Aconitase
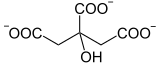
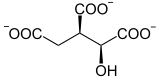
L’aconitase (ou aconitate hydratase ou ACO), est une Isomerase qui catalyse la réaction :
| Aconitase | ||
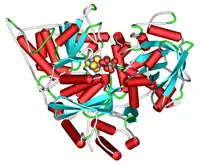 Structure d'une aconitase bovine (PDB 1AMI[1]) | ||
| Caractéristiques générales | ||
|---|---|---|
| Nom approuvé | Aconitase 1 | |
| Symbole | ACO1 | |
| N° EC | 4.2.1.3 | |
| Homo sapiens | ||
| Locus | 9p21.1 | |
| Masse moléculaire | 98 399 Da[2] | |
| Nombre de résidus | 889 acides aminés[2] | |
| Liens accessibles depuis GeneCards et HUGO. | ||
| Aconitase mitochondriale | ||
| Caractéristiques générales | ||
| Nom approuvé | Aconitase 2 | |
| Symbole | ACO2 | |
| N° EC | 4.2.1.3 | |
| Homo sapiens | ||
| Locus | 22q13.2 | |
| Masse moléculaire | 85 425 Da[2] | |
| Nombre de résidus | 780 acides aminés[2] | |
| Liens accessibles depuis GeneCards et HUGO. | ||
| N° EC | EC |
|---|---|
| N° CAS | |
| Cofacteur(s) | Fe-S |
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
| GO | AmiGO / EGO |
Cette enzyme intervient notamment dans le cycle de Krebs pour réaliser l'isomérisation stéréospécifique du citrate en isocitrate via le cis-aconitate[3] - [4] - [5]. La réaction d'isomérisation implique une déshydratation suivie d'une réhydratation afin de translater l'atome d'oxygène de l'hydroxyle de part et d'autre d'une double liaison transitoire.
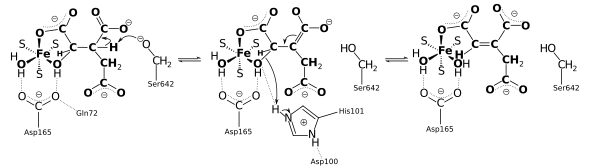
Contrairement à la plupart des protéines fer-soufre, qui fonctionnent comme transporteurs d'électrons, le centre fer-soufre de l'aconitase réagit directement avec le substrat de l'enzyme.
Structure
L'aconitase présente deux configurations légèrement différentes selon qu'elles activée ou inactivée[6] - [7].
La forme inactive contient quatre domaines[6]. Seuls les trois premiers domaines à partir de l'extrémité N-terminale interagissent étroitement avec les centre [3Fe-4S], mais le site actif fait intervenir des résidus des quatre domaines, y compris le grand domaine C-terminal. Le centre Fe-S et un anion SO42− se logent également dans le site actif[6].
Lorsque l'enzyme est activée, elle acquiert un atome de fer supplémentaire pour former un centre [4Fe-4S][7] - [8], tandis que la structure du reste de l'enzyme demeure quasiment inchangée, avec une translation des autres atomes n'excédant pas 10 pm[7].
Régulation
L'aconitase a un centre actif [Fe4S4]2+ qui peut se convertir en une forme inactive [Fe3S4]+. Trois résidus de cystéine ont été identifiés comme ligands du centre [Fe4S4]. Dans la forme active de ce cluster, le cation de fer labile est coordonné à des molécules d'eau et non à des résidus de cystéine de l'enzyme.

L'aconitase est inhibée par l'anion fluoroacétate FCH2COO−, présent notamment dans le fluoroacétate de sodium FCH2COONa, qui agit donc comme un poison. Le centre fer-soufre est très sensible à l'oxydation par les anions superoxyde O2−[9].
Dénominations alternatives
- cis-Aconitase.
- Citrate hydro-lyase.
- Citrate(isocitrate) hydro-lyase.
- Protéine régulatrice du fer ou IRP1 (pour ACO1)
Isoenzymes
Il existe plusieurs isoenzymes de l'aconitase :
- ACO1 : présente dans le cytosol. En plus de sa fonction aconitase, ACO1 joue un rôle important comme protéine régulatrice du fer dans la cellule. La décomplexation de cette enzyme avec son agrégat fer-soufre [Fe4S4] provoque un changement de sa conformation spatiale, lui conférant une activité régulatrice post-transcriptionnelle. Elle peut alors se fixer sur les éléments de réponse au fer présents dans les régions non-traduites d'ARN messagers impliqués dans le contrôle de l'homéostasie du fer.
- ACO2 : présente dans la mitochondrie. Cette enzyme est exprimée dans tous les types cellulaires[10]. La région 5'UTR de son ARN messager contient un IRE, permettant une régulation de la traduction par les protéines régulatrices du fer[10].
- ACO3 : chez la plante Arabidopsis thaliana, il existe une troisième forme d'aconitase : ACO3[11].
Notes et références
- (en) Hanspeter Lauble, M. Claire Kennedy, Helmut Beinert et C. David Stout, « Crystal Structures of Aconitase with Trans-aconitate and Nitrocitrate Bound », Journal of Molecular Biology, vol. 237, no 4, , p. 437-451 (PMID 8151704, DOI 10.1006/jmbi.1994.1246, lire en ligne)
- Les valeurs de la masse et du nombre de résidus indiquées ici sont celles du précurseur protéique issu de la traduction du gène, avant modifications post-traductionnelles, et peuvent différer significativement des valeurs correspondantes pour la protéine fonctionnelle.
- (en) H. Beinert, M. C. Kennedy, « Aconitase, a two-faced protein: enzyme and iron regulatory factor », FASEB J., vol. 7, no 15, , p. 1442-1449 (PMID 8262329)
- (en) D. H. Flint, R. M. Allen, « Iron-Sulfur Proteins with Nonredox Functions », Chem. Rev., vol. 96, no 7, , p. 2315-2334 (PMID 11848829, DOI 10.1021/cr950041r)
- (en) H. Beinert, M. C. Kennedy, C. D. Stout, « Aconitase as Iron-Sulfur Protein, Enzyme, and Iron-Regulatory Protein », Chem. Rev., vol. 96, no 7, , p. 2335-2374 (PMID 11848830, DOI 10.1021/cr950040z)
- (en) A. H. Robbins et C. D. Stout, « The structure of aconitase », Proteins, vol. 5, no 4, , p. 289-312 (PMID 2798408, DOI 10.1002/prot.340050406, lire en ligne)
- (en) A. H. Robbins et C. D. Stout, « Structure of activated aconitase: formation of the [4Fe-4S] cluster in the crystal », Proceedings of the National Academy of Sciences of the United States of America, vol. 86, no 10, , p. 3639-3643 (PMID 2726740, PMCID 287193, DOI 10.1073/pnas.86.10.3639, lire en ligne)
- (en) H. Lauble, M. C. Kennedy, H. Beinert et C. D. Stout, « Crystal structures of aconitase with isocitrate and nitroisocitrate bound », Biochemistry, vol. 31, no 10, , p. 2735-2748 (PMID 1547214, DOI 10.1021/bi00125a014, lire en ligne)
- (en) P. R. Gardner, « Aconitase: sensitive target and measure of superoxide », Meth. Enzymol., vol. 349, , p. 9-23 (PMID 11912933, DOI 10.1016/S0076-6879(02)49317-2)
- (en) D. B. Mirel, K. Marder et al., « Characterization of the human mitochondrial aconitase gene (ACO2) », Gene, vol. 213, nos 1-2, (ISSN 0378-1119, DOI 10.1016/S0378-1119(98)00188-7)
- (en) M. A. Hooks, J. W. Allwood et al., « Selective induction and subcellular distribution of ACONITASE 3 reveal the importance of cytosolic citrate metabolism during lipid mobilization in Arabidopsis », Biochem. J., vol. 463, no 2, , p. 309--317 (PMID 25061985, DOI 10.1042/BJ20140430)