Oxyde de carbone
Un oxyde de carbone est un composé chimique constitué d'une combinaison d'atomes de carbone et d'oxygène uniquement[alpha 1] - [1] - [2].
Les plus simples et les plus communs des oxydes de carbone sont le monoxyde de carbone, CO, et le dioxyde de carbone, CO2. Beaucoup d'autres oxydes de carbone stables, métastables ou hypothétiques sont connus mais sont rarement rencontrés comme le suboxyde de carbone C3O2, ou l'anhydride mellitique C12O9, voire très rarement, comme le monoxyde de tricarbone C3O, ou l'évanescent tétroxyde de carbone CO4.
 |
 | ||||
| CO monoxyde de carbone |
CO2 dioxyde de carbone |
C3O2 suboxyde de carbone |
C12O9 anhydride mellitique |
C3O monoxyde de tricarbone |
CO4 tétroxyde de carbone |
Bien que les manuels de chimie n'affichent souvent que les trois premiers et, rarement, le quatrième, un grand nombre d'autres oxydes de carbone sont aujourd'hui connus, la plupart d'entre eux synthétisés depuis les années 1960. Certains de ces nouveaux oxydes sont stables à température ambiante. Certains, en revanche, sont métastables ou stables uniquement à des températures très basses et se décomposent en oxydes de carbone simples quand ils sont chauffés. Beaucoup sont instables par nature et ne peuvent être observés que momentanément en tant qu'intermédiaires dans des réactions chimiques, ou sont si réactifs qu'ils ne peuvent exister qu'au sein d'une phase gazeuse ou dans des conditions d'isolement en matrice.
L'inventaire des oxydes de carbone semble s'accroître constamment. L'existence de l'oxyde de graphène et d'autres oxydes de carbone polymériques stables avec des structures moléculaires sans borne[3] - [4] suggère que beaucoup d'autres restent encore à découvrir.
Vue d'ensemble
Le dioxyde de carbone, CO2, est très fréquent dans la nature, où il est produit notamment par la respiration des êtres vivants ainsi que par la combustion de substances contenant du carbone. C'est une étape essentielle des formes du carbone au cours du cycle du carbone sur Terre et celle sous laquelle il est capté par les plantes. Il a été progressivement reconnu comme un composé chimique, appelé autrefois Sylvestre spiritus (« esprit sauvage ») ou « air fixe » par divers chimistes des XVIIe et XVIIIe siècles[5], et encore fréquemment gaz carbonique.
Le monoxyde de carbone, CO, peut être aussi produit lors d'une combustion et a été utilisé (quoi qu'étant non reconnu) depuis l'Antiquité pour la fonte du fer de ses minerais. Comme le dioxyde de carbone, il a été décrit et étudié en Europe par divers alchimistes et chimistes depuis le Moyen Âge. Sa composition chimique a été découverte par William Cruikshank en 1800.
Le suboxyde de carbone[6], C3O2, a été découvert par Benjamin Collins Brodie en 1873 en faisant passer du courant électrique dans du dioxyde de carbone[7].
Le quatrième oxyde de carbone « classique », l'anhydride mellitique, C12O9, a été apparemment obtenu par Justus von Liebig et Friedrich Wöhler en 1830 pendant leur étude de la mellite (pierre miel)[8], mais n'a été caractérisé qu'en 1913 par Hans Meyer et Karl Steiner[9] - [10].
Brodie a aussi découvert en 1859 un sixième composé appelé oxyde de graphite, composé de carbone et d'oxygène dans des ratios variant de 2:1 à 3:1, mais la nature et la structure moléculaire de cette substance sont restées inconnues jusque dans les années 2000 quand il a été renommé oxyde de graphène et est devenu un sujet de recherche dans les nanotechnologies[3].
Des exemples notables d'oxydes instables ou métastables qui ne sont détectés que dans des situations extrêmes sont le radical monoxyde de dicarbone :C=C=O, le trioxyde de carbone CO3[11], le tétroxyde de carbone CO4[12] - [13] et la 1,2-dioxétanedione C2O4[14] - [15]. Certains de ces oxydes de carbone réactifs ont été détectés dans les nuages moléculaires du milieu interstellaire par spectroscopie rotationnelle[16].
Beaucoup d'oxydes de carbone hypothétiques ont été étudiés par des méthodes théoriques mais n'ont pas encore été détectés. Des exemples en sont l'anhydride oxalique C2O3 ou O=(cyclo-C2O)=O, l'éthènedione C2O2 ou O=C=C=O[17], les autres polycétones, polymères linéaires ou cycliques de monoxyde de carbone, (-CO-)n[18] et ceux du dioxyde de carbone (-CO2-)n comme le dimère 1,3-dioxétanedione C2O4[19] et le trimère 1,3,5-trioxanetrione C3O6[19] - [20].
 |
 |
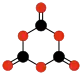 |
||
| C2O3 anhydride oxalique |
C2O4 1,2-dioxétane- dione |
C2O4 1,3-dioxétane- dione |
C3O6 1,3,5-trioxane- trione |
C2O2 éthènedione |
Structure générale
Habituellement, le carbone est tétravalent, tandis que l'oxygène est divalent et dans la plupart des oxydes de carbone comme dans la plupart des composés du carbone, l'atome de carbone peut alors être lié à quatre autres atomes, tandis que l'atome d'oxygène ne peut être lié au plus qu'à deux atomes. De plus, tandis que le carbone peut former des chaînes arbitrairement longues ou des réseaux, les chaînes de trois oxygènes consécutifs ou plus sont rarement, sinon jamais, observées. Ainsi les oxydes de carbone électriquement neutres connus consistent en un ou plusieurs squelettes carbonés, incluant les structures cycliques et aromatiques, connectés et clos par des groupes oxo, -O- ou =O, et peroxo, -O-O-.
Des atomes de carbone non tétravalents mais divalents sont trouvés dans certains oxydes, comme les biradiraux, monoxyde de carbone, CO ou :C=O, monoxyde de dicarbone, C2O ou :C=C=O, et monoxyde de tricarbone, C3O ou :C=C=C=O, mais à part le premier, ces oxydes sont généralement trop réactifs pour être séparés en quantité[21]. La perte ou le gain d'électrons peut produire des oxygènes chargés négativement et monovalents, –O−, des oxygènes chargés positivement et trivalents, ≡O+ ou encore des atomes de carbone chargés négativement et trivalents, ≡C−. Ces deux dernières formes se rencontrent dans le monoxyde de carbone, −C≡O+[22] alors que les atomes d'oxygène chargés négativement apparaissent dans les oxocarbones anioniques (en).
Dioxydes de carbone linéaires
Une des familles d'oxydes de carbone a la formule générale CnO2, ou O=(C=)nO, c'est-à-dire qu'il s'agit d'une chaîne linéaire d'atomes de carbone sp2 chapeautée à chaque bout par un atome d'oxygène. Les premiers composés sont les suivants :
- CO2 ou O=C=O, le dioxyde de carbone ;
- C2O2 ou O=C=C=O, l'extrêmement instable éthènedione[17] ;
- C3O2 ou O=C=C=C=O, le métastable suboxyde de carbone ou dioxyde de tricarbone ;
- C4O2 ou O=C=C=C=C=O, le dioxyde de tétracarbone ou la butatriène-1,4-dione[23] ;
- C5O2 ou O=C=C=C=C=C=O, le dioxyde de pentacarbone[24], stable en solution à température ambiante et pur jusqu'à −90 °C[25].
Des membres de cette famille ont été détectés à l'état de trace dans des expériences en phase gazeuse à basse pression ou en matrice cryogénique, spécifiquement pour n = 7[25] et pour n = 17, n = 19 et n = 21[26].
Monoxydes de carbone linéaires
Les monoxydes de carbone linéaires, CnO, forment une autre famille d'oxydes de carbone. Son premier membre, le monoxyde de carbone, CO, semble être le seul qui soit stable à l'état pur et à température ambiante[alpha 2]. La photolyse des dioxydes de carbone dans une matrice cryogénique induit la perte d'une unité CO, entraînant des quantités détectables de monoxydes avec n pair comme C2O, C4O[21] et C6O[25]. Les composés jusqu'à n = 9 ont aussi été obtenus par décharges électriques sur du suboxyde de carbone dilué dans de l'argon[27]. Les trois premiers composés de cette famille ont été détectés dans le milieu interstellaire[27].
Quand n est pair, les molécules sont censées être dans un état triplet du type cumulène, avec tous les atomes connectés avec des doubles liaisons et une orbitale moléculaire vide sur le premier carbone comme dans :C=C=O, :C=C=C=C=O et, en général, :(C=)2m=O. Quand n est impair, la structure triplet (radicalaire) est estimée en résonance avec un état singulet du type acétylène, polaire avec une charge négative sur le carbone terminal et une charge positive sur l'oxygène à l'autre bout comme dans −C≡C-C≡O+, −C≡C-C≡C-C≡O+ et, en général, −(C≡C-)2mC≡O+[27]. Le monoxyde de carbone suit cette tendance : sa forme prédominante est considérée comme étant −C≡O+[22].
Polycétones cycliques de type radialène
Une autre famille d'oxydes de carbone méritant une attention spéciale est celle des oxydes de carbone cycliques de type radialène de formule générale CnOn ou (CO)n[28]. Ils peuvent être vus comme étant des oligomères cycliques du monoxyde de carbone ou comme des n-uples cétones de cycloalcanes à n carbones. Le monoxyde de carbone peut être vu comme le premier composé de cette famille (n = 1). Des études théoriques indiquent que l'éthènedione, C2O2 ou O=C=C=O, et la cyclopropanetrione, C3O3, ne peuvent exister[17] - [18]. Les trois composés suivants, C4O4, C5O5 et C6O6 sont théoriquement possibles mais probablement peu stables[18] et jusqu'à maintenant, ils n'ont été synthétisés qu'en minuscules quantités[29] - [30].
 |
 |
 |
 |
| (CO)3 cyclopropane- trione |
(CO)4 cyclobutane- tétrone |
(CO)5 cyclopentane- pentone |
(CO)6 cyclohexane- hexone |
D'un autre côté, les anions de ces oxydes de carbone sont relativement stables et certains d'entre eux sont connus depuis le XIXe siècle[28] :
| Formule chimique | Nomenclature IUPAC | Chimiste(s) | Année de la découverte |
|---|---|---|---|
| C2O22− | éthynediolate[31] | Bücher & Weiss | 1963 |
| C3O32− | deltate[32] - [33] | Eggerding & West | 1976 |
| C4O42− | squarate[34] | Cohen & al. | 1959 |
| C5O52− | croconate[35] | Gmelin | 1825 |
| C6O62− | rhodizonate[36] | Heller | 1837 |
L'oxyde cyclique C6O6 forme aussi les anions stables de la tétrahydroxybenzoquinone (C6O64−) et du hexahydroxybenzène (C6O66−)[37]. L'aromaticité de ces anions a été étudiée par des méthodes théoriques[38] - [39].
Nouveaux oxydes de carbone
Beaucoup de nouveaux oxydes de carbone stables ou métastables ont été synthétisés depuis les années 1960 comme (dans l'ordre chronologique) :
| Formule | Nomenclature IUPAC | Commentaire | Découverte | Formule développée (image) | |
|---|---|---|---|---|---|
| Chimiste | Année | ||||
| C10O8 | dianhydride 1,4-benzoquinonetétracarboxylique[40] | Hammond | 1963 |  | |
| C6O6 | dianhydride éthylènetétracarboxylique | isomère stable de la cyclohexanehexone[41]. | Sauer & al. | 1967 |  |
| C12O12 ou C6(C2O4)3 |
trisoxalate d'hexahydroxybenzène | stable sous forme de solvate de tétrahydrofurane[42]. | Verter & Dominic | 1967 |  |
| C10O10 ou C6O2(C2O4)2 |
bisoxalate de tétrahydroxy-1,4-benzoquinone | stable sous forme de solvate de tétrahydrofurane[43]. | Verter & al. | 1968 |  |
| C8O8 ou C6O2(CO3)2 |
biscarbonate de tétrahydroxy-1,4-benzoquinone | se décompose vers 45–53 °C[44]. | Nallaiah | 1984 |  |
| C9O9 ou C6(CO3)3 |
triscarbonate d'hexahydroxybenzène | se décompose vers 45–53 °C[44]. | Nallaiah | 1984 |  |
| C24O6 | tris(3,4-diéthynyl-3-cyclobutène-1,2-dione) | un trimère cyclique du biradical 3,4-diéthynyl-3-cyclobutène-1,2-dione ▪C≡C-(C4O2)-C≡C▪[45] | Rubin & al. | 1990 | 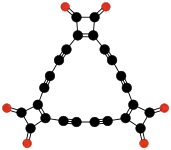 |
| C32O8 | tétrakis(3,4-diéthynyl-3-cyclobutène-1,2-dione) | un tétramère du radical 3,4-diéthynyl-3-cyclobutène-1,2-dione[45] | Rubin & al. | 1990 |  |
| C4O6 | dioxanetétracétone ou dimère de l'anhydride oxalique | stable dans Et2O à −30 °C, mais se décompose à 0 °C[46]. | Strazzolini & al. | 1998 |  |
| C12O6 | hexaoxotricyclobutabenzène[47] - [48] | Hamura & al. | 2006 |  | |
De nombreux composés proches de ces oxydes ont été étudiés théoriquement et certains devraient être stables, comme les esters carbonate et oxalate de la tétrahydroxy-1,2-benzoquinone et des acides rhodizonique, croconique, squarique et deltique[18].
Oxydes de carbone polymériques
Le suboxyde de carbone polymérise spontanément à température ambiante en polymère carbone-oxygène de ratio atomique 3:2[4] - [49]. Le polymère est considéré comme une chaîne linéaire de lactones, à 6 atomes, fusionnées, avec une ossature continue de carbone constituée d'une alternance de liaisons simples et doubles. Des mesures physiques indiquent que le nombre moyen d'unités par molécule est d'environ 5-6, dépendant de la température de formation[4] - [49].
 1 |
2 |
3 |
 4 |
| Unités de terminaison et de constitution du C3O2 polymérique[4]. À noter que les unités 1 et 4 et, identiquement, 2 et 3 sont identiques (sous différents angles, sur la figure) et donc que deux unités chimiques suffisent pour décrire les oligomères et polymères de C3O2. | |||
 |
 |
 |
 |
| Oligomères de C3O2 de 3 à 6 unités[4]. | |||
En comprimant du monoxyde de carbone à 5 GPa dans une cellule à enclumes de diamant, un polymère rougeâtre assez similaire avec une teneur en oxygène légèrement plus élevée est obtenu[50] - [51]. Il est métastable à température et pression ambiantes. Le CO dismuterait dans la cellule, créant un mélange de CO2 et de C3O2, ce dernier formant un polymère similaire à celui obtenu par polymérisation spontanée du C3O2, décrit ci-dessus, mais avec une structure plus irrégulière et qui piège en son sein une partie du CO2[50] - [51].
Un autre polymère carbone-oxygène avec un ratio C:O de 2:1 ou plus, est le classique oxyde de graphite[3] et sa version monocouche, l'oxyde de graphène.
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Oxocarbon » (voir la liste des auteurs).
Notes
Références
- (en) M. Nic, J. Jirat, B. Kosata, « IUPAC. Compendium of Chemical Terminology - Oxocarbons », sur IUPAC Gold Book, Blackwell Scientific Publications, (consulté le )
- (en) R. West, Oxocarbons, New York, Academic Press, , 235 p. (ISBN 0-12-744580-3)
- (en) William S. Hummers Jr. et Richard E. Offeman, « Preparation of Graphitic Oxide », J. Am. Chem. Soc., vol. 80, no 6, , p. 1339-1339 (ISSN 0002-7863, DOI 10.1021/ja01539a017)
- (en) A. W. Snow, H. Haubenstock et N.-L. Yang, « Poly(carbon suboxide). Characterization, Polymerization, and Radical Structure », Macromolecules, vol. 11, no 1, , p. 77-86 (ISSN 0024-9297, DOI 10.1021/ma60061a015)
- (en) Ebbe Almqvist, History of industrial gases, Dordrecht/London, Springer, , 472 p. (ISBN 0-306-47277-5, lire en ligne), p. 93-108
- (en) L. H. Reyerson et Kenneth Kobe, « Carbon Suboxide », Chem. Rev., vol. 7, no 4, , p. 479–492 (ISSN 0009-2665, DOI 10.1021/cr60028a002)
- (en) B. C. Brodie, « Note on the Synthesis of Marsh-Gas and Formic Acid, and on the Electric Decomposition of Carbonic Oxide », Proc. R. Soc. Lond., vol. 21, , p. 245-247 (ISSN 0370-1662, DOI 10.1098/rspl.1872.0052, lire en ligne)
- (de) F. Wohler, « Ueber die Honigsteinsäure », Ann. Phys. Chem., vol. 83, no 7, , p. 325–334 (lire en ligne)
- (de) Hans Meyer et Karl Steiner, « Über ein neues Kohlenoxyd C12O9 », Ber. Dtsch. Chem. Ges., vol. 46, no 1, , p. 813-815 (ISSN 0365-9496, DOI 10.1002/cber.191304601105)
- (de) Bugge, « Ein neues Kohenoxyd », Naturwissenschaftliche Wochenschrift, vol. 13, no 12, , p. 188 (lire en ligne)
- (en) William B. DeMore et C. W. Jacobsen, « Formation of carbon trioxide in the photolysis of ozone in liquid carbon dioxide », J. Phys. Chem., vol. 73, no 9, , p. 2935-2938 (DOI 10.1021/j100843a026)
- (en) Laurence Y. Yeung, Mitchio Okumura, Jeffrey T. Paci, George C. Schatz, Jianming Zhang et Timothy K. Minton, « Hyperthermal O-Atom Exchange Reaction O2 + CO2 through a CO4 Intermediate », J. Am. Chem. Soc., vol. 131, no 39, , p. 13940–13942 (ISSN 0002-7863, DOI 10.1021/ja903944k)
- (en) Corey S. Jamieson, Alexander M. Mebel et Ralf I. Kaiser, « Novel detection of the C-2v isomer of carbon tetraoxide (CO4) », Chem. Phys. Lett., vol. 440, nos 1-3, , p. 105-109 (ISSN 0009-2614, DOI 10.1016/j.cplett.2007.04.043)
- (en) Herman F. Cordes, Herbert P. Richter et Carl A. Heller, « Mass spectrometric evidence for the existence of 1,2-dioxetanedione (carbon dioxide dimer). Chemiluminescent intermediate », J. Am. Chem. Soc., vol. 91, no 25, , p. 7209 (ISSN 0002-7863, DOI 10.1021/ja01053a065)
- (en) Richard Bos, Neil W. Barnett, Gail A. Dyson, Kieran F. Lim, Richard A. Russell et Simon P. Watson, « Studies on the mechanism of the peroxyoxalate chemiluminescence reaction: Part 1. Confirmation of 1,2-dioxetanedione as an intermediate using 13C nuclear magnetic resonance spectroscopy », Anal. Chim. Acta., vol. 502, no 2, , p. 141-147 (ISSN 0003-2670, DOI 10.1016/j.aca.2003.10.014)
- (en) H. M. Pickett, E. A. Cohen, B. J. Drouin et J. C. Pearson, Submillimeter, Millimeter, and Microwave Spectral Line Catalog, JPL, , 359 p. (lire en ligne)
- (en) Detlef Schröder, Christoph Heinemann, Helmut Schwarz, Jeremy N. Harvey, Suresh Dua, Stephen J. Blanksby et John H. Bowie, « Ethylenedione: An Intrinsically Short-Lived Molecule », Chem. Eur. J., vol. 4, no 12, , p. 2550-2557 (ISSN 0947-6539, DOI 10.1002/(SICI)1521-3765(19981204)4:12<2550::AID-CHEM2550>3.0.CO;2-E)
- (en) Haijun Jiao et Hai-Shun Wu, « Are Neutral Oxocarbons Stable? », J. Org. Chem., vol. 68, no 4, , p. 1475–1479 (ISSN 0022-3263, DOI 10.1021/jo026243m)
- (en) Errol Lewars et Hai-Shun Wu, « Polymers and oligomers of carbon dioxide: ab initio and semiempirical calculations », J. Mol. Struct. THEOCHEM, vol. 363, no 1, , p. 1-15 (ISSN 0166-1280, DOI 10.1016/0166-1280(95)04420-5)
- (en) Matthew L. Shirel et Peter Pulay, « Stability of Novel Oxo- and Chloro-Substituted Trioxanes », J. Am. Chem. Soc., vol. 121, no 37, , p. 8544-8548 (ISSN 0002-7863, DOI 10.1021/ja984451j)
- (en) Günter Maier et Hans Peter Reisenauer, Advances in carbene chemistry : Carbenes in Matrices: Specrospcopy, Structure, and Photochemical Behavior, vol. 3, Elsevier Science, , 332 p. (ISBN 0-444-50892-9), p. 135
- (de) Werner Kutzelnigg, Einführung in die Theoretische Chemie, Weinheim, Wiley-VCH, , 1re éd., 896 p. (ISBN 3-527-30609-9)
- (en) Günther Maier, Hans Peter Reisenauer, Heinz Balli, Willy Brandt et Rudolf Janoschek, « C4O2 (1,2,3-Butatriene-1,4-dione), the First Dioxide of Carbon with an Even Number of C Atom », Angew. Chem. Int. Ed., vol. 29, no 8, , p. 905-908 (ISSN 1433-7851, DOI 10.1002/anie.199009051)
- (en) Günther Maier, Hans Peter Reisenauer, Ulrich Schäfer et Heinz Balli, « C5O2 (1,2,3,4-Pentatetraene-1,5-dione), a New Oxide of Carbon », Angew. Chem. Int. Ed., vol. 27, no 4, , p. 566-568 (ISSN 1433-7851, DOI 10.1002/anie.198805661)
- (en) Frank W. Eastwood, Gas Phase Pyrolytic Methods for the Preparation of Carbon-Hydrogen and Carbon-Hydrogen-Oxygen Compounds, CRC Press, , 309 p. (ISBN 90-5699-081-0), p. 97
- (de) Roman Reusch, Thèse : Absorptionsspektroskopie von langen Kohlenstoff-Kettenmolekülen und deren Oxide in kryogenen Matrizen, Heidelberg, Université de Heidelberg, , 122 p. (lire en ligne), p. 95
- (en) Teruhiko Ogata et Yoshio Tatamitani, « The Simplest Linear-Carbon-Chain Growth by Atomic-Carbon Addition and Ring Opening Reactions », J. Phys. Chem. A, vol. 1123, no 43, , p. 10713-10715 (ISSN 1089-5639, DOI 10.1021/jp806725s)
- (en) Gunther Seitz et Peter Imming, « Oxocarbons and pseudooxocarbons », Chem. Rev., vol. 92, no 6, , p. 1227–1260 (ISSN 0009-2665, DOI 10.1021/cr00014a004)
- (en) Detlef Schröder, Helmut Schwarz, Suresh Dua, Stephen J. Blanksby et John H. Bowie, « Mass spectrometric studies of the oxocarbons CnOn (n = 3-6) », Int. J. Mass Spectrom., vol. 188, nos 1-2, , p. 17-25 (ISSN 1387-3806, DOI 10.1016/S1387-3806(98)14208-2)
- (en) Richard B. Wyrwas et Caroline Chick Jarrold, « Production of C6O6 from Oligomerization of CO on Molybdenum Anions », J. Am. Chem. Soc., vol. 128, no 42, , p. 13688-13689 (ISSN 0002-7863, DOI 10.1021/ja0643927)
- (en) Werner Büchner et E. Weiss, « Zur Kenntnis der sogenannten «Alkalicarbonyle» I Die Kristallstruktur des Kalium-acetylendiolats, KOC≡COK », Helv. Chim. Acta, vol. 46, no 4, , p. 1121-1127 (ISSN 0018-019X, DOI 10.1002/hlca.19630460404)
- (en) David Eggerding et Robert West, « Synthesis of Dihydroxycyclopropenone (Deltic Acid) », J. Am. Chem. Soc., vol. 97, no 1, , p. 207-208 (ISSN 0002-7863, DOI 10.1021/ja00834a047)
- (en) David Eggerding et Robert West, « Synthesis and Properties of Deltic Acid (Dihydroxycyclopropenone) and the Deltate Ion », J. Am. Chem. Soc., vol. 98, no 12, , p. 207-208 (ISSN 0002-7863, DOI 10.1021/ja00428a043)
- (en) Sidney Cohen, John R. Lacher et Joseph D. Park, « Diketocyclobutanediol », J. Am. Chem. Soc., vol. 81, no 13, , p. 3480 (ISSN 0002-7863, DOI 10.1021/ja01522a083)
- (de) Leopold Gmelin, « Ueber einige merkwürdige, bei der Darstellung des Kaliums nach der Brunner'schen Methode, erhaltene Substanzen », Ann. Phys. Chem., vol. 4, , p. 31-62 (lire en ligne)
- (de) Johann Florian Heller, « Die Rhodizonsäure, eine aus den Produkten der Kaliumbereitung gewonnene neue Säure, und ihre chemischen Verhältnisse », Annalen der Pharmacie, vol. 24, no 1, , p. 1-17 (ISSN 0365-5490, DOI 10.1002/jlac.18370240102, lire en ligne)
- (en) Haiyan Chen, Michel Armand, Matthieu Courty, Meng Jiang, Clare P. Grey, Franck Dolhem, Jean-Marie Tarascon et Philippe Poizot, « Lithium Salt of Tetrahydroxybenzoquinone: Toward the Development of a Sustainable Li-Ion Battery », J. Am. Chem. Soc., vol. 131, no 25, , p. 8984–8988 (ISSN 0002-7863, DOI 10.1021/ja9024897)
- (en) Robert West et J. Niu, Non-benzenoid aromatics, vol. 1, New York, Academic Press,
- (en) Paul von Ragué Schleyer, Katayoun Najafian, Boggavarapu Kiran et Haijun Jiao, « Are Oxocarbon Dianions Aromatic? », J. Org. Chem., vol. 65, no 2, , p. 426–431 (ISSN 0022-3263, DOI 10.1021/jo991267n)
- (en) P. R. Hammond, « 1,4-Benzoquinone Tetracarboxylic Acid Dianhydride, C10O8: A Strong Acceptor », Science, vol. 142, no 3591, , p. 502 (ISSN 0036-8075, DOI 10.1126/science.142.3591.502)
- (de) Jürgen Sauer, Barbara Schröder et Richard Wiemer, « Eine Studie der Diels-Alder-Reaktion, VI. Kinetischer Nachweis des Moleküls C6O6 (Dianhydrid der Äthylentetracarbonsäure) », Chem. Ber., vol. 100, no 1, , p. 306-314 (ISSN 0009-2940, DOI 10.1002/cber.19671000135)
- (en) H. S. Verter et R. Dominic, « A new carbon oxide: synthesis of hexahydroxybenzene tris oxalate », Tetrahedron, vol. 23, no 10, , p. 8984–8988 (ISSN 0040-4020, DOI 10.1016/S0040-4020(01)97894-9)
- (en) H. S. Verter, H. Porter et R. Dominic, « A new carbon oxide: synthesis of tetrahydroxybenzoquinone bisoxalate », Chem. Commun., , p. 973b-974 (ISSN 1359-7345, DOI 10.1039/C1968000973b)
- (en) C. Nallaiah, « Synthesis of tetrahydroxy-1,4-benzoquinone biscarbonate and hexahydroxybenzene triscarbonate - new organic carbon oxides », Tetrahedron, vol. 40, no 23, , p. 4897-4900 (ISSN 0040-4020, DOI 10.1016/S0040-4020(01)91324-9)
- (en) Yves Rubin, Carolyn B. Knobler et François Diederich, « Precursors to the cyclo[n]carbons: from 3,4-dialkynyl-3-cyclobutene-1,2-diones and 3,4-dialkynyl-3-cyclobutene-1,2-diols to cyclobutenodehydroannulenes and higher oxides of carbon », J. Am. Chem. Soc., vol. 112, no 4, , p. 1607-1617 (ISSN 0002-7863, DOI 10.1021/ja00160a047)
- (en) Paolo Strazzolini, Alberto Gambi, Angelo G. Giumanini et Hrvoj Vancik, « The reaction between ethanedioyl (oxalyl) dihalides and Ag2C2O4: a route to Staudinger’s elusive ethanedioic (oxalic) acid anhydride », J. Chem. Soc., Perkin Trans. 1, , p. 2553-2558 (ISSN 0300-922X, DOI 10.1039/a803430c)
- (en) Toshiyuki Hamura, Yousuke Ibusuki, Hidehiro Uekusa, Takashi Matsumoto, Jay S. Siegel, Kim K. Baldridge et Keisuke Suzuki, « Dodecamethoxy- and Hexaoxotricyclobutabenzene: Synthesis and Characterization », J. Am. Chem. Soc., vol. 128, no 31, , p. 10032-10033 (ISSN 0002-7863, DOI 10.1021/ja064063e)
- (en) Holger Butenschön, « A new oxocarbon C12O6 via highly strained benzyne intermediates », Angew. Chem. Int. Ed., vol. 46, no 22, , p. 4012-4014 (ISSN 1433-7851, DOI 10.1002/anie.200700926)
- (en) B. D. Kybett, G. K. Johnson, C. K. Barker et J. L. Margrave, « The Heats of Formation and Polymerization of Carbon Suboxide », J. Phys. Chem., vol. 69, no 10, , p. 3603-3606 (DOI 10.1021/j100894a060)
- (en) Allen I. Katz, David Schiferl et Robert L. Mills, « New phases and chemical reactions in solid carbon monoxide under pressure », J. Phys. Chem., vol. 88, no 15, , p. 3176-3179 (DOI 10.1021/j150659a007)
- (en) W. J. Evans, M. J. Lipp, C.-S. Yoo, H. Cynn, J. L. Herberg, R. S. Maxwell et M. F. Nicol, « Pressure-Induced Polymerization of Carbon Monoxide: Disproportionation and Synthesis of an Energetic Lactonic Polymer », Chem. Mater., vol. 18, no 10, , p. 2520-2531 (ISSN 0897-4756, DOI 10.1021/cm0524446)