Tétrahydroxy-1,4-benzoquinone
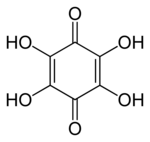
La tétrahydroxy-1,4-benzoquinone aussi appelée tétrahydroxy-p-benzoquinone, tétrahydroxybenzoquinone et même tétrahydroxyquinone (THBQ, THQ) est un composé organique de formule C6O2(OH)4. Cette molécule est composé d'un cycle cyclohexadiène avec, comme substituants, quatre groupes hydroxyle et deux groupes cétone en positions opposées c'est-à-dire "para".
| Tétrahydroxy-1,4-benzoquinone | |
| |
| Identification | |
|---|---|
| Nom UICPA | 2,3,5,6-tétrahydroxycyclohexa-2,5-diène-1,4-dione |
| No CAS | (hydrate) |
| No ECHA | 100.005.706 |
| PubChem | 5424 |
| SMILES | |
| InChI | |
| Apparence | cristaux bleu-noir[1] |
| Propriétés chimiques | |
| Formule | C6H4O6 [Isomères] |
| Masse molaire[2] | 172,092 4 ± 0,006 9 g/mol C 41,88 %, H 2,34 %, O 55,78 %, |
| Propriétés physiques | |
| T° fusion | >300 °C[3] |
| Solubilité | peu soluble dans l'eau |
| Précautions | |
| SGH[3] | |
 |
|
| Unités du SI et CNTP, sauf indication contraire. | |
Ce composé donne des solutions aqueuses rouge clair[4] et forme des cristaux avec un éclat bleu-noir mais non conducteurs du dihydrate C6O2(OH)4·2H2O[5] - [4].
La tétrahydroxy-1,4-benzoquinone peut être synthétisée de l'éthanedial[6] ou de l'inositol, un composé naturel largement présent dans des plantes[7].
La THBQ forme un adduit de ratio 2:3 avec la 4,4'-bipyridine[8].
Sels de la tétrahydroxy-1,4-benzoquinone
Comme la plupart des phénols, THBQ est acide et perd facilement les protons, H+ de ses groupes hydroxyles pour former des anions comme C6H2O62− et C6O64−. Ce dernier est parfaitement symétrique et aromatique, les doubles liaisons et les charges négatives étant uniformément réparties sur le six unités CO.
Le sel de calcium, Ca2C6O6 est un pigment pourpre foncé produit de l'inositol par Chromohalobacter beijerinckii (en) dans la fermentation de haricots secs salés déjà noté par T. Hof en 1935[5] - [9] - [10] - [11] - [12].
Le sel noir de tétrapotassium,K4C6O6 a été préparé par Robert West et Hsien Ying Niu en 1962 par réaction entre THBQ et du méthanoate de potassium dans le méthanol. Ce sel est diamagnétique et son spectre infrarouge suggère que les longueurs des liaisons C-C et C-O soient toutes égales et que le cycle soit légèrement distordu vers une conformation chaise[13]. Une oxydation partielle de ce composé produit un solide vert fortement paramagnétique, conjecturé être K+3 C6O63− et l'oxydation complète aboutit au rhodizonate de potassium, K+2 C6O62−[13].
Le sel de sodium noir verdâtre,Na4C6O6 a été décrit par Alexander J. Fatiadi et W. F. Sanger en 1962[6].
Le sel de lithium violet foncé,Li4C6O6 a été proposé comme un matériau d'électrode pour piles électriques: Il peut être oxydé en rhodizonate de lithium, Li2C6O6 ou réduit en le sel de lithium de l'hexahydroxybenzène, Li6C6O6[7]. En l'absence d'oxygène, Li4C6O6 est stable jusqu'à env. 450 °C et alors se décompose en laissant un résidu de carbonate de lithium, Li2CO3[7]. Cependant, le rhodizonate se dismute vers 400 °C en Li4C6O6 et en cyclohexanehexone, C6O6 qui se décompose rapidement en monoxyde de carbone, CO, dioxyde de carbone, CO2 et carbone[7]. Li4C6O6 forme un dihydrate, Li4C6O6·2H2O qui reperd ses molécules d'eau à 250 °C[7].
Ester
La tétrahydroxy-1,4-benzoquinone a la particularité de pouvoir former avec certains acides des esters qui sont des oxydes de carbone originaux. Ainsi, le bisoxalate de tétrahydroxy-1,4-benzoquinone, synthétisé en 1968[14] et le biscarbonate de tétrahydroxy-1,4-benzoquinone, synthétisé en 1984[15] en sont des exemples réalisés et les acides rhodizonique, croconique, squarique et deltique en auraient aussi la capacité.
Notes
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Tetrahydroxy-1,4-benzoquinone » (voir la liste des auteurs).
- Tetroquinone in The Merck Index, 11th Edition, p.9177
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Harold P. Klug, The Crystal Structure of Tetrahydroxy-p-benzoquinone, Acta Crystallographica, 1965, vol. 19, p. 983.
- Max W. Miller, Microbial metabolites, McGraw-Hill, 1961.
- A. J. Fatiadi and W. F. Sanger, Tetrahydroxyquinone, Organic Syntheses, 1973, coll. vol. 5, p. 1011; 1962, coll. vol. 42, p. 90.
- Haiyan Chen, Michel Armand, Matthieu Courty, Meng Jiang, Clare P. Grey, Franck Dolhem, Jean-Marie Tarascon, and Philippe Poizot, Lithium Salt of Tetrahydroxybenzoquinone: Toward the Development of a Sustainable Li-Ion Battery, J. Am. Chem. Soc., 2009, vol. 131(25), p. 8984–8988. DOI 10.1021/ja9024897.
- J. A. Cowan, J. A. K. Howard and M. A. Leech, Interpenetrating supramolecular lattices in 4,4'-bipyridine-2,3,5,6-tetrahydroxy-1,4-benzoquinone (3/2), Acta Crystallographica Section C, 2001, vol. 57(10), p. 1196-1198. DOI 10.1107/S0108270101011647.
- T. Hof, Rec. Trav. Botan. Neerland, 1935, vol. 32, p. 92.
- A J Kluyver, T Hof, A G J Boezaardt, On the Pigment of Pseudomonas Beijerinckii Hof [ = Chromohalobacter beijerinckii]
- , Vitamins and Hormones: Advances in Research and Applications, 1945, vol. 3.
- Leland Alfred Underkofler, Richard James Hickey, Industrial fermentations, 1954.
- Robert West, Hsien Ying Niu, Symmetrical Resonance Stabilized Anions, CnOn-m. II. K4C6O6 and Evidence for C6O6-3., Journal of the American Chemical Society, 1962, vol. 84(7), p. 1324–1325. DOI 10.1021/ja00866a068.
- H. S. Verter, H. Porter and R. Dominic, A new carbon oxide: synthesis of tetrahydroxybenzoquinone bisoxalate, Chemical Communications (London), 1968, pp. 973b–974. DOI 10.1039/C1968000973b.
- C. Nallaiah, Synthesis of tetrahydroxy-1,4-benzoquinone biscarbonate and hexahydroxybenzene triscarbonate - new organic carbon oxides, Tetrahedron, 1984, vol. 40(23), p. 4897-4900. DOI 10.1016/S0040-4020(01)91324-9.