Trioxyde de carbone
Le trioxyde de carbone (CO3) est un oxyde instable de carbone. Il y a trois isomères possibles pour le trioxyde de carbone de symétrie Cs, D3h ou C2v. Le CO3 C2v a été montré par plusieurs études comme étant l'état fondamental de la molécule[1] - [2].
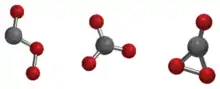
Le trioxyde de carbone ne doit pas être confondu avec l'ion stable carbonate (CO32−).
Le trioxyde de carbone peut être produit dans la zone de dérive d'une décharge corona négative par réaction entre le dioxyde de carbone (CO2) et l'oxygène atomique (O) créé à partir de l'oxygène moléculaire (O2) par des électrons libres du plasma[3].
Une autre méthode reportée est la photolyse d'ozone (O3) dissous du CO2 liquide ou dans un mélange CO2/SF6 à -45 °C, irradié à 253,7 nm. La formation de CO3 est inférée mais il apparaît qu'il se désintègre spontanément via 2CO3 → 2CO2 + O2 avec une durée de vie plus courte qu'une minute[4].
Le trioxyde de carbone peut être formé par soufflage d'ozone sur de la glace carbonique (CO2 solide) et il a également été détecté dans des réactions entre le monoxyde de carbone (CO) et le dioxygène (O2).
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Carbon trioxide » (voir la liste des auteurs).
- Tim Kowalczyk, Electronic structure and spectroscopy of carbon trioxide
- (en) T. Kowalczyk and A. I. Krylov, « Electronic structure of carbon trioxide and vibronic interactions involving Jahn-Teller states », J. Phys. Chem. A, vol. 111, no 33, , p. 8271 – 8276 (ISSN 1089-5639, PMID 17661455, DOI 10.1021/jp073627d)
- (en) Sabin, J. R et Kim, H, « A theoretical study of the structure and properties of carbon trioxide », Chemical Physics Letters, vol. 11, no 5, , p. 593–597 (DOI 10.1016/0009-2614(71)87010-0, lire en ligne)
- (en) DeMore W. B., Jacobsen C. W., « Formation of carbon trioxide in the photolysis of ozone in liquid carbon dioxide », Journal of Physical Chemistry, vol. 73, no 9, , p. 2935–2938 (DOI 10.1021/j100843a026)
- (en) Sobek V., Skalný J. D., « A simple model of processes in the drift region of negative corona discharge in a mixture of air with halocarbons », Czechoslovak Journal of Physics, vol. 43, no 8, , p. 807 (DOI 10.1007/BF01589802, lire en ligne [archive du ])
- (en) Pople J. A. , Seeger U., Seeger R., Schleyer P. v. R., « The structure of carbonate », Journal of Computational Chemistry, vol. 1, no 2, , p. 199–203 (DOI 10.1002/jcc.540010215)
- (en) Moll N. G., Clutter D. R., Thompson W. E., « Carbonate: Its Production, Infrared Spectrum, and Structure Studied in a Matrix of Solid CO2 », The Journal of Chemical Physics, vol. 45, no 12, , p. 4469–4481 (DOI 10.1063/1.1727526)
- (en) Gimarc B. M., Chou T. S., « Geometry and Electronic Structure of Carbon Trioxide », The Journal of Chemical Physics, vol. 49, no 9, , p. 4043–4047 (DOI 10.1063/1.1670715)
- (en) DeMore W. B., Dede C., « Pressure dependence of carbon trioxide formation in the gas-phase reaction of O(1D) with carbon dioxide », Journal of Physical Chemistry, vol. 74, no 13, , p. 2621–2625 (DOI 10.1021/j100707a006)
- (en) Francisco J. S., Williams I. H., « A theoretical study of the force field for carbon trioxide », Chemical Physics, vol. 95, no 3, , p. 373 (DOI 10.1016/0301-0104(85)80160-9)