Acrylonitrile
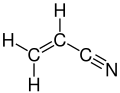
L'acrylonitrile (cyanure vinylique, cyanure de vinyle ou « VCN ») est constitué d'un groupe vinyle lié à un nitrile. Sa formule semi-développée est CH2CHCN.

| Acrylonitrile | |
| |
| Identification | |
|---|---|
| Nom UICPA | 2-propènenitrile |
| Synonymes |
cyanure de vinyle, |
| No CAS | |
| No ECHA | 100.003.152 |
| No CE | 203-466-5 |
| PubChem | 7855 |
| ChEBI | 28217 |
| SMILES | |
| InChI | |
| Apparence | liquide incolore ou jaune pâle, d'odeur âcre[2] |
| Propriétés chimiques | |
| Formule | C3H3N [Isomères] |
| Masse molaire[3] | 53,062 6 ± 0,002 8 g/mol C 67,91 %, H 5,7 %, N 26,4 %, |
| Moment dipolaire | 3,92 ± 0,07 D[4] |
| Diamètre moléculaire | 0,468 nm[5] |
| Propriétés physiques | |
| T° fusion | −84 °C[2] |
| T° ébullition | 77 °C[2] |
| Solubilité | 70 g·l-1 à 20 °C |
| Paramètre de solubilité δ | 21,6 J1/2·cm-3/2 (25 °C)[5] |
| Masse volumique | 0,8 g·cm-3[2] |
| T° d'auto-inflammation | 481 °C[2] |
| Point d’éclair | −1 °C (coupelle fermée)[2] |
| Limites d’explosivité dans l’air | 3,05–17,0 %vol[2] |
| Pression de vapeur saturante | à 20 °C : 11,0 kPa[2] |
| Point critique | 45,6 bar, 262,85 °C[6] |
| Thermochimie | |
| Cp | |
| Propriétés électroniques | |
| 1re énergie d'ionisation | 10,91 ± 0,01 eV (gaz)[8] |
| Propriétés optiques | |
| Indice de réfraction | =1,388[5] |
| Précautions | |
| SGH[9] | |
     Danger |
|
| SIMDUT[10] | |
   B2, D1A, D2A, D2B, F, |
|
| NFPA 704 | |
| Transport[9] | |
| Classification du CIRC | |
| Groupe 2B : Peut-être cancérogène pour l'homme[11] | |
| Écotoxicologie | |
| LogP | 0,25[2] |
| Seuil de l’odorat | bas : 1,6 ppm haut : 22 ppm[12] |
| Unités du SI et CNTP, sauf indication contraire. | |
C'est un liquide incolore (à jaunâtre en raison d'impuretés). Son odeur est âcre et légèrement piquante (perceptible par l'homme à partir d'une teneur d'environ 20 ppm). L'acrylonitrile est toxique en raison notamment de la production de cyanure comme métabolite ou sous-produit de dégradation[14] - [15] parmi ses métabolites), écotoxique et hautement inflammable. Il interagit négativement avec l'ADN (Agent mutagène)[16], in vitro et in vivo[17].
Issu de la pétrochimie, il est massivement utilisé par l'industrie chimique et des plastiques[18], c'est un polluant environnemental dangereux car à la fois écotoxique, volatil et soluble dans l'eau (73,5 g/l à 20 °C)[19]. De plus, dans l'eau ou en contexte humide, il attaque le cuivre (composant fréquent des conduites d'eau potable) et ses alliages[19].
Son point de congélation est très bas (−83,55 °C selon American Cyanamid[20]) et il est sensible à la chaleur : à pression atmosphérique normale, il entre en ébullition dès 77,3 °C[19] et sa décomposition thermique peut conduire à l'apparition de cyanure d'hydrogène[19].
C'est un monomère utilisé (par polymérisation) pour produire des plastiques (dont le polyacrylonitrile, un polymère très cohésif de la famille des acryliques) et de nombreuses fibres textiles (Orlon, Crylor fabriquée par Rhône-Poulenc).
En copolymérisation avec le butadiène, il fournit aussi des élastomères « azotés » doués de propriétés remarquables, telles que la résistance aux huiles et aux agents chimiques, et avec le butadiène et le styrène, il forme des résines solides dites à hautes performances (résines ABS).
C'est une des nombreuses molécules toxiques pouvant être émises et détectées dans les émissions de pots d'échappement et dans la fumée du tabac[21] ou dans les vapeurs émises lors des processus de thermoformage de certains plastiques[22] ou de certaines unités de traitement pour recyclages ou valorisation de déchets de plastiques[23]. Elle semble être principalement et d'abord émise dans l'air, mais peut ensuite être retrouvée dans l'eau.
Production et synthèse
La principale synthèse industrielle est l'ammoxydation du propène via le « procédé Sohio », et ce depuis 1950 environ[24]:
- 2 CH2=CH–CH3 + 2 NH3 + 3 O2 → 2 CH2=CH–C≡N + 6 H2O.
Un mélange d'air, de propène et d'ammoniac dans des proportions stœchiométriques est introduit dans un réacteur à lit fluidisé opérant de 400 à 500 °C et entre 30–200 kPa[24]. Un catalyseur est utilisé pour obtenir une réaction complète et sélective (les seules impuretés sont l'acide cyanhydrique et l'acétonitrile). Originellement à base de bismuth et de phosphomolybdate, les catalyseurs actuels sont formés d'antimoine et d'uranium ou de ferrobismuth et phosphomolybdate[24].
Précédemment, la production se faisait à base d'acétylène :
La réaction avait autrefois lieu dans une solution diluée d'acide chlorhydrique en présence de chlorure de cuivre(I), mais les réactifs étaient relativement chers et la réaction produisait des impuretés tel le divinylacétylène qui posaient problème lors de la purification ; ce procédé n'a pas résisté à la concurrence du procédé Sohio[24].
Polymérisation
Il polymérise facilement, sous l'effet de :
- la lumière ;
- la chaleur ;
- l'irradiation, et on a montré dès le début des années 1960 - par exposition à des rayons X - que ses vitesses initiales de polymérisation étaient proportionnelles au débit de dose[25] ;
- les catalyseurs qui peuvent être notamment des bases fortes, des peroxydes, des persulfates[19].
La polymérisation chimiquement catalysée est très exothermique. Elle peut induire l'explosion du liquide en train de polymériser et de vapeurs s'en dégageant[19].
Les industriels, pour limiter ce risque, utilisent des « inhibiteurs de polymérisation » (en général 35 à 45 ppm d'éther monoéthylique de l'hydroquinone, avec 0,4 à 0,5 % d'eau). Cette stabilisation de la polymérisation nécessite aussi un environnement aérobie[19].
Réactivité chimique
Dans les conditions normales de température et de pression, ce produit réagit vivement (jusqu'à exploser) en présence de certains produits, qui sont notamment :
Dégradation, biodégradation
Dans l'air ce produit est rapidement photodégradé[26] et peut être biodégradé dans le sol[27] - [28], mais il est très soluble et peu biodégradable dans l'eau[29] (hormis en surface et en station d'épuration).
Selon des tests faits en Malaisie par le Rubber Research Institute of Malaysia, par rapport aux autres types de caoutchouc, y compris synthétiques, le caoutchouc (ex. : gants en caoutchouc) contenant de l'acrylonitrile semble très peu dégradable voire non-dégradable aux échelles habituelles de temps, dans différents types de sol (argileux et sableux)[30].
Utilisation
L'acrylonitrile CH2 = CH-CN est :
- le monomère précurseur de polymères de synthèse comme le polyacrylonitrile, les fibres acryliques, le nylon, le caoutchouc synthétique (dit caoutchouc-nitrile par exemple utilisé pour produire les chambres à air de pneus de camions, voiture, vélo, avions, etc.[31] qui contient typiquement de 25 à 45 % d'acrylonitrile[32] ou caoutchouc-nitrile carboxylé (carboxylated nitrile rubber ; XNBR si on leur a ajouté une faible quantité d'acide carboxylique comme de l'acide méthacrylique) ;
- intermédiaires chimiques pour la production d'acrylamide et d'adiponitrile[13] ;
- l'un des deux monomères composant le copolymère styrène-acrylonitrile (SAN) ;
- l'un des trois monomères composant le copolymère acrylonitrile butadiène styrène (ABS, l'un des polymères acryliques très utilisés dans les véhicules nécessitant un faible poids et une résistance élevée aux chocs). Ce matériau est un copolymère d’acrylonitrile, de butadiène et de styrène, d’où son nom d'ABS.
Il a autrefois été utilisé comme insecticide et pesticide de fumigation (alors produit par American Cyanamid et utilisé en mélange avec 66 % de tétrachlorure de carbone pour être rendu moins explosif et inflammable[33]). Il a aussi été utilisé comme fumigant pour tuer les vers de farine et larves de mites) dans les moulins, les minoteries industrielles, les boulangeries et certaines machines du secteur agroalimentaire. On l'a aussi utilisé en chambres atmosphériques pour la fumigation du tabac et de cigares[34] - [35], de cerneaux de noix, céréales, fruits secs dont les dattes. Comme il pénètre moins profondément les matériaux poudreux denses (farine) que le bromure de méthyle, ce dernier lui est préféré pour la farine et d'autres produits de meunerie. Dès les années 1950, il est utilisé pour la fumigation sous vide du tabac[36] ainsi que pour tuer les termites dans le bois sec de maisons ou bâtiments où des termines sont présents.
Un pesticide à base d'acrylonitrile a été récemment breveté comme tel en 1997 par Norihiko Mimori[37]. En 1965, alors que ce produit est très utilisé sur certains produits alimentaires, les experts invités à une réunion conjointe de la FAO et de l'OMS concluent qu'au vu des connaissances alors disponibles, ils ne peuvent évaluer les risques pour la santé humaine liés à ces pratiques, et que des recherches toxicologiques sont nécessaires[1]. En raison de sa toxicité et dangerosité, ce produit sera de moins en moins utilisé comme pesticide et il ne semble plus très utilisé pour ces usages.
Il est aussi utilisé pour l'encollage et comme apprêt (textile) industriels[19].
L'hydrolyse de l'acrylonitrile conduit en outre à l'acide acrylique dont les esters sont les monomères de la synthèse des résines acryliques.
Toxicologie
Elle varie selon les espèces, et les tissus ciblés par l'acrylonitrile ou ses métabolites[38], y compris en tant que génotoxique[39]. Ce composé fait partie de la liste EPA des substances extrêmement dangereuses.
Toxicocinétique
Cette molécule peut être absorbée sous forme liquide ou vapeur (ou comme contaminant) et distribuée par toutes les voies (orale, percutanée, pulmonaire, etc.). Son degré de toxicité et sa répartition dans différents organes varient selon le type de régime alimentaire du sujet au moment de l'intoxication[40].
La toxicocinétique de cette molécule a notamment été étudiée chez le rat[41] - [42] - [43]. Chez l'homme le passage transcutané est pour un adulte moyen de 0,6 mg·cm-2 par heure (pour une dose de produit directement appliquée sur la peau, sans lavage durant quatre heures)[19].
L'acrylonitrile n'est pas arrêté par les barrières placentaires ni hémato-encéphaliques[19]. De premières bases pour un modèle pharmacokinétique ont été publiées par Gargas pour le rat en 1990[44], ensuite affinées concernant la précision des doses (1995) par le même auteur[45].
Chez le rat de laboratoire, 95 à 98 % de la dose orale et 91,5 % de la dose inhalée passent dans l'organisme. Après absorption orale, un pic sanguin est constaté au bout de trois heures environ (pour une demi-vie sanguine de 61 minutes en moyenne). Chez l'animal, l'acrylonitrile et/ou ses métabolites s'accumulent d'abord dans le sang (dans les globules rouges sous forme de cyanoéthylvaline), le foie, les reins, les muqueuses de l'estomac et de l'intestin, les poumons[46] et le cortex surrénal. Puis après trois à six heures, ces produits sont retrouvés plus concentrés dans le cœur, le thymus, la rate, les glandes surrénales, le cerveau et la peau[19]. Enfin, après 72 h environ dans le tractus gastro-intestinal.
Il est métabolisé via deux voies coexistantes :
- en étant conjugué avec le glutathion[47] - [48] (ce serait la voie de détoxication de l'organisme, qui peut être étudiée in vivo et in vitro[49]) ;
- par oxydation via une famille d'enzymes dite « cytochrome P450 », ce qui induit la formation de COE (oxyde de cyanoéthylène, expliquant la toxicité du produit, que l'on cherche à comprendre au moins depuis les années 1940[50] - [51].
Produits de dégradation
On les retrouve en grand nombre, sous forme de métabolites différents[52] dans l'urine, dont sous forme d'ions thiocyanate et cyanure, et N-acétyl-S-(2-cyanoéthyl)cystéine (acide 2-cyanoéthyl-mercapturique ou CMA), qui est le métabolite le plus fréquemment trouvé chez l'animal exposé (pour différentes espèces)[53] - [19].
Toxicité
Sa toxicité semble essentiellement due à ses métabolites[54] - [55] - [56], dont l'excrétion dans les urines est globalement dose-dépendante[57].
Au-delà d'une certaine doses (et d'effets qui varient selon l'espèce concernée - les effets chez l'animal de laboratoires ne pouvant donc pas être extrapolés à l'Homme[58] - [59]), c'est un toxique cellulaire aigu[19] - [60].
Il est toxique par contact, par ingestion et par inhalation[19] - [61] - [62] - [63].
Soins
En cas d'intoxication aiguë, il est conseillé de laver abondamment la peau ou les yeux qui auraient été en contact avec le produit et de ne pas faire vomir en raison de fréquentes pertes de conscience.
Certains effets (érosion gastrique et hémorragie du tube digestif) peuvent être atténués ou contrôlés s'il y a eu administration préventive d'atropine, de L-cysteine, de cystéamine ou de cimétidine[64], mais on ne lui connait pas vraiment d'antidote parfait[65] - [66] - [67] - [68].
Lors d'intoxications faisant suite à des fumigations, trois antidotes sont souvent utilisés en mélange, avec des dosages variant selon l'âge du patient : amyl nitrite, sodium nitrite et sodium thiosulfate, vendu en kit sous le nom de « Lilly Cyanide Antidote kit » (car produit par « Eli Lilly and Company » à Indianapolis[69].
Allergénicité
Ce produit est fortement irritant pour les yeux (dont chez l'homme[70]) et la peau ; dès quinze minutes après application cutanée chez le lapin, avec formation d'un œdème dégénérant en nécrose pour une exposition de vingt heures. Chez l'homme, le contact avec le produit, sa vapeur ou un vêtement souillé, peut provoquer une dermatite de contact[71] avec érythème, voire un œdème, une brûlure, un prurit important ou un phlyctène[19].
C'est aussi un sensibilisant cutané (des contacts répétés à de faibles doses entrainent une sensibilisation).
Des cas d'eczéma de contact et de dermite allergique ont été signalés chez des travailleurs exposés à ce produit, avec paresthésie des doigts et avant-bras, cessant avec l'arrêt de l'exposition. Une sensibilisation a été confirmée dans ces cas (par patch tests)[72] - [19] - [73].
Cancérogénicité
Une exposition chronique à de faibles doses est cancérogène (ce produit est classé cancérogène de niveau 2 en Europe, et classé dans le groupe 2B par le CIRC)[19] (source de cancer du cerveau[74], de cancers gastrointestinaux et des carcinomes squameux la glande de Zymbal (dans le foie) et des glandes mammaires chez le rat[75] chez lequel il peut cibler plusieurs molécules connues pour intervenir dans la cancérogenèse[76]). Les mécanismes de cancérogenèse sont encore pour partie incompris, mais semblent fortement liés à son caractère mutagène et à sa propension à former des adduits. L'exposition à l'Acrylonitrile diminue curieusement - chez l'animal de laboratoire - le risque d'adénome de l'hypophyse[19].
Le caractère cancérigène de cette molécule pourrait être potentialisé par d'autres polluants (ex : PCB[77] ou médicaments (phénobarbital[77]).
Sensibilité toxicologique
Elle varie selon les animaux de laboratoire expérimentalement exposés. Les signes cliniques[78] varient selon l'espèce (rat[79], hamster[80], lapin, chat, singe, chien…, le chien se montrant par exemple nettement plus sensible à l'inhalation que ces autres espèces, alors que le chat est le seul à ne pas subir d'irritation nasale ni bronchopneumonie après inhalation). Pour une même espèce, la sensibilité varie aussi significativement selon que l'exposition soit orale, cutanée ou par inhalation[19].
Ce produit se montre nettement mutagène et génotoxique in vitro pour Salmonella typhimurium[81] et Escherichia coli et plus encore chez des levures[82] en présence d'activateurs biologiques[19], mais cet effet n'a pas été clairement observé in vivo[19]. Il casse l'ADN et provoque des échanges entre chromatides sœurs. Il est source d'aberration chromosomique et fait apparaître des « micronoyaux » (sans réparation de l'ADN constatée). La souris y est sensible[83]. Son métabolite COE est un mutagène direct.
Effets sur la fertilité et le développement
Selon certains auteurs, aux doses non toxiques pour les parents, de tels effets n'ont pas été détectés. Aux doses toxiques, des effets sur le développement existent (ex : augmentation du poids du foie et du cœur) de même que sur le fœtus et l'embryon (baisse de poids fœtal, hausse du risque de malformations congénitales du squelette)[19].
À des doses relativement élevées(par rapport au fond moyen d'exposition), plusieurs observé chez la souris de laboratoire[84] et le rat de laboratoire une toxicité testiculaire (se traduisant par une perte de poids des testicules et de l'épididyme, sans effet cependant sur la prostate et les vésicules séminales)[85] - [86]. On observe une délétion de la spermatogenèse du rat exposé à 23 à 46 mg/kg d'acrylonitrile durant quatre semaines (avec diminution du nombre de spermatocytes, dégradation de leur fonctionnalité[87] et diminution du nombre de spermatides). Le nombre de spermatozoïdes et leur mobilité diminuent alors. L'alkylation de l'ADN[88] et une inhibition du processus naturel de réparation de l'ADN seraient en cause[89].
Effets endocriniens, reprotoxicité
L'exposition réelle de la population et même celle des salariés ou travailleurs indépendants sont mal connues, mais une étude publiée en 1990 a montré une chute très significative du niveau de testostérone chez les employés de la chimie exposé à l'acrylonitrile[90], ce qui plaide en faveur d'un effet de perturbateur endocrinien aux doses auxquelles sont exposées les employés de l'industrie chimique exposés à ce produit.
Ce produit pourrait aussi être reprotoxique selon Wu W. et al. (1995), qui ont détecté une augmentation significative du risque de prématurité et de fausses couches chez les bébés issus d'employées[91] et d'employés de l'industrie chimique exposés à l'acrylonitrile[92], avec en outre une augmentation des vomissements[91] et de l'anémie[91] chez la mère durant la grossesse quand cette mère avait été exposée, mais la part de responsabilité du produit est toujours difficile à établir dans ce type d'étude, car un travailleur est généralement exposé à plusieurs produits chimiques et non à l'acrylonitrile seul. L'exposition en laboratoire de rates gestantes conduit à augmenter le taux de malformation fœtale[93].
Symptômes de l'intoxication
Les signes cliniques subjectifs[94] et objectifs[95] sont ceux d'une intoxication par nitriles avec intoxication par les cyanures libérés par le clivage de la molécule de nitrile. Les symptômes varient selon le dosage et d'espèce animale concernée, mais peuvent dans tous les cas être classés en 4 stades :
- stade 1 : excitation, larmoiement ;
- stade 2 : phase « tranquille », avec symptômes cholinergiques (salivation, larmoiement, défécation/diarrhées et émissions d'urine incontrôlables, toux, dyspnée, vertiges, nausées, vomissements, somnolences, irritabilité et parfois atteinte hépatique[19]), effets pouvant être bloqués par l'administration d'atropine ;
- stade 3 : effets neurotoxiques : Convulsions, atteintes cardiaques et pertes successives de connaissance ;
- stade 4 : paralysie, coma puis mort[96]. Une situation d'hypoxie augmente fortement le risque de mortalité (chez le rat préalablement intoxiqué par de l'acrylonitrile).
L'autopsie (ou d'autres moyens d'investigation chez le sujet vivant) peuvent révérer des hémorragies du tractus gastro-intestinal dues à l'endommagement du tube digestif par les effets (ici il s'agit d'une réaction inflammatoire des muqueuses, pouvant conduire à des nécroses) de cette molécule[97] - [98]. Des nécroses peuvent aussi toucher l'estomac, qui font intervenir le gastric glutathione stomacal[99]). Chez l'homme, l'intensité et la survenue des symptômes semblent plus corrélés à la durée qu'à l'intensité d'exposition. Ils peuvent être confondus avec ceux d'une exposition à des solvants ou métaux lourds[19].
Ce produit et ses polymères peuvent poser problèmes en cas de contact alimentaire[100], en cas de migration[101] - [102] du monomère « acrylonitrile » vers des aliments ou vers une boisson à partir des matières plastiques utilisées comme « contenant » ou emballage[103] ou en tant que contaminant indésirable ou accidentel.
Écotoxicologie
Chez les mammifères, selon les expériences faites sur l'animal de laboratoire, l'acrylonitrile produit des métabolites dont la toxicité peut être comparée à celle du cyanure (cyanure de potassium), mais doublée d'une toxicité pour les globules rouges résultant de mécanismes autres que la libération d'ions cyanure (CN-). Ceci serait dû au fait que l'acrylonitrile se lie facilement aux protéines cytoplasmiques et membranaires, alors que le CN se lie directement à l'Hème[104] - [105] - [106] - [107].
L'acrylonitrile se montre également écotoxique pour divers organismes aquatiques, en eaux douces, comme dans l'environnement marin[108], chez des crustacés tels que Asellus aquaticus[109], comme chez des poissons fréquemment utilisés comme modèle animal par les toxicologues (Cyprinodon variegatus), adulte[110] ou à l'état d'alevin[111]). De même, divers organismes végétaux aquatiques ont une croissance qui est inhibée par l'acrylonitirile (ex : algues[112] - [113] ou des plantes aquatiques à fleur dont par exemple Ruppia maritima[114].
Les champignons du sol peuvent l'intégrer et le métaboliser[115].
Explosivité
il est explosif dans l'air quand il y est présent dans une proportion comprise entre 3 % (seuil inférieur d'explosivité)[19] et jusqu'à 17 ou 28 % selon les sources (seuil supérieur)[19]
Précautions
Il doit être produit, stocké, surveillé (teneur de l'air[116]), transporté et utilisé avec des précautions particulières, notamment en milieu industriel[117], en raison de son caractère à la fois combustible, explosif, toxique et écotoxique (avec étiquetage CE en Europe[19]). Il ne doit pas être relâché dans l'environnement[19]. Il conviendrait aussi de vérifier (via des analyses par chromatographie par exemple) qu'il ne migre pas à partir des colles, plastiques, résines ou caoutchouc vers l'environnement et les aliments ou boissons[118], et à partir d'environnements industriels à risque[119].
Au Canada, depuis 2003, dans le cadre de la Loi canadienne sur la protection de l'environnement de 1999 dite LCPE (1999), il doit faire l'objet d'une planification de prévention de pollution[120], Gouvernement du Canada (2008), Fiche documentaire concernant le Lot 2 du plan de gestion des produits chimiques du gouvernement du Canada ().
En cas d'incendie, l'eau ne doit pas être utilisée pour l'extinction du feu, au profit de dioxyde de carbone, poudres chimiques ou mousses pour liquides polaires. Des pompiers formés aux risques de « polymérisation explosive » et équipés d'appareils respiratoires isolants et d'équipement de protection individuelle intégral doivent opérer sur ce type d'incendie[19]. On préfère parfois laisser brûler la totalité d'un stock, en considérant qu'ainsi moins de produits toxiques seront générés et diffusés que via une extinction mal effectuée ou risquent d'induire la dispersion de monomère dans l'environnement.
On cherche encore des biomarqueurs spécifiques d'exposition[121] pour la population générale ou les travailleurs[122], idéalement à partir des urines, pour faciliter le monitoring d'un patient ou d'un groupe[123].
Exposition en milieu de travail
Le risque d'exposition professionnelle chronique et moindrement accidentel existe pour de nombreux métiers et postes professionnels car l'acrylonitrile est très utilisé dans les pays industriels.
Ce risque a fait l'objet de diverses études épidémiologiques. Il est difficile à évaluer in situ et plus encore a posteriori[124] - [125] concernant par exemple dans les années 1980 des effets sur l'incidence du cancer[126] - [127] - [128] ou sur la mortalité[129] - [130] - [131] - [132].
En France, l'air des locaux de travail ne doit pas[19] en contenir plus de :
- 2 ppm, soit 4,5 mg·m-3 pour la VME ;
- 15 ppm, soit 32,5 mg·m-3 pour la VLE.
Aux États-Unis, l'AGGIH[133] impose un taux max de 2 ppm (TLV[134]-TWA[135])[19].
Accidents majeurs ou graves
Ils sont répertoriés par la base de données spécialisée FACTS[136] qui contient 33 références décrivant des accidents ayant eu lieu dans des pays industrialisés. Ils ont eu lieu durant le processus de fabrication dans des usines chimiques, ou à l'occasion de l’utilisation du produit (aux UDSA en 2002 par exemple), ou durant le transport par camion sur la route, par péniche (sur rivière, aux États-Unis en 1982 par exemple) ou bateau en mer (en 1991, avec du dichloroéthane, ou au Japon en 1989), ou par train sur des voies ferrées, dans des installations portuaires (stockage ou lors du transbordement dans un bateau comme aux États-Unis en 1986) ou à la suite d'une rupture de conduite à proximité d'un réservoir d'acrylonitrile[136] comme à Cologne ou l'incendie d'un réservoir secondaire à celui induit par une fuite d'éthylène à proximité a imposé le déploiement en urgence (en cinq heures) de 1 180 pompiers, qui ont stoppé le feu en quelques heures, mais sans pouvoir empêcher la dispersion d'acrylonitrile dans l'air (20 ppm mesurés dans le district de Worringen, près de Cologne)[137] - [136] ; dans ce dernier cas, 1 200 tonnes d’acrylonitrile ont brûlé, soit 600 % du seuil Seveso (qui était alors de 200 t pour ce produit)[137].
Un accident majeur a eu lieu en Flandre belge, dans la nuit du vendredi 3 au samedi , vers deux heures du matin. Six wagons-citernes, d'un train de marchandises en comprenant treize, ont déraillé au niveau d'un aiguillage situé entre Schellebelle et Wetteren, non loin de l'Escaut. Cinq de ces citernes étaient chargées d'acrylonitrile, toutes destinées au port maritime de Gand[138]. L'accident serait dû à une vitesse excessive[139] qui fit dérailler une locomotive et plusieurs wagons. Plusieurs citernes ont pris feu ou explosé, causant 1 mort (un homme de 64 ans intoxiqué chez lui par la fumée), 17 blessés à 49 blessés/hospitalisés (selon les sources et dates[140] - [138] - [141]). Une fois que la nature exacte des produits leur a été communiquée, les pompiers ont préféré laisser brûler les produits plutôt qu'arroser les foyers en risquant d'accentuer les infiltrations d'acrylonitrile vers les eaux superficielles ou souterraines ou favoriser l'émission de vapeurs toxiques ; toutefois, durant les premières minutes, de grandes quantités d'eau ont été projetées en direction du sinistre. Environ 300 personnes habitant à proximité ont été évacuées, et les autres invitées à se calfeutrer[138]. Des riverains ont été autorisés à rentrer chez eux, puis ont été réévacués le lendemain. Selon les médias, l'eau d'extinction aurait été stockée pour être retraitée aux Pays-Bas. Cependant, l'eau utilisée lors de la première phase d'extinction s'est en partie déversée vers l'ancien réseau d'égouts (dont les plans semblent avoir été perdus) qui fut contaminé par l'acrylonitrile, contaminant à son tour les maisons voisines et l'Escaut[142]. 47 personnes sont évacuées pour plusieurs semaines et les travaux de dégagement de la voie ferrée prendront aussi plusieurs semaines.
Présence extraterrestre
Grâce à un spectre d'émission caractéristique, son éventuelle présence dans l'espace interstellaire est théoriquement repérable. Des indices de présence ont été repérés par des astrophysiciens dans les années 1970, mais ils pourraient aussi résulter d'artéfacts. Sous réserve de confirmation, ce serait la première preuve d'existence de molécules carbonées avec double pont entre atomes de carbone dans l'espace[143].
L'acrylonitrile a également été probablement identifié dans l'atmosphère de Titan[144].
Notes et références
- INCHEM (1965), Evaluation of the hazards to consumers resulting from the use of fumigants in the protection of food, FAO Meeting Report No. PL/1965/10/2 ; WHO/Food Add/28.65
- ACRYLONITRILE, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) David R. Lide, Handbook of chemistry and physics, CRC, , 89e éd., 2736 p. (ISBN 978-1420066791), p. 9-50
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, Angleterre, John Wiley & Sons Ltd, , 239 p. (ISBN 0-471-98369-1)
- « Properties of Various Gases », sur flexwareinc.com (consulté le )
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 1, Huston, Texas, Gulf Pub. Co., (ISBN 0-88415-857-8)
- (en) David R. Lide, Handbook of chemistry and physics, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 10-205
- Entrée « Acrylonitrile » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 26 juillet 2011 (JavaScript nécessaire)
- « Acrylonitrile » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 23 avril 2009
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 2B : Peut-être cancérogènes pour l'homme », sur http://monographs.iarc.fr, CIRC, (consulté le )
- « Acrylonitrile », sur hazmap.nlm.nih.gov (consulté le )
- HPA, Dossier Acrylonitrile / General information [PDF], 5 p. (consulté le 8 mai 2013)
- Abreu M et Ahmed AE (1980), Metabolism of acrylonitrile to cyanide: in vitro studies. Drug Metab. Disposition 8(6), 376-379.
- Frederick W. Benz, Donald E. Nerland, William M. Pierce, Christine Babiuk (1990), Acute acrylonitrile toxicity: Studies on the mechanism of the antidotal effect of d- and l-cysteine and their N-acetyl derivatives in the rat (Sprague-Dawley mâles); Toxicology and Applied Pharmacology Volume 102, Issue 1, janvier 1990, pages 142 à 150 (résumé)
- Hogy LL (1986), Metabolism of acrylonitrile and interactions with DNA. Dissertation Abstracts International 47, B1529-1530
- Hogy LL et Guengerich FP (1986), In vivo interaction of acrylonitrile and 2-cyanoethylene oxide with DNA in rats. Cancer Research 46, 3932-3938
- Bayer O (1949), Die Chemie des Acrylonitrils, Angewandte Chemie, 61 Jahrg. No. 6, 229-276
- [INRS] ; N Bonnard & al., Fiche toxicologique Acrylonitrile (no 105)
- American Cyanamid Co. (1959), The Chemistry of Acrylonitrile, 2e éd., p. 14-15, New York.
- Fennell TR, MacNeela JP, Bell DA, Thompson CL (1995), Exposure to acrylonitrile in cigarette smokers: Analysis of N-(2-cyanoethyl)valine in hemaglobin, Proc. Am. Assoc. Cancer Res. 36, 110 (résumé no 655).
- Forrest MJ, Jolly AM, Holdings SR, Richards SJ (1995), Emissions from processing thermoplastics, Ann. Occup. Hyg. 39, 35-53
- Freeman RA et Schroy JM (1984), Air stripping of acrylonitrile from waste-treatment plants, Environmental Progress 3, 26-33.
- (en) Patrick W. Langvardt, Acrylonitrile, Wiley-VCH Verlag GmbH & Co, coll. « Ullmann's Encyclopedia of Industrial Chemistry », (DOI 10.1002/14356007.a01_177, présentation en ligne)
- René Bensasson et Rose Marx (1960), « Irradiation de l'acrylonitrile à l'état solide », Journal of Polymer Science, vol. 48, issue 150, p. 53–59, décembre 1960, Wiley Online Library (résumé)
- Institute for Health and Consumer Protection ; European Chemicals Bureau ; Existing Substances (2004), European Union Risk Assessment Report Acrylonitrile (CAS No: 107-13-1) 1st Priority List Volume: 32 ; voir p. 9/322
- Donberg PA, Odelson DA, Klecka GM (1991), The biodegradation of acrylonitrile in soil, Abstr. Gen. Meet. Am. Soc. Microbiol. 91, 304.
- Donberg PA, Odelson DA, Klecka GM, Markam DA (1992), Biodegradation of acrylonitrile in soil, Environmental Toxicology and Chemistry 11, 1583-1594.
- BASF AG (1996), Internal Report. Determination of the biodegradability of acrylonitrile in the Closed Bottle Test, BASF Laboratory of Microbiology, Project No. 96/0439/23/1.
- Ikram, A. ; Alias, O. ; Napi, D. (2000), Biodegradability of NR gloves in soil, Journal of Rubber Research, vol. 3, no 2, p. 104-114 (ISSN 1511-1768) (résumé)
- Cantoni G, Senati U (1979), A new technology for nitrile rubbers production: Improvment in residual monomers content in the polymer and in the factory environment, Proceedings of the international Rubber Conference, Milan, Italie, p. 876-885.
- ECHA (2002), 1,3-Butadiene, rapport final no 106-99-0EINECS, no 203-450-8 RISK ASSESSMENT, United Kingdom
- Environnement Canada (2002), « Les plans de prévention de la pollution à l’égard de l’acrylonitrile »
- Tenhet, J.N. (1954) Fumigation of cigar tobaccos. Tobacco, 139 : 12-14
- Childs, D.P. et Overby, J.E. (1967), Atmospheric chamber fumigation of cigar tobacco ; T . Sci., 11 : 38 - 41.
- Tenhet, J.N. (1957) Tobacco fumigants and fumigation. Tobacco, 144 : 22 - 26.
- brevet Composés d'acrylonitrile WO 2000017193 A1, déposé 1997-04-24, publié l1997-10-30
- Butterworth BE, Eldridge SR, Sprankle CS, Working PK, Bentley KS, Hurtt ME (1992), Tissue-specific genotoxic effects of acrylamide and acrylonitrile, Environ. Mol. Mutagen. 20, 148-155.
- Eldridge SR Butterworth BE, Sprankle CS, Working PK, Bentley KS et Hurtt ME (1992), Tissue-specific genotoxic effects of acrylamide and acrylonitrile, Environ Mol Mutagen (US) 20(3), 148-155
- R. J. Jaeger, I. L. Cote, A. E. Rogers, E. H. Silver, S. Szabo (1984), Acute Toxicity of Acrylonitrile: Effect of Diet on Tissue Nonprotein Sulfhydryl Content and Distribution of 1–14C-Acrylonitrile or Its Metabolites ; International Journal of Toxicology ; janvier-février 1984, vol. 3 no. 1 93-102 ; doi:10.3109/10915818409009076 (résumé))
- Ahmed AE, Farooqui MYH, Upreti RK, El-Shabrawy O (1982), Distribution and covalent interactions of (1-14C) acrylonitrile in the rat, Toxicology, 23, 159-175.
- Ahmed AE, Farooqui MYH, Upreti RK, El-Shabrawy O (1983a), Comparative toxicokinetics of 2, 3014C- and 1- 14C-acrylonitrile in the rat, Journal of Applied Toxicology 3, 39-47.
- Ahmed AE (1983), In vivo interactions of acrylonitrile with macromolecules in rats, Chem. Biol. Interactions 47, 363-371
- Gargas ML, Kedderis GL, Fennell TR, Andersen ME (1990), A physiologically-based pharmacokinetic (PB-PK) model for acrylonitrile (ACN) in the rat, The Toxicologist 10, 216.
- Gargas ML, Anderson ME, Teo SKO, Batra R, Fennell TR et Kedderis GL (1995), A Physiologically-based dosimetry description of acrylonitrile and cyanoethylene oxide in the rat, Toxicol. Appl. Pharmacol. 134, 185-194
- Ahmed AE, Abdel-Aziz AH, Abdel-Rahman SZ, Haque AK, Nouraldeen AM, Shouman SA (1992), Pulmonary toxicity of acrylonitrile: covalent interaction and effect on replicative and unscheduled DNA synthesis in the lung, Toxicology 86, 1-14
- Cote IL, Bowers A, Jaeger RJ (1984), Effects of acrylonitrile on tissue glutathione concentrations in rat, mouse, and hamster, Research Communications in Chemical Pathology and Pharmacology, 43, 507-510
- Kedderis GL, Batra R, Sumner SCJ, Turner Jr. MJ (1990), Conjugation of acrylonitrile (ACN) and 2-cyanoethylene oxide (CEO) with glutathione (GSH). The Toxicologist 10, 199
- Guengerich FP, Geiger lE, Hogy LL, Wright PL (1981), In vitro metabolism of acrylonitrile to 2-cyanoethylene oxide, reaction with glutathione, and irreversible binding to proteins and nucleic acids, Cancer Res. 41, 4925-4933.
- Dudley HC et Neal PA (1942), Toxicology of acrylonitrile (vinyl cyanide), I. Study of the acute toxicity, J. Ind. Hyg. Toxicol. 24 (2), 27-36.
- Dudley HC, Sweeney TR, Miller JW (1942), Toxicology of acrylonitrile, II. Studies of effects of daily inhalation, J. Ind. Hyg. Toxicol. 24, 255-258
- Dahm DJ (1977), Identification of metabolites of acrylonitrile, Testimony before the US FDA (Industrial Biotest Report No. 74-42, Appendix 4: A.1-A.19, prepared for the Monsanto Company
- Kedderis GL, Roberts AE, Turner Jr. MJ, Held SD (1988), Urinary metabolites of acrylonitrile. Abstracts, 12th Annual CIIT Scientific Evening 16
- Kedderis GL (1989), The biotransformation of acrylonitrile : Implications of metabolic studies for risk assessment. CIIT Activities 9, 1-5.
- Kedderis GL et Batra R (1991), Species differences in the hydrolysis of 2-cyanoethylene oxide, the epoxide metabolite of acrylonitrile. Proc. Am. Assoc. Cancer Res. 32, 118
- Kedderis GL et Batra R (1993), Species differences in the hydrolysis of 2-cyanoethylene oxide, the epoxide metabolite of acrylonitrile. Carcinogenesis 14, 685-689
- Kedderis GL, Held SD, Batra R, Turner Jr. MJ, Roberts AE (1989), Dose dependent urinary excretion of acrylonitrile (ACN) metabolites in F-344 rats and B6C3F1 mice. The Toxicologist 9, 84
- Brambilla G, Martelli A, Robbiano L (1991), Use of human and rat hepatocyte primary cultures for the detection of interspecies differences in genotoxicity, The 1991 Eurotox Congress (résumé no 39).
- Brewer WE (1976), 90-day subacute vapour inhalation toxicity study with acrylonitrile in beagle dogs, albino rats and albino mice (Industrial Biotest Report no. 74-42, prepared for the Monsanto Company).
- Benesh V et Cherna V (1959), Akrylonitrile: Akute toxizitat and wirkungmechanismus, J. Hyg. Epidemiol. Microbiol. Immunol. 3, 106-116
- Buchter A, Peter H, Bolt HM (1982), Zur Toxikologie von Acrylnitril, Komb. Belastungen Arbeitsplatz, Ber. Jahrestag. Deut. Gesch. Arbeitsmedizin 22, 183-185.
- Hashimoto K et Kanai R (1965), Studies on the toxicology of acrylonitrile: metabolism, mode of action and therapy, Industrial Health 3, 30-46.
- Hashimoto S, Bandow H, Akimoto H, Weng JH, Tang XY (1984), Products and mechanism for the OH radicalinitiated oxidation of acrylonitrile, methacrylonitrile and allylcyanide in the presence of NO, Int. J. Kinet. 16, 1385- 1399
- Ghanayem BI, Boor PJ et Ahmed AE (1986), Prevention of acrylonitrile-induced gastrointestinal bleeding by sulfhydryl compounds, atropine and cimetidine, Res. Commun. Chem. Pathol. Pharmacol. 53, 141-144
- Appel KE, Peter H et Bolt HM (1981). Effect of potential antidotes on the acute toxicity of acrylonitrile. Int. Arch. Occup. Environ. Health, 49, 157-163
- Benz FW, Nerland DE, Pierce WM, Babiuk C (1990). Acute acrylonitrile toxicity: Studies on the mechanism of the antidotal effect of D- and L-cysteine and their N-acetyl derivatives in the rat. Toxicology and Applied Pharmacology 102, 142-150
- Borak J (1992). Acute acrylonitrile toxicity: reconsideration of mechanisms and antidotes. The OEM Report, Vol. 6. No. 3. 19-21
- Buchter A, Peter H, Bolt HM (1984). N-Acetyl-Cystein als Antidot bei akzidenteller Acrylnitril-Intoxikation. Int. Arch. Occup. Environ. Health 53, 311-319.
- Voir p. 165 du chapitre « Fumigants » in « Recognition and management of pesticide poisonings » (sponsorisé par l'EPA et produit par le National Pesticide Information Center, États-Unis).
- Delivanova S, Popovski P et Orusev T (1978), Blepharoconjunctivitis in workers in the manufacture of synthetic polyacrylonitrile fibres, God Zb Med Fak Skopje. 24, 279-282
- Hashimoto K et Kobayasi T (1961), A case of acute dermatitis caused by contact with acrylonitrile, Q. J. Labor. Res. 9(1-4), 21-24.
- Chu CY, Sun CC. (2001), Allergic contact dermatitis from acrylonitrile; Am J Contact Dermat. 2001 Jun;12(2):113-4
- Bakker JG, Jongen SMJ, van Neer FCJ, Neis JM (1991). Occupational contact dermatitis due to acrylonitrile. Contact Dermatitis 24, 50-53.
- Bigner DD, Bigner SH, Burger PC, Shelburne JD, Friedman HS (1986), Primary brain tumours in Fischer 344 rats chronically exposed to acrylonitrile in their drinking water, Fd. Chem. Toxicol. 24, 129-137
- Gallagher GT, Maull EA, Kovacs K, Szabo S (1988), Neoplasms in rats ingesting acrylonitrile for two years, J. Am. Coll. Toxicol. 7, 603-615
- Ahmed AE, Farooqui MYH (1984). Molecular interaction of acrylonitrile at target sites of carcinogenicity in rats. Arch. Toxicol. Suppl. 7, 405-406.
- Szabo S, Silver EH, Gallagher GT, Maull EA (1983), Potentiation of duodenal ulcerogenic action of acrylonitrile byPCB or phenobarbital in the rat, Toxicol. Appl. Pharmacol. 71, 451-454
- Buchter A et Peter H (1984). Clinical toxicology of acrylonitrile. G. Ital. Med. Lav. 6, 83-86.
- Barnes JM (1970), Effects on rats of compounds related to acrylamide, Br. J. Ind. Med. 27 (2), 147-149
- Barrett JC et Lamb PW (1985). Tests with the Syrian hamster embryo cell transformation assay. In: Ashby J, de Serres FJ, Draper M, Ishidate Jr. M, Margolin BH, Matter BE, Shelby MD (Eds.): Evaluation of short-term tests for carcinogens. Report of the International Programme on Chemical Safety's collaborative study on in vitro assays. Progress in Mutation Research 5, 623-628.
- Jung R (1986), Acrylonitrile: Study of the mutagenic potential in strain TA 102 of Salmonella typhimurium (Ames test). Pharma Research Toxicology and Pathology, Hoechst (unpublished report).
- Arni P (1985). Induction of various genetic effects in the yeast Saccharomyces cerevisiae strain D7. In Ashby J, de Serres FJ, Draper M, Ishidate Jr. M, Margolin BH, Matter BE, Shelby MD (eds.): Evaluation of short-term tests for carcinogens. Report of the International Programme on Chemical Safety's collaborative study on in vitro assays. Progress in Mutation Research 5, 217-224.
- Banerjee S, Schultz K, Ghosh L (1990), Cellular transforming genes in acrylonitrile transformed cells and nude mouse tumors, J. Cancer Res. Clin. Oncol. 116, Suppl. 1, 93
- Tandon R, Saxena DK, Chandra SV, Seth PK, Srivastava SP (1988), Testicular effects of acrylonitrile in mice ; Toxicology Letters 42, 55-63.
- Abdel Naim AB, Hamada FM, Abdel Aziz AH et Ahmed AE (1994), Acrylonitrile (VCN)-induced testicular toxicity in the rat, The Toxicologist 14, 87.
- Abdel Naim AB (1995), Studies on the mechanisms of testicular toxicity induced by acrylonitrile ; Ph.D Thesis, Department of Pharmacology and Toxicology, université Al-Azhar, Le Caire
- Hurtt ME, Bentley KS, Working PK (1987), Effects of acrylamide and acrylonitrile on unscheduled DNA synthesis (UDS) in rat spermatocytes. Environ. Mutagen. 9, Suppl. 8, 49-50.
- Farooqui MYH and Ahmed AE (1982). In vivo covalent binding of acrylonitrile to DNA, RNA and proteins. The Toxicologist 2, 108
- Ahmed AE, Abdel-Rahman SZ, Nour-Al Deen AM (1992), Acrylonitrile interaction with testicular DNA in rats, J. Biochem. Toxicology 7, 5-11
- Ivănescu M, Berinde M, Simionescu L. (1990), endocrinologie. 1990 Jul-Dec;28(3-4):187-92 ([résumé])
- Wu W, Su J, Huang M (1995), An epidemiological study on reproductive effects in female workers exposed to acrylonitrile, Chung Hua Yu Fang I Hsueh Tsa Chih 29, 83–5.
- Wu W, Su J, Huang M (1995), An epidemiologicalstudy on reproductive effects in female workersexposed to acrylonitrile, Chung Hua Yu Fang I HsuehTsa Chih 29, 83–5.
- Murray FJ, Schwetz BA, Nitsche KD, John JA, Norris JM, Gehring PJ (1978), Teratogenicity of acrylonitrile given to rats by gavage or by inhalation. Food Cosmet Toxicol 16, 547–52.
- Kaneko Y. et Omae K. (1992), Effect of chronic exposure to acrylonitrile on subjective symptoms, Keio J. Med. 41, 25-32.
- Babanov GP, Kljuchikov VN, Karajeva NI et Lileeva ZA (1959), Clinical symptoms of chronic poisoning by acrylonitrile, Vrach. Delo. 8, 833-836.
- Davis JH, Davies JE, Americo Rafonnelli RS, Reich G (1973). Investigation of fatal acrylonitrile intoxications. Pesticides and the environment, a continuing controversy. Inter. Med. Book Corp. 2, 547-556
- Ahmed AE, Abdel-Rahman, SZ, Nour Al-Deen A (1991). Studies on the mechanisms of acrylonitrile induced gastrointestinal damage: Time course of molecular interaction at the gastrointestinal tissues of rats. The Toxicologist 11, 329.
- Ghanayem BI et Ahmed AE (1983), Acrylonitrile-induced gastrointestinal hemorrhage and the effects of metabolism modulation in rats, Toxicol. Appl. Pharmacol. 68, 290-296
- Ghanayem BI, Boor PJ et Ahmed AE (1985), Acrylonitrile-induced gastric mucosal necrosis: Role of gastric glutathione, J. Pharmacol. Exp. Ther. 232, 570-577
- Isabelle Severin, Anne-Marie Riquet, Marie-Christine Chagnon (2011), Polluants alimentaires ; Toxicologie Évaluation et gestion des risques–Matériaux d'emballage à contact alimentaire ; Cahiers de nutrition et de diététique Volume 46, Issue 2, avril 2011, Pages 59–66 ; https://dx.doi.org/10.1016/j.cnd.2010.11.003 (texte issu d’une conférence IFN de Marie-Christine Chagnon le 29 juin 2010, résumé))
- EC (1982). Council Directive 82/711/EEC of 18 October 1982, laying down the basic rules necessary for testing migration of the constituents of plastic materials and articles intended to come into contact with foodstuffs
- EC (1993). Commission Directive 93/8/EEC of 15 March 1993, amending Council Directive 82/711/EEC, laying down the basic rules necessary for testing migration of constituents of plastic materials and articles intended to come into contact with foodstuffs
- Gawell GBM (1979). Natl. Food Administration, Food Res. Dept. - Uppsala, Suède. Determination of acrylonitrile monomer in plastic pachaging and beverages by headspace gas chromatography. Analyst 110, 104 ISS Feb. CODEN:ANALA
- Farooqui MYH et Ahmed AE (1983), The effects of acrylonitrile on hemoglobin and red cell metabolism. Journal of Toxicology and Environmental Health 12, 695-707
- Farooqui MYH et Ahmed AE (1983b). In vivo interactions of acrylonitrile with macromolecules in rats. Chem. Biol. Interactions 47, 363-371.
- Farooqui MYH, Mumtaz MM, Ghanayem BI, Ahmed AE (1990), Hemoglobin degradation lipid peroxidation and inhibition of Na+/K+-ATPase in rat erythrocytes exposed to acrylonitrile, J. Biochem. Toxicology 5, 221-227
- Fennell TR, MacNeela JP, Turner MJ, Swenberg JA (1989), Hemoglobin adducts formed on administration of acrylonitrile (AN) to rats, The Toxicologist 9, 128
- Adema DMM (1976), Acute toxiciteitstoetsen met 1,2-dichloorethaan, fenol acrylonitril en alkylbenzeensulfonaat in seewater, TNO Report No. MD-N&E 76/1.
- (en) Erben R et Beader B (1993b), Effect of cumene, acetone and acrylonitrile on the crabs Asellus aquaticus L. and Gammarus fossarum Koch (Isopoda, Amphipoda), Polyopr. Sumar. 29, 105-114 (résumé).
- AN Group Washington DC (1997). Acrylonitrile: determination of acute toxicity (LC50) to Sheepshead Minnow (96 h, semi-static). Inveresk Research, Tranent, Scotland.
- Analytical Bio Chemistry Laboratories Inc. (1980). Early life stage toxicity of acrylonitrile to fathead minnows (Pimephales promelas) in a flow-through system. Final report No. 25673
- AN Group Washington DC (1997). Acrylonitrile: marina alga growth inhibition test (72 hr, EC50). Inveresk Research, Tranent, Scotland
- Bayer AG (1995). Algal Inhibition test on acrylonitrile, study No. 533A/95.
- Garrison PF (1978). Preliminary studies on the effect of acetonitrile and potassium thiocyanate on the sea grass Ruppia maritima potamogetonaceae. ASSOC. Southeast Bio. Bull. 25, 68
- Giacin K., Gilbert S., Antoine A.D. (1973), Utilization of acrylonitrile-based ploymers and related monomers by soil fungi, Am. Soc. for Microbiol. Abstr., p. 175, 170
- Cicolella A, Voirin D, Hecht G, Gerber JM, Ducos P, Limasset JC (1981). Monitoring of athmospheric concentrations of acrylonitrile in eleven French factories. G. Ital. Med. lav. 3, 165-167
- Baxter RA (1979). Evaluation and control of industrial exposure to acrylonitrile. Ann. Occup. Hyg. 22, 429-435.
- Gilbert J. et Shepard M.J. (1981), Headspace gas chromatography for the analysis of vinyl chloride and other monomers in plastic packaging and in foods, J. Assoc. Publ. Analysts 19, 39-49
- Going JE, Kuykendahl P, Long S, Onstot J, Thomas K (1978), Environmental monitoring near industrial sites: acrylonitrile, PB 295928 Contract No. 68-01-4115
- Environnement Canada (Innovation réglementaire et systèmes de gestion) ; Avis de planification de la prévention de la pollution Avis obligeant l'élaboration et l'exécution d'un plan de prévention de la pollution à l'égard de l'acrylonitrile (texte de l'avis et document de travail préalable au projet d'avis), consulté 2013-05-08
- Borba H, Monteiro M, Proenca MJ, Chaveca T, Pereira V, Lynce N et Rueff J (1996). Evaluation of some biomonitoring markers in occupationally exposed populations to acrylonitrile. Teratogenesis, Carcinogenesis, and Mutagenesis 16, 205-218
- Calleman CJ, Wu Y, He F, Tian G, Bergmark E, Zhang S, Deng H, Wang Y, Crofton KM et Fennell T (1994), Relationships between biomarkers of exposure and neurological effects in a group of workers exposed to acrylamide, Toxicol. Appl. Pharmacol. 126, 361-371
- Jakubowski M, Linhart I, Pielas G, Kopecky J (1987), 2-cyanoethylmercapturic acid (CEMA) in the urine as a possible indicator of exposure to acrylonitrile. British Journal of Industrial Medicine 44, 834-840
- Esmen NA. (1998), Exposure estimation in four major epidemiologic studies in the acrylonitrile industry. Scand J Work Environ Health. 1998; 24 Suppl 2:63-70.
- Doll R (1980). Report of Acrylonitrile Epidemiological Conference, 1980. Association of Plastics manufacturers in Europe, held in Brussels
- Chen JL, Walrath J, O'Berg MT, Burke CA, Pell S (1987). Cancer incidence and mortality among workers exposed to acrylonitrile. American Journal of Industrial Medicine 11, 157-163
- Chen JL, Fayerweather WE, Pell S (1988), Cancer incidence of workers exposed to dimethylformamide and/or acrylonitrile, J. Occup. Med. 30, 813-818.
- Coggon D, Cole P. (1998), Acrylonitrile and human cancer--an overview, Scand. J. Work Environ. Health, 24 Suppl 2:81-2 (MRC Environmental Epidemiology Unit, université de Southampton, Royaume-Uni)
- Chen JL, Fayerweather WE, Pell S (1988), Mortality study or workers exposed to dimethylformamide and/or acrylonitrile, J. Occup. Med. 30, 819-821.
- Collins JJ, Page LC, Caporossi JC, Utidjian HM, Lucan LJ (1989), Mortality patterns among employees exposed to acrylonitrile, J. Occup. Med. 31, 368-371.
- Delzell E et Monson RR (1982), Mortality among rubber workers exposed to acrylonitrile, J. Occup. Med. 24, 767-769.
- Doll R (1998), The mortality of acrylonitrile workers - new evidence and a review of the old, Scand. J. Work Environ. Health 24 suppl. 2.
- Portail de l' American Conference of Governmental Industrial Hygienists
- Threshold limit value
- TWA signifie : Time weighted average ; TLV-TWA: average exposure on the basis of a 8h/day, 40h/week work schedule
- FACTS (2013), Chemical Accidents with Acrylonitrile (acn)
- ARIA, Incendie d’un pipeline d’éthylène et d’un réservoir d’acrylonitrile situé à proximité 17 mars 2008 Cologne (Rhénanie-du-Nord-Westphalie) Allemagne ; IMPEL - Ministère du Développement durable - DGPR / SRT / BARPI – Gouvernement du district de Cologne ; fiche actualisée mai 2009, consultée 2013-05-08
- Déraillement mortel en Belgique : le conducteur admet avoir roulé trop vite, Métro, publié et mis à jour 2013-05-05, consulté 2013-05-06
- « Schellebelle: Le train roulait à 87 km/h au lieu de 40 », sur LaLibre.be,
- LEXPRESS.fr (2013), L'accident de train en Belgique relance le débat sur la sécurité du rail, publié 2013-05-05
- Agence France-Presse, Belgian chemical train accident toll rises to one dead, 49 injured, 2013-05-05 20:45
- Rapport d'Enquête de Sécurité : accident du 4 mai 2013
- Gardner FF et Winnewisser G (1975). [The detection of interstellar vinyl cyanide (acrylonitrile)]. The AstrophysicalJournal 195, 127-130.
- (en) Maureen Y. Palmer, Martin A. Cordiner, Conor A. Nixon, Steven B. Charnley, Nicholas A. Teanby, Zbigniew Kisiel, Patrick G. J. Irwin et Michael J. Mumma, « ALMA detection and astrobiological potential of vinyl cyanide on Titan », Science Advances, vol. 3, no 7, , e1700022 (ISSN 2375-2548, DOI 10.1126/sciadv.1700022, lire en ligne, consulté le ).
Voir aussi
Articles connexes
Liens externes
- N. Bonnard et al., Fiche toxicologique Acrylonitrile, no 105, INRS.
- (en) Dossier Acrylonitrile / General information [PDF], HPA, 5 p.
- (en) DESCRIPTIVE SUMMARIES OF THE DATA ON THE BASIS OF WHICH THE CHEMICALS, INDUSTRIAL PROCESSES AND INDUSTRIES WERE EVALUATED FOR CARCINOGENICITY TO HUMANS [PDF] (Monographie sur l'acrylonitrile), IARC
Bibliographie
- (en) Ageeva ST (1970), The condition of the metabolism of mediating substances in workers producing acrylonitrile. Tr.Sarat. Med. Inst., 78, 10-13.
- (en) Institute for Health and Consumer Protection ; European Chemicals Bureau ; Existing Substances (2004), European Union Risk Assessment Report Acrylonitrile (CAS No: 107-13-1) 1st Priority List Volume: 32 ; 322 p.
- (en) Ya.S. Vygodskii, O.A Mel'nik, E.I. Lozinskaya et A.S. Shaplov (2005), Free-radical polymerization and copolymerization of acrylonitrile in ionic liquids ; Polymer science ; Series B, vol. 47, no 3-4, p. 122-126 5 p. et 16 références ; (ISSN 1560-0904) (résumé INIST-CNRS)
- (en) Susan C. J. Sumner, Timothy R. Fennell, Timothy A. Moore, Brian Chanas, Frank Gonzalez et Burhan I. Ghanayem (1999), Role of cytochrome P450 2E1 in the metabolism of acrylamide and acrylonitrile in mice ; - Chemical research in toxicology (Chem. Res. Toxicol.), 1999, 12 (11), p. 1110–1116 ; DOI 10.1021/tx990040k, en ligne 1999-10-28, ACS Publications (résumé)
- (en) Brieger H, Rieders F, Hodes WA. (1952), Acrylonitrile ; spectrophotometric determination, acute toxicity, and mechanism of action ; AMA Arch. Ind. Hyg. Occup. Med., août 1952, 6(2):128-40.
- (en) Beliles RP, Paulin HJ, Makris NG, Weir RJ (1980), Three-generation reproduction study of rats receiving acrylonitrile in drinking water. Litton Bionetics Inc., Project no. 2660, OTS0536313, DOC.I.D. 88-920002178
- (en) Benn T et Osborne K, (1998), Mortality of United Kingdom acrylonitrile workers - an extended and undated study ; Scand. J. Work Environ. Health 24 suppl. 2, 17-24.
- (en) Bhooma T, Padmavathi B, Niranjali Devaraj S (1992), Effect of acrylonitrile on the procoagulant activity of rat lung. Bull. Environ. Contam. Toxicol. 48, 321-326
- (en) Blair A, Stewart PA, Zaebst D, Pottern L, Zey J, Bloom T, Miller B, Ward E et Lubin J (1998), Mortality study of industrial workers exposed to acrylonitrile, Scand. J. Work Environ. Health 24 suppl. 2, 25-41.
- (en) Byrd GD, Fowler KW, Hicks RD, Lovette ME et Borgerding MF (1990), Isotope dilution gas chromographymass spectrometry in the determination of benzene, toluene, styrene and acrylonitrile in mainstream cigarette smoke. J. Chromatogr. 503, 359-368.
- (en) CEFIC (1995), Guidelines for the distribution of acrylonitrile. Rev. 2, .
- (en) Cote IL, Bowers A, Jaeger RJ (1983), Induced tolerance of acrylonitrile toxicity by prior acrylonitrile exposure. Res. Comm. Chem. Path. Pharmacol. 42, 169-172.
- (en) Davis HS et Wiedeman OF (1945), Physical properties of acrylonitrile. Ind. Eng. Chem. 37, 482-485.
- (en) Guengerich FP, Hogy LL, Inskeep PB, Liebler DC (1986), Metabolism and covalent binding of vic-dihaloalkanes, vinyl halides and acrylonitrile, IARC Sci. Publ. 70, 255-260.
- (en) Ivanov V, Rahier J, Lauwerys R (1989), Lipid peroxidation in acrylonitrile-treated rats, evidenced by elevated ethane production. J. Appl. Toxicol. 9, 353-358
- (en) Duverger-van Bogaert M, Lambotte-Vandepaer M, de Meester C, Rollmann B, Poncelet F, Mercier M (1981), Effect of several factors on the liver extract mediated mutagenicity of acrylonitrile and identification of four new in vitro metabolites. Toxicol. Let. 7, 311–9.
- (en) Lambotte-Vandepaer M, Duverger-van Bogaert M, de Meester C, Poncelet F, Mercier M (1980), Mutagenicity of urine from rats and mice treated with acrylonitrile. Toxicology 16, 67–71
- (en) Thiess AM, Fleig I (1978), Analysis of chromosomes of workers exposed to acrylonitrile. Arch. Toxicol. 41, 149–52






