Acide de Caro
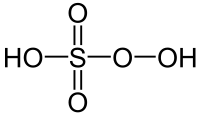
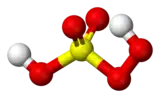
L'acide de Caro ou acide peroxymonosulfurique ou persulfurique est un puissant oxydant et acide fort de formule brute H2SO5. Il est la source des anions hydrogénopersulfate HSO5− et persulfate SO52−.
Histoire
L'acide de Caro a été décrit pour la première fois par le chimiste allemand Heinrich Caro (également codécouvreur de la synthèse de l'indigo).
Synthèse
Il existe deux voies principales de synthèse de l'acide de Caro :
- En laboratoire, il peut être produit par mélange de l'acide chlorosulfurique HSO3Cl et du peroxyde d'hydrogène H2O2 :
- À l'échelle industrielle, on le produit en réalisant un mélange piranha, c'est-à-dire un mélange d'acide sulfurique H2SO4 et de peroxyde d'hydrogène H2O2 :
- Les proportions en acide sulfurique et en peroxyde d'hydrogène peuvent varier. Traditionnellement on utilise un rapport 5 / 2 de H2SO4 à 93 % et de H2O2 à 70 %. On obtient alors un équilibre entre les différents réactifs et produits qui peut être désiré (voir utilisations).
L'acide de Caro étant instable, il est souvent produit directement sur le site de son utilisation.
Utilisations
L'acide de Caro est principalement utilisé en tant que nettoyant, pour enlever les molécules organiques des substrats. Il permet également d'hydrolyser diverses surfaces et les rendre hydrophiles.
Il est fréquemment utilisé dans l'industrie microélectronique pour nettoyer les wafers de silicium car il a l'avantage sur l'acide chromique de ne pas contaminer les surfaces qu'il nettoie avec des métaux lourds.
En laboratoire, on s'en sert pour nettoyer la verrerie quand celle-ci a été contaminée par des molécules organiques.
Il est également utilisé dans les mines d'or pour détruire les cyanures en les transformant en cyanates :
En outre, le peroxyde d'hydrogène contenu dans le mélange réagit lui aussi, bien que plus lentement :
Cette réaction est très rapide et dure moins d'une minute et permet de diminuer les rejets de cyanure des mines d'or en dessous des concentrations minimales tolérées. De plus, il s'agit d'une solution particulièrement économique car les produits utilisés pour le synthétiser sont peu onéreux et le procédé très simple à mettre en œuvre.
Voir aussi
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.