Bromométhane
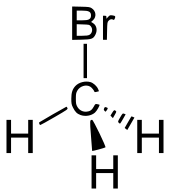
Le bromométhane ou bromure de méthyle est un composé chimique organique halogéné dont la formule chimique est la suivante : CH3Br. Il fait partie des Halogénures de méthyle (halocarbures).
| Bromométhane | |
  |
|
| Identification | |
|---|---|
| Synonymes |
Bromure de méthyle |
| No CAS | |
| No ECHA | 100.000.740 |
| No CE | 200-813-2 |
| PubChem | 6323 |
| ChEBI | 39275 |
| SMILES | |
| InChI | |
| Apparence | gaz comprimé liquéfié, incolore et inodore[1]. |
| Propriétés chimiques | |
| Formule | CH3Br [Isomères] |
| Masse molaire[2] | 94,939 ± 0,002 g/mol C 12,65 %, H 3,19 %, Br 84,16 %, |
| Moment dipolaire | 1,820 3 ± 0,000 4 D [3] |
| Propriétés physiques | |
| T° fusion | −93,66 °C [4] |
| T° ébullition | 3,56 °C [4] |
| Solubilité | dans l'eau à 20 °C : 1.5 ml/100 ml[1] |
| Paramètre de solubilité δ | 19,6 MPa1/2 (25 °C)[5] |
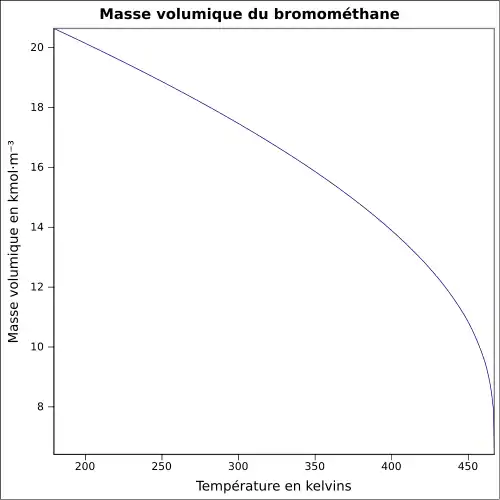
| Masse volumique | 3,973 9 g·cm-3 (0 °C,1 013 mbar) [4]
|
| T° d'auto-inflammation | 537 °C[1] |
| Point d’éclair | < 194 °C [4] |
| Limites d’explosivité dans l’air | 8,6–20 %vol [4] |
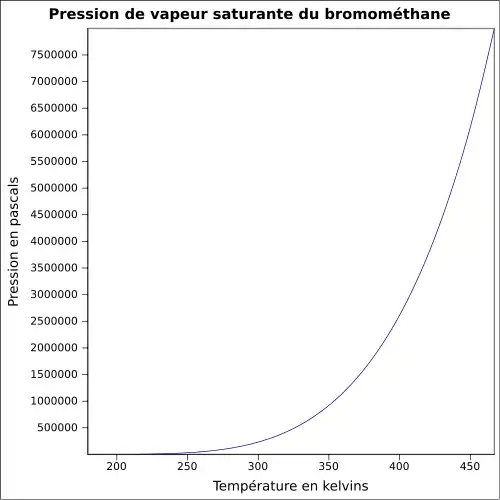
| Pression de vapeur saturante | 1,89 bar à 20 °C 2,6 bar à 30 °C 4,9 bar à 50 °C [4] |
| Point critique | (194 °C), 52,3 bar, 0,577 kg·l-1 [4] |
| Point triple | (−93,7 °C), 0,002 bar [4] |
| Thermochimie | |
| S0liquide, 1 bar | 155,14 J·K-1·mol-1 [7] |
| ΔfH0gaz | −34,3 kJ·mol-1 [7] |
| ΔfH0liquide | −60,6 kJ·mol-1 [7] |
| ΔfusH° | 6,0 kJ·mol-1 à −93,65 °C [7] |
| ΔvapH° | 23,24 kJ·mol-1 [7] |
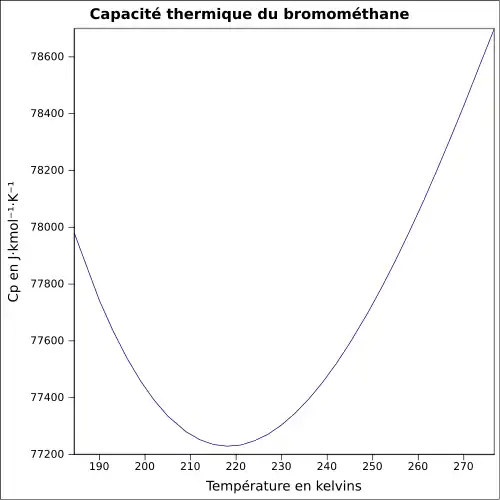
| Cp | 114,6 J·K-1·mol-1 (liquide,9,85 °C) [7]
|
| Propriétés électroniques | |
| 1re énergie d'ionisation | 10,541 ± 0,003 eV (gaz)[9] |
| Précautions | |
| SGH[10] | |
    Danger |
|
| SIMDUT[11] | |
   A, D1A, D2B, E, |
|
| NFPA 704 | |
| Transport[4] | |
| Classification du CIRC | |
| Groupe 3 : Inclassable quant à sa cancérogénicité pour l'Homme[12] | |
| Ingestion | |
| Autre | dépression du système nerveux central. Dommages au foie et aux reins. Arrêt respiratoire. |
| Écotoxicologie | |
| LogP | 1,19 [1] |
| Seuil de l’odorat | bas : 20 ppm haut : 1 000 ppm[13] |
| Unités du SI et CNTP, sauf indication contraire. | |
C'est un gaz toxique et très écotoxique, sans couleur et ininflammable sans odeur distinctive. Ses propriétés chimiques sont tout à fait semblables à celle du chlorométhane.
C'est un pesticide (insecticide), de la famille des biocides. Il fait partie des gaz réfrigérants. Le bromométhane est commercialisé sous différents noms, dont les plus connus sont l’embafume et le terabol. Il est aussi connu sous l'appellation R40B1.
Puisque c'est à la fois un gaz à effet de serre (puissant) et l'un des gaz qui détruisent la couche d'ozone qui protège la Terre d'un excès de rayonnement ultraviolet, il est prévu de l'interdire depuis longtemps, mais seuls certains pays ont appliqué cette interdiction, la France depuis 2005 (avec des dérogations pour certains usages) et l'Union européenne depuis 2011.
Lors de la Trentième Réunion des Parties au Protocole de Montréal relatif à des substances qui appauvrissent la couche d'ozone, se déroulant à Quito, capitale de l'Équateur, le Canada, l'Australie, l'Argentine et l'Afrique du Sud obtinrent également des dérogations pour l'utilisation de bromure de méthyle pour 2019 et 2020[14]
Origine
Le bromométhane existe en petite quantité dans la nature où il se forme naturellement dans l’océan, synthétisé par le phytoplancton (et le varech ?).
Quand il est biogénique (d'origine naturelle, produit par le vivant), il joue dans la nature un rôle encore incompris. Il pourrait peut être impliqué dans le rétrocontrôle du climat (car si son temps de séjour dans l'atmosphère est court (environ 1 an[15]), c'est un puissant gaz à effet de serre[15] et il inhibe la production d'ozone stratosphérique[15].
Lors d'une expérience récente de géoingénierie visant à augmenter les capacités de puits de carbone marin par fertilisation de l'océan en fer à moyenne échelle (surface de moins de 1 000 km2), il a été constaté un effet adverse : une production accrue de bromométhane océanique[15].
Il provient également de certaines plantes terrestres, notamment celles de la famille des brassica.
Industriellement, en tant que biocide, il est fabriqué par réaction du méthanol avec l’acide bromhydrique.
Utilisations
Jusqu'à ce que sa production et son usage aient été réduits ou proscrits par le protocole de Montréal (signé en 1987, mais encore incomplètement respecté), il était couramment et massivement employé comme agent de stérilisation des sols, principalement pour la production de semences mais également pour certaines cultures maraîchères comme les fraises.
Le bromométhane a été également utilisé comme fumigant d'usage universel pour éliminer une grande variété de nuisibles, des rats aux insectes, en passant par les champignons microscopiques. Il l'est encore pour certains usages (désinfection de bois importés). Il sert également de précurseur pour la fabrication d'autres produits chimiques, et il a été utilisé comme solvant pour l’extraction des huiles à partir des graines et comme dégraissant de la laine.
Lorsque le protocole de Montréal a sévèrement restreint l'utilisation du bromométhane au niveau international, certains pays, dont les États-Unis ont incité à des dérogations pour l’emploi du produit en usage contrôlé. En 2004, la dernière année pour laquelle les données sont disponibles, plus de 3 000 tonnes de bromométhane ont ainsi été pulvérisées dans les champs californiens.
En 2017, près de 10 000 tonnes de bromure de méthyle avaient été utilisées pour la quarantaine et les traitements préalables à l’expédition et ce chiffre était en hausse. Au cours des dix dernières années, la quantité de bromure de méthyle utilisée pour la quarantaine et les traitements préalables à l’expédition avait plus que doublé dans certaines pays, en raison peut-être d’une intensification des échanges commerciaux, des dangers posés par les ravageurs de quarantaine, et/ou d’une classification abusive de certaines utilisations comme utilisations pour la quarantaine et les traitements préalables à l’expédition. Ces dernières étaient la principale composante des émissions globales, représentant approximativement 7 500 tonnes par an. Le bromure de méthyle utilisé pour la quarantaine et les traitements préalables à l’expédition était hautement volatil (jusqu’à 95 % du bromure de méthyle ainsi utilisé pourrait être rejeté directement dans l’atmosphère après la fumigation). Les avancées dans les techniques de récupération et de destruction pourraient, toutefois, réduire sensiblement les émissions[16].
Le bromométhane était autrefois utilisé dans les extincteurs spéciaux, avant l'avènement des halons moins toxiques, car il est électriquement non conducteur et ne laisse aucun résidu. Il était principalement utilisé pour les sous-stations électriques, les avions militaires et contre certains risques industriels. Il n'a jamais été aussi populaire que d'autres agents en raison de son coût élevé et de sa toxicité. Le bromométhane a été utilisé des années 1920 aux années 1960. En France, le décret n° 59-449 du interdit à compter du , la fabrication, la détention, le remplissage, la cession à titre onéreux ou gratuit des extincteurs d'incendie chargés en bromure de méthyle ou en tétrachlorure de carbone[17].
Destruction de la couche d’ozone
Le bromométhane est sur la liste des substances interdites par le protocole de Montréal à cause des risques de destruction de la couche d’ozone. Puisque le brome est 60 fois plus nocif que le chlore, même une faible quantité de bromométhane suffit à causer des dommages considérables à la couche d'ozone. En 2005 et 2006, cependant, on lui a accordé une dérogation pour un usage contrôlé dans le cadre du protocole de Montréal.
Controverses
Le protocole de Montréal stipule que l'usage du bromométhane doit être interdit, mais ce produit présentait de nombreux avantages notamment pour le traitement des bois, sols, grains et semences, et pour certains usages, il n'y a pas de produits de substitution disponible au même coût ou aussi pratique. Le bromométhane est utilisé aux États-Unis pour préparer les terrains de golf et le gazon des surfaces utilisées pour différentes compétitions sportives, en particulier pour l'entretien de gazons de Cynodon dactylon. L'administration de George W. Bush a adopté des dérogations pour empêcher la désorganisation des marchés.
Une évaluation des risques a été mise à jour en 2010 par l'EFSA[18]
Effets sur la santé
S’il est inhalé à une concentration élevée pendant une période courte, il provoque des maux de tête, des vertiges, des nausées, des vomissements des malaises. Ces symptômes peuvent être suivis de signes d'excitation nerveuse, convulsions et même de troubles psychiques aigus à type d’agitation maniaque. L’inhalation prolongée à des concentrations plus faibles peut causer une irritation bronchique et des troubles pulmonaires.
Le liquide brûle la peau, provoque des démangeaisons et un érythème, puis des phlyctènes plusieurs heures après contact. Le liquide et le gaz provoquent des brûlures oculaires sévères.
Les niveaux d'exposition pouvant provoquer la mort varient de 1 600 à 60 000 ppm, suivant la durée de l'exposition.
Les atteintes respiratoires, rénales, et neurologiques concernent davantage de personnes. Aucun cas d’effets graves à long terme sur le système nerveux n'a été noté chez l’homme à la suite d’une exposition à des niveaux faibles, mais des études sur les lapins et les singes ont montré des lésions qualifiées de modérées à graves.
Production et dégradation
Les sources de production du CH3Br comprennent la production océanique, les émissions des plantes et des marais, la combustion de la biomasse, la fumigation des sols, et les gaz d’échappement des véhicules fonctionnant au carburant plombé, ainsi que l’industrie, la production de biens de consommation durable et de denrées périssables. Sa production industrielle décline, mais n'a pas été stoppée, y compris en France[19]
La dégradation du polluant se fait par décomposition photochimique dans l'atmosphère (réaction avec le radical chimique hydroxyle(OH)) et par oxydation[20] (qui donne comme produits secondaires BrC(O)CH3 et BrC(O)H), ou par photodécomposition à des altitudes plus élevées.
À ces moyens d’élimination il faut ajouter les pertes (adsorption, dégradation) dans les sols, la dégradation chimique et biologique dans l'océan, et un certain recyclage par les plantes vertes.
Alternatives
Pour de nombreux usages (ex : traitement du bois, fumigation du sol avant plantation[21]), il n'existe aucune alternative aussi facile à mettre en œuvre (ou alors, avec un risque toxique plus important, si l'on utilise par exemple comme alternative la chloropicrine utilisée durant la Première Guerre mondiale comme gaz de combat et comme gaz pour tuer les animaux dans leurs terriers, ou le dazomet...)
- Des traitements thermiques sont utilisables pour désinfecter les sols de serre (hormis contre les vitres) ou de poulailler (avec le même matériel que pour le désherbage thermique éventuellement)
- Lutte intégrée ; par exemple selon l'Anses[22], pour l'agriculture, l'agriculteur peut associer
- l’examen attentif des parcelles de multiplication,
- la culture de variétés à haut niveau de résistance,
- la production de semences sur des parcelles indemnes,
- l’échantillonnage et analyse des lots de semences,
- l’élimination des débris végétaux associés aux semences,
- des pratiques culturales limitant les risques de pullulation d'un pathogène (rotations, etc.).
Notes et références
- BROMURE DE METHYLE, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) David R. Lide, Handbook of chemistry and physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1 et 1-4200-6679-X), p. 9-50
- Entrée « Bromomethane » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 19 février 2009 (JavaScript nécessaire)
- (en) James E. Mark, Physical Properties of Polymer Handbook, Springer, , 2e éd., 1076 p. (ISBN 978-0-387-69002-5 et 0-387-69002-6, présentation en ligne), p. 294
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, , 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50
- (en) « Methyl bromide », sur NIST/WebBook, consulté le
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 1, 2 et 3, Huston, Texas, Gulf Pub. Co., (ISBN 0-88415-857-8, 0-88415-858-6 et 0-88415-859-4)
- (en) David R. Lide, Handbook of chemistry and physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 10-205
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- « Bromométhane » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Évaluations globales de la cancérogénicité pour l'Homme, Groupe 3 : Inclassables quant à leur cancérogénicité pour l'Homme », sur http://monographs.iarc.fr, CIRC, (consulté le )
- « Methyl bromide », sur hazmap.nlm.nih.gov (consulté le )
- Programme des Nations Unies pour l'environnement, Rapport de la trentième Réunion des Parties au Protocole de Montréal relatif à des substances qui appauvrissent la couche d'ozone, Décision XXX/9: Dérogations pour utilisations critiques de bromure de méthyle pour 2019 et 2020.
- Fertilisation des océans : atténuation des impacts environnementaux de la recherche scientifique ; Secrétariat canadien de consultation scientifique Avis scientifique 2010/012 (version publiée en avril 2010 et mise à jour: juin 2010, consultée 2013-09-17) ; voir page 9/15 du PDF
- Rapport de la trentième Réunion des Parties au Protocole de Montréal relatif à des substances qui appauvrissent la couche d'ozone, UNEP/Ozl.Pro.30/11, Annexe VI, au paragraphe 74.
- « interdiction des extincteurs d'incendie chargés en bromure de méthyle », sur legifrance (consulté le )
- EFSA 12/01/11 <Peer Review of the pesticide risk assessment of the active substance methyl bromide
- |http://www.ifen.fr/uploads/media/couche_ozone_01.pdf Données actuelles et prospectives de production pour la France]
- Atmospheric Oxidation Mechanism of Bromoethane
- Duniway, J. M. (2002). Status of chemical alternatives to methyl bromide for pre-plant fumigation of soil. Phytopathology, 92(12), 1337-1343.
- Anses (2013) Analyse de risque phytosanitaire Ditylenchus dipsaci sur luzerne Avis de l’Anses Rapport d’expertise collective, avril 2013, PDF, 146 pages
Liens externes
- (fr) Fiche toxicologique de l'INRS (version 2007)
- (fr) Fiche canadienne sur la Lutte antiparasitaire durable et intégrée suppression du bromure de méthyle (PDF, 41p)
- MSDS : Hazardous Chemical Database
- ChemSub Online (Bromométhane).