Pression atmosphérique
La pression atmosphérique est la pression qu'exerce le mélange gazeux constituant l'atmosphère considérée (sur Terre : de l'air) sur une surface quelconque en contact avec elle. Les molécules de ce mélange, animées d'un mouvement aléatoire incessant, l'agitation thermique, subissent des collisions entre elles et contre les surfaces des objets. Les forces d'impact dues aux chocs de ces molécules sur les objets présents dans l'atmosphère résultent en des forces réparties sur la surface de ces objets et qui sont responsables de la pression atmosphérique (forces pressantes des molécules de l'atmosphère par unité de surface).
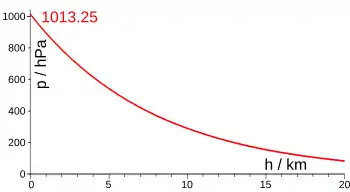

Plus précisément, la gravité présente sur Terre comprime l'atmosphère vers le sol de telle sorte qu'à chaque niveau, la pression locale ainsi générée soit suffisante pour supporter le poids total de la colonne d'air sus-jacente. La pression atmosphérique au niveau de la mer est en moyenne de 1 013,25 hPa ou 1 atm. Elle dépend essentiellement de la masse de l'atmosphère, qui, étant distribuée de façon complexe par la circulation atmosphérique globale, fait varier la pression d'un endroit à l'autre.
La pression atmosphérique se mesure à l'aide d'un baromètre, d'un hypsomètre ou d'un altimètre. Elle a été longtemps mesurée en millimètres de mercure (symbole mmHg ; nommé aussi torr, symbole Torr) en raison de l'utilisation courante du baromètre à colonne de mercure.
Depuis l'adoption du pascal dans le Système international d'unités (SI) comme unité de la pression, les météorologues utilisent un multiple de cette unité, l'hectopascal (hPa), qui a l'avantage de correspondre exactement au millibar utilisé auparavant : 1 hPa = 1 mbar.
Historique
En 1638, Galilée écrit Discours et démonstrations mathématiques concernant deux nouvelles sciences (en), où il décrit diverses expériences, dont une conçue par Aristote qui permet de mettre en évidence le poids de l'air grâce à une bouteille contenant l'air comprimé[2]. Dans son ouvrage, le savant rapporte une observation que les fontainiers de Florence lui ont soumise sur l'impuissance où se trouvent les pompes aspirantes des fontaines à soulever l’eau au-dessus de 10 mètres. Galilée attribue cette impuissance à une cause intrinsèque, l'horreur limitée du vide, en reprenant l'idée aristotélicienne fausse de l'horror vacui (« la nature a horreur du vide »). En 1643, Torricelli, ami et disciple de Galilée, réalise une expérience (en) qui lui permet d'attribuer l'élévation de l'eau à une cause extérieure, la pression atmosphérique, et de mesurer précisément le poids de l'atmosphère[3]. Les expériences des hémisphères de Magdebourg réalisées par Otto von Guericke à partir de 1654 montrent que la pression atmosphérique pousse les deux demi-boules l'une contre l'autre à raison de dix tonnes par mètre carré.
Pression atmosphérique normale
La pression atmosphérique réellement mesurée varie autour de la pression atmosphérique normale fixée, par définition[4], comme étant, au « niveau de la mer » (niveau moyen), à la température de 15 °C, de :
- 101 325 Pa ;
- soit 1 013,25 hPa.
- Autres unités hors SI
Dans les anciennes unités du Système CGS, la pression atmosphérique normale vaut :
- 1,013 25 bar ;
- 1 013,25 mbar ;
- 1 013 250 baryes.
Par définition du millimètre de mercure (mmHg) et du torr (Torr) qui lui est égal, la pression atmosphérique normale vaut exactement 760 mmHg = 760 Torr.
Enfin la pression atmosphérique normale permet elle-même de définir une unité de pression : 1 atm = 101 325 Pa.
À 20 °C, la vitesse moyenne des molécules d'air à pression atmosphérique normale est d'environ 500 m /s (1 800 km/h), à 100 °C, cette vitesse d'agitation atteint 560 m/s (2 016 km/h)[5]. Mais à 20 °C et à la pression atmosphérique, la distance moyenne entre les molécules est de l'ordre de dix fois le diamètre de ces molécules et le libre parcours moyen de l'ordre de 100 fois ce diamètre. Les molécules s'entrechoquent très souvent (chacune subit en moyenne une collision toutes les 10-10 secondes), elles ne gardent cette vitesse que sur de très courtes distances)[6].
Variation verticale
La pression atmosphérique diminue quand l'altitude augmente, car la masse -- et donc le poids -- de l'air sus-jacent diminue nécessairement avec la hauteur, comprimant l'air de moins en moins. La pression diminue, exponentiellement, d'un facteur 10 chaque fois que l'on s'élève de 16 km (ou de moitié à 5 500 m). Il est ainsi possible d'utiliser la pression pour mesurer la hauteur, ce qui est le principe de base de l'altimètre utilisé en aéronautique et en alpinisme.
En météorologie appliquée, la pression est souvent utilisée directement comme coordonnée verticale. On parlera par exemple de la température à (une « hauteur » de) 700 hPa. Cette approche a des avantages techniques et elle simplifie certaines équations utilisées en météorologie.
Stabilité et instabilité
En règle générale, la pression atmosphérique diminue de moitié à environ 5 500 mètres et la température moyenne de l'atmosphère diminue de 9,7 °C par 1 000 mètres[7]. Cependant, ce taux n'est valable que pour une atmosphère normalisée et varie en fait selon le contenu en vapeur d'eau et l'altitude. Ces propriétés peuvent être démontrées rigoureusement si l'on fait l'hypothèse que l'atmosphère est en équilibre (bien que cela demeure une excellente approximation, cela n'est pas tout à fait vrai en pratique).
Lorsque le sol est chauffé par le Soleil, par convection, les basses couches de l'atmosphère sont réchauffées et comme l'air chaud est moins dense, l'air réchauffé va avoir tendance à s'élever grâce à la poussée d'Archimède. Si la poche d'air chaud se refroidit moins vite que l'air environnant, cette parcelle d'air va accélérer vers le haut. On est alors en présence d'une masse d'air instable. Dans le cas contraire, l'air en ascension devient plus froid que l'air environnant, le mouvement ascendant va s'interrompre et l'atmosphère est alors stable.
Le taux de refroidissement de la masse d'air en ascension peut être calculé théoriquement, ou sur un diagramme thermodynamique, par rapport à la température de l'environnement donnée par un radiosondage. Ce calcul repose sur l'hypothèse qu'il n'y a pas d'échange calorique avec l'air extérieur et que le taux de changement de température est différent si l'air est saturé ou pas. Dans le premier cas, la vapeur d'eau condensée est retirée de la masse en ascension.
Variation horizontale


Les météorologues analysent les variations horizontales de la pression atmosphérique pour localiser et suivre les systèmes météorologiques : cela permet de définir les zones de dépressions (D) (pression généralement inférieure à 1 013 hPa, 760 mmHg), les zones anticycloniques (A) (pression généralement supérieure à 1 013 hPa, 760 mmHg) et les isobares. Les dépressions et les creux barométriques sont généralement associés au mauvais temps. Les anticyclones et les crêtes barométriques sont quant à eux favorables au beau temps.
La différence de pression entre deux points de même altitude (ou gradient horizontal de pression) est également la plus importante force motrice du vent : des valeurs de 5 hPa/km ont été observées dans les cyclones tropicaux les plus violents.
Afin d'utiliser la pression pour suivre les systèmes météo et estimer la force du vent, il est nécessaire de faire concorder des mesures de pression qui ont été prises à différentes altitudes : en mer, dans les vallées, en montagne. Pour ce faire, on soumet les mesures brutes de pression à un ajustement standardisé. La valeur résultant de cet ajustement est appelée pression au niveau de la mer, ou PNM. Si l'on prend par exemple le cas d'une station située à 100 mètres au-dessus du niveau de la mer, l'ajustement sera effectué en estimant la pression au fond d'un trou fictif, de 100 mètres de profondeur, qu'on aurait creusé à la station. Plus précisément, la valeur de la PNM est fonction de la pression mesurée à la station et de la température assignée à la colonne d'air fictive. Pour cette dernière on utilise la moyenne de la température actuelle à la station et de celle mesurée douze heures auparavant. La PNM est une approximation d'une grande utilité, mais il faut se garder de lui donner toute la valeur d'une mesure physique exacte, particulièrement en terrain montagneux. La pression atmosphérique mesurée au niveau de la mer varie autour d'une valeur moyenne de 1 013 hPa.
La pression mesurée au sol est utilisée pour l'étalonnage et la validation des données en provenance d'instruments météorologiques de mesure à distance. Des mesures précises de pression sont ainsi un fondement nécessaire pour l'observation de la Terre et du climat.
Valeurs types
- Ouragan[8] de classe 5 : pression au centre inférieure à 920 hPa
- Ouragan de classe 4 : pression au centre comprise entre 920 et 944 hPa
- Ouragan de classe 3 : pression au centre comprise entre 945 et 964 hPa
- Ouragan de classe 2 : pression au centre comprise entre 965 et 980 hPa
- Ouragan de classe 1 : pression au centre supérieure à 980 hPa
Valeurs records
- PNM maximum :
- pour une station à plus de 750 mètres d'altitude : 1 086,8 hPa, à Tosontsengel (Mongolie), le [9] (mais l'Organisation météorologique mondiale ne reconnaît encore que 1 084,8 hPa au même endroit le [10]). Cette valeur est obtenue tenant compte de la réduction au niveau de la mer de la pression avec une hypothétique colonne d'air très importante sous la station ;
- pour une station sous 750 mètres d'altitude : 1 083,8 hPa, Agata, Evenhiyskiy, Russie[11] ;
- PNM minimum :
- 870 hPa, au large des Philippines, près du centre du typhon Tip, le [12] ;
- des pressions plus basses encore ont été enregistrées au sein de violentes tornades, mais ces mesures demeurent non officielles ;
- selon une analyse des données d'un satellite météorologique, la pression minimale de 868,5 hPa[13] a été estimée le à 7 h 15 UTC au centre du cyclone Monica, lorsqu'il a frappé au nord de Maningrida, en Australie. Cette mesure est basée sur une variante améliorée de la technique de Dvorak et non une mesure directe, ce qui la rend impossible à prouver. En 2010, Stephen Durden, du Jet Propulsion Laboratory de la NASA, a révisé les données sur le cyclone et a publié un article montrant que la pression centrale ne devait pas avoir été plus basse que 900 à 920 hPa[14].
Observations et expériences
Expérience du verre retourné
_(6).jpg.webp)
L'expérience du « verre retourné » ou « verre inversable » consiste à remplir un verre de liquide non gazeux, recouvrir son ouverture d'une feuille de papier cartonné (ou un support équivalent)[15], retourner délicatement le verre puis retirer la main qui maintient le papier. Le liquide reste dans le verre. Cette observation contre-intuitive s'explique de la manière suivante : la pression atmosphérique (environ 1 kg/cm2) et, dans une moindre mesure la tension superficielle, exercent une force verticale ascendante plus importante que le poids du liquide contenu dans le verre et la pression de l'air au fond du verre. Si le support est retiré, le liquide s'échappe bien que la pression atmosphérique exerce la même force ascendante : les forces gravitationnelles (déstabilisantes) prennent le pas sur les forces de tension superficielle (stabilisantes) et déclenchent l'instabilité de Rayleigh-Taylor[16].
Un corollaire de cette expérience est l'ouverture d'un bocal de confiture, de conserve en verre ou de pot de bébé, rendue difficile par la pression atmosphérique supérieure à la pression de l'air extrêmement faible sous le couvercle. Un autre corollaire est « l'eau bouillant sans feu » avec l'ouverture d'un verre sans pied recouvert d'un mouchoir enfoncé dans l'intérieur de façon qu'il soit en contact avec la surface liquide et rabattu extérieurement autour du verre. Une fois le verre renversé, ramener avec une main le mouchoir jusqu'à ce qu'il se trouve bien tendu sur l'ouverture. On entend alors un bouillonnement et on observe de grosses bulles s'élever à travers l'eau agitée comme si elle bouillait. En tendant le mouchoir, on produit un « vide partiel » à l'intérieur du verre, ce qui entraîne l'air extérieur à traverser les pores du tissu et de l'eau pour combler ce « vide »[17].
Expérience de l'ascension de l'eau dans une enceinte où un combustible a brûlé
La combustion d'une allumette ou d'une bougie qui repose sur le fond d'un récipient empli d'eau (assiette, cristallisoir …) et qui est placée sous une enceinte (typiquement un verre), met en évidence la pression atmosphérique[18]. La consommation partielle d'oxygène[19] due à la combustion de la cire de paraffine[20] produit du dioxyde de carbone CO2 et de l'eau H2O, deux produits de réaction qui sont sous forme gazeuse. Le refroidissement du gaz résiduel (contraction thermique)[21] et la condensation de la vapeur d'eau (observable par la formation de buée sur les parois internes de l'enceinte) entraînent une diminution de la pression interne qui devient inférieure à la pression atmosphérique externe. Contrairement aux idées reçues parfois enseignées, c'est principalement ce phénomène qui explique que l'eau est poussée vers l'intérieur du verre par la pression atmosphérique[22] - [23].
Notes et références
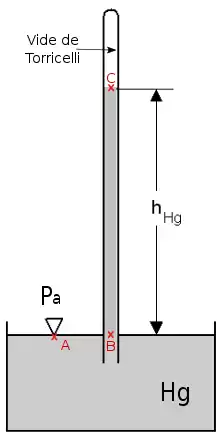
- En hydrostatique, le poids de la colonne de mercure (P=mHgg) est équilibré par le poids de l'air qui appuie sur la totalité de la surface libre du mercure dans la cuve. En rapportant ces deux forces à une même unité de surface, on peut écrire que la pression qui s'exerce sur la surface du mercure contenu dans la cuve (PA = Patm = Pa car le point A est au contact de l'air ambiant) est égale à la pression dans le mercure au niveau de l’ouverture du tube (PB). Dans le tube de Torricelli plongeant dans un bain de mercure (de symbole Hg et de masse volumique ρ), la colonne est surmontée de vide (appelée vide de Torricelli), ou plus précisément de vapeur de mercure à la pression de vapeur saturante (à 20°C, p*(Hg) = 0,16012 Pa). Cette valeur étant négligeable au regard de la pression atmosphérique, on peut admettre que PC ≈ 0. La différence de pression entre deux points B et C (situés à une hauteur telle que hB - hC = h) et hC, situés respectivement à une profondeur hB et hC est donnée par la loi fondamentale de l'hydrostatique pour un fluide incompressible entre différents points :
Pour le mercure, Patm = 101 325 Pa, ρ = 13 600 kg/m3, 9,81 m/s2, d'où h = 760 mm Hg. Pour l'eau ρ = 1 000 kg/m3 et h = 10,3 m H2O. Cf Physique chimie, Bordas, , p. 251 - (en)Schéma de l'expérience de Galilée
- (en) Howard Margolis, It Started with Copernicus: How Turning the World Inside Out Led to the Scientific Revolution, McGraw-Hill, , p. 174
- Pression atmosphérique normale, Météo-France
- Idées & Notions en Sciences de la matière, Encyclopaedia Universalis, , p. 77-78
- Georges Bruhat, Thermodynamique, Masson, , p. 477
- (en) Kshudiram Saha, The Earth's Atmosphere : Its Physics and Dynamics, Berlin, Springer-Verlag, , 367 p. (ISBN 978-3-540-78426-5), p. 31
- Les différentes classes de cyclones.
- « Record absolu de pression en Mongolie », sur La Chaîne Météo, (consulté le ).
- (en) Organisation météorologique mondiale, « World: Highest Sea Level Air Pressure Above 750 meters », sur Université d'Arizona (consulté le ).
- (en) Organisation météorologique mondiale, « World: Highest Sea Level Air Pressure Below 750 meters », sur Université d'Arizona (consulté le ).
- (en) Organisation météorologique mondiale, « World: Lowest Sea Level Air Pressure (excluding tornadoes) », sur Université d'Arizona (consulté le ).
- (en) « Advanced Dvorak Technique Intensity listing for Cyclone Monica (Maningrida, Australie) », CIMSS (consulté le ).
- (en) Stephen L. Durden, « Remote Sensing and Modeling of Cyclone Monica near Peak Intensity », Atmosphere, Multidisciplinary Digital Publishing Institute, vol. 1, no 1, , p. 15–33 (ISSN 2073-4433, DOI 10.3390/atmos1010015, lire en ligne, consulté le ).
- Feuille de papier cartonnée (carte de visite, carte postale), essuie-tout… L'expérience marche aussi avec une gaze, une toile métallique ou une passoire qui font intervenir plus intensément un autre phénomène physique, la tension superficielle, laquelle explique que l'expérience ne « marche » pas avec du papier plastifié ou graissé avec un peu d'huile.
- Jean-Michel Courty et Édouard Kierlik, « Des fluides sens dessus dessous », Pour la science, no 467, , p. 89-91 (lire en ligne)
- Raoul Marquis, 100 expériences physiques, A.-L. Guyot, , p. 30-31
- Cette expérience remonte à Philon d'Alexandrie. Cf, Francisco Vera, op. cit., p. 882.
- L'extinction progressive de la flamme n'est pas due à la disparition de l'oxygène mais au dégagement de CO2 qui entre en contact avec le verre, se refroidit et « tombe » sur la flamme qui est étouffée (atmosphère appauvrie en oxygène rendant toute combustion impossible). Cette propriété explique la recommandation, lors d'un incendie, de ramper au sol sous les fumées pour y capter l'air frais moins étouffé par le CO2. Cf [vidéo] Scilabus, Une expérience de bougie démythifiée sur YouTube, , (en) James P. Birk & Anton E. Lawson, « The Persistence of the Candle-and-Cylinder Misconception », J. Chem. Educ., vol. 76, no 7, , p. 914 (DOI 10.1021/ed076p914)
- La vapeur de cire qui réagit avec l'oxygène donne la réaction suivante : CnH2n+2 (s) + (1.5n + 0.5) O2 (g) → CO2 (g) + (n+1) H2O (g)
- L'expérience de l'œuf dur ou du ballon de baudruche « aspiré » à travers le goulot d'une bouteille ou d'un flacon chauffés (rincée à l'eau chaude, allumettes enflammées et plongées dans le récipient) puis refroidie, repose également sur le principe de la contraction qui crée une dépression à l'intérieur de la bouteille.
- (en) Harold R. Hunt, Toby F. Block, George M. McKelvy, Laboratory Experiments for General Chemistry, Brooks/Cole-Thomson Learning, , p. 146-149
- (en) Francisco Vera, Rodrigo Rivera, César Núñez Ramírez, « Burning a Candle in a Vessel, a Simple Experiment with a Long History », Science & Education, vol. 20, no 9, , p. 881-893 (DOI 10.1007/s11191-011-9337-4)
Voir aussi
Articles connexes
Liens externes
- Expériences sur l'air et la pression atmosphérique
- [vidéo] clipedia, La pression atmosphérique : introduction sur YouTube,



