Thiocyanate
Les thiocyanates sont des composés intégrant l'anion −[S-C≡N], qui est la base conjuguée de l'acide thiocyanique (HSCN). Ils sont tautomères des thioisocyanates, possédant le groupe [S=C=N]− (charge sur l'atome d'azote) comme l'acide thioisocyanique (HNCS) l'est vis-à-vis de l'acide thiocyanique.

Les sels incolores thiocyanate de potassium et thiocyanate de sodium sont des exemples communs de tels composés.
Le thiocyanate de mercure(II) était autrefois utilisé en pyrotechnie.
Les composés organiques qui contiennent le groupe SCN sont aussi appelés thiocyanates.
Synonymes
Les thiocyanates sont connus sous les noms de sulphocyanates, thiocyanures et rhodanures [1].
Description
L'anion thiocyanate est analogue à l'ion cyanate, [OCN]− dans lequel l'atome d'oxygène est remplacé par un atome de soufre. Il est aussi un pseudohalogénure à cause de la similarité de ses réactions avec celles d'un ion halogénure. Il est aussi un cofacteur important dans le cadre de la détoxification du peroxyde d'hydrogène par une peroxydase (lactoperoxydase, myéloperoxydase) et permet la production d'hypothiocyanite
Synthèse
Des thiocyanates sont naturellement produits par certains végétaux.

L'industrie chimique le produit par la réaction du soufre élémentaire ou de thiosulfate sur l'ion cyanure:
- 8 CN− + S8 → 8 SCN−
- CN− + S2O32− → SCN− + SO32−
Cette dernière réaction est catalysée par l'enzyme sulfotransférase rhodanase et peut être pertinente pour la désintoxication des cyanures absorbés par un être vivant.
Structure, liaison et chimie de coordination
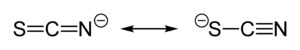
La charge négative du thiocyanate est partagée à peu près également entre l'atome de soufre et l'atome d'azote. En conséquence, le thiocyanate peut agir comme nucléophile aussi bien avec l'atome de soufre que celui d'azote. De plus, il est un ligand ambidente et bidente comme pour ponter deux atomes métalliques (M−SCN−M') et même tridente (>SCN− ou −SCN<). Les données expérimentales conduisent à la conclusion générale que les métaux de classe A (en) (acides durs) tendent à former des complexes N-thiocyanates tandis que les métaux de classe B (en) (acides mous) tendent plutôt à former des complexes S-thiocyanates. D'autres facteurs, par exemple cinétiques et de solubilité, sont parfois associés et des isoméries de liaison peuvent se produire, par exemple [Co(NH3)5(NCS)]Cl2 et [Co(NH3)5(SCN)]Cl2[2].
Thiocyanates organiques
Les dérivés organiques ou de métaux de transition du thiocyanate peuvent exister sous forme d'isomères de liaison. Pour les thiocyanates, le groupe organique ou le métal de transition est attaché au soufre : R−S−C≡N qui a une liaison S-C simple et une triple liaison C-N[3]. Dans les isothiocyanates, le substituant est attaché par l'azote : R−N=C=S qui a deux doubles liaisons pour S-C et C-N.

Les thiocyanates organiques sont hydrolysés en thiocarbamates dans la synthèse de Riemschneider.
Santé, toxicologie, médecine
La carence, comme l'excès de thiocyanate semblent source de problèmes de santé. La salive humaine en contient naturellement une faible quantité, que l'on a mesuré et qui augmente chez les fumeurs, en réponse semble-t-il au monoxyde de carbone[4] (0,031 +/- 0,0052 g/l chez une personne saine non fumeur, et 0,039 +/- 0,0048 g/l chez une personne en bonne santé mais fumeur 0,048 +/- 0,0161 g/l[5]). Le thiocyanate présent dans la salive est très stable (ne diminue pas après un stockage d'échantillons conservés dans un contenant fermé, à 20 °C durant un an)[6].
Les effets d'un excès de thiocyanate sur la santé humaine ou d'autres mammifères sont encore discutés, mais comme les nitrates et les perchlorates, ils font partie des perturbateurs endocriniens en tant que molécules dites « goitrogènes »[7]. Les thiocyanates interagissent en effet avec la thyroïde en freinant la capacité de cette glande à capter l'iode qui lui est nécessaire, comme le font les nitrates et plus encore les perchlorates[7], molécules avec lesquelles les nitrates peuvent développer des effets cumulatifs ou synergiques[7].
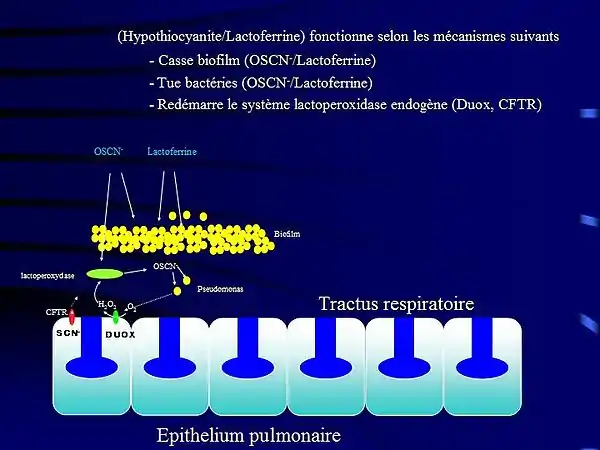
Les thiocyanates sont en revanche nécessaires à certains processus biologiques de l'immunité (Cf. lactoperoxydase[8] - [5]) chez les plantes et dans l'organisme animal et humain[9] comme substrat dans la biosynthèse de l'hypothiocyanite catalisée par une peroxydase[10] - [11] - [12].
Une carence interne en « conjugués de thiocyanate avec le glutathion »[13] ou une carence en thiocyanate[5] dans le corps humain, comme dans une mucoviscidose, a une très grande influence sur le système immunitaire[14].
Le thiocyanate a des fonctions antioxydantes récemment (2009) confirmées, qui peuvent jouer un rôle contre certaines pathologies inflammatoires et fibroses[15].
Indicateur
C'est un des indicateurs biochimiques de tabagisme, qui peut être en tant que tel recherché dans la salive prélevée sous la langue ou en zone parodontale de la bouche [16], à condition de bien prendre en compte les biais qui pourraient être suscités par une salivation ou hypersalivation stimulée[17]
Test de l'ion Fe (III)
Si du thiocyanate [SCN]− est ajouté dans une solution qui contient des ions Fe3+, la solution devient rouge sang par la formation de complexes [Fe(NCS)(H2O)5]2+.
![Le complexe rouge sang pentaaqua(thiocyanato-N)fer(III), [Fe(NCS)(H2O)5]2+, indique la présence de Fe3+ en solution.](https://img.franco.wiki/i/Pentaaquathiocyanatoiron(II)-3D-balls.png.webp) Le complexe rouge sang pentaaqua(thiocyanato-N)fer(III), [Fe(NCS)(H2O)5]2+, indique la présence de Fe3+ en solution.
Le complexe rouge sang pentaaqua(thiocyanato-N)fer(III), [Fe(NCS)(H2O)5]2+, indique la présence de Fe3+ en solution.n)_hydrate_mix.jpg.webp) Test du Fe3+
Test du Fe3+
Notes et références
- Les thiocyanates ont été autrefois connus sous ce nom, rhodanure du mot grec pour la couleur rose car il forme des complexes de cette couleur avec le fer.
- (en) N. N. Greenwood et A. Earnshaw, Chemistry of the elements, Oxford Boston, Butterworth-Heinemann, , 2e éd. (1re éd. 1984), 1341 p. (ISBN 978-0-7506-3365-9, OCLC 804401792), p. 326.
- Guy, R. G., Syntheses and Preparative Applications of Thiocyanates in "Chemistry of Cyanates and Their Derivatives", vol II. Patai, S., (Editor), John Wiley, 1977, New York.
- The saliva thiocyanate analysis : a methodological extension and its relationship to CO and self-report in moderate smokers. Abueg FR, Colletti G, Rizzo AA. Addict Behav. 1986; 11(1):55-8.
- Minarowski Ł, Sands D, Minarowska A, Karwowska A, Sulewska A, Gacko M, Chyczewska E. Thiocyanate concentration in saliva of cystic fibrosis patients. Folia Histochem Cytobiol. 2008;46(2):245-6. (https://www.ncbi.nlm.nih.gov/pubmed/18519245 résumé])
- Callas PW, Haugh LD, Flynn BS., Effects of long-term storage on salivary thiocyanate concentration ; Addict Behav. 1989; 14(6):643-8. (résumé)
- Tonacchera M, Pinchera A, Dimida A, Ferrarini E, Agretti P, Vitti P, Santini F, Crump K & Gibbs J. Relative potencies and additivity of perchlorate, thiocyanate, nitrate and iodide on the inhibition of radioactive iodide uptake by the human sodium iodide symporter. Thyroid 2004 14 1012–1019 (résumé).
- Conner GE, Wijkstrom-Frei C, Randell SH, Fernandez VE, Salathe M.,The lactoperoxidase system links anion transport to host defense in cystic fibrosis. FEBS Lett. 2007 Jan 23; 581(2):271-8. Epub 2006 Dec 19.
- Pedemonte N, Caci E, Sondo E, Caputo A, et al. Thiocyanate transport in resting & IL-4-stimulated human bronchial epithelial cells : role of pendrin and anion channels. J Immunol. 2007;178(8):5144-53. http://www.jimmunol.org/cgi/reprint/178/8/5144
- Conner GE, Wijkstrom-Frei C, Randell SH, Fernandez VE, Salathe M. The lactoperoxidase system links anion transport to host defense in cystic fibrosis. FEBS Lett. 2007;581(2):271-8. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1851694/pdf/nihms16911.pdf
- White WE Jr, Pruitt KM, Mansson-Rahemtulla B. Peroxidase-Thiocyanate-Peroxide Antibacterial System Does Not Damage DNA. Antimicrob. Agents Chemother. 1983; 23(2): 267–272. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC186035/pdf/aac00203-0085.pdf
- Thomas EL, Aune TM. Lactoperoxidase, peroxide, thiocyanate antimicrobial system : correlation of sulfhydryl oxidation with antimicrobial action. Infect. Immun. (1978); 20(2):456-63. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC421877/pdf/iai00197-0132.pdf
- Childers M, Eckel G, Himmel A, Caldwell J. A new model of cystic fibrosis pathology : lack of transport of glutathion and its thiocyanate conjugates. Med Hypotheses. 2007;68(1):101-12. (https://www.ncbi.nlm.nih.gov/pubmed/16934416 résumé PubMed)
- Mowska, Patryk, Daniel Lorentzen, Katherine Excoffon, Joseph Zabner, Paul B. McCray, William M. Nauseef, Corinne Dupuy, and Botond Bánfi. A novel host defense system of airways is defective in cystic fibrosis. American Journal of Respiratory and Critical Care Medicine, . Web. 26 novembre 2009. http://ajrccm.atsjournals.org/cgi/reprint/175/2/174.pdf
- Xu Y, Szep S, Lu Z. The antioxidant role of thiocyanate in the pathogenesis of cystic fibrosis and other inflammation related diseases, PNAS. 2009; Early edition, November 16th http://www.pnas.org/content/106/48/20515.full.pdf+html
- Fears BA, Gerkovich MM, O'Connell KA, Cook MR, Evaluation of salivary thiocyanate as an indicator of smoking behavior. Health Psychol. 1987; 6(6):561-8. (résumé)
- O'Connell KA, Gerkovich MM, Fears BA, Cook MR, The influence of salivary stimulation on the validity of thiocyanate as an index of smoking status ; Addict Behav. 1988; 13(4):383-6. (résumé)
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Thiocyanate » (voir la liste des auteurs).