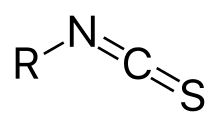
Isothiocyanate
Le groupe isothiocyanate est le groupe −N=C=S, formé par substitution par du soufre de l'atome d'oxygène du groupe isocyanate. De nombreux isothiocyanates naturels d'origine végétale sont produits par conversion enzymatique de métabolites appelés glucosinolates. Par exemple, l'isothiocyanate d'allyle est un composé qu'on trouve dans l'huile de moutarde et est responsable de son âcreté. Un isothiocyanate artificiel, l'isothiocyanate de phényle, est utilisé pour le séquençage des acides aminés dans la dégradation d'Edman.
Les légumes crucifères, comme le bok choy, le brocoli, le chou, le chou-fleur, le chou kale, le chou frisé, le chou romanesco et d'autres, sont de riches sources de glucosinolates, précurseurs des isothiocyanates[1] Bien que certaines recherches fondamentales aient été menées sur la façon dont les isothiocyanates pourraient exercer des effets biologiques in vivo, aucune preuve de leur efficacité sur les maladies humaines ne peut encore être apportée[1].
C'est la base conjuguée de l'acide isothiocyanique.
Synthèse et réactions
La méthode générale de formation des isothiocyanates consiste à faire réagir une amine primaire (par exemple l'aniline) avec du disulfure de carbone dans de l'ammoniac aqueux[1], ce qui provoque la précipitation du sel de dithiocarbamate d'ammonium, qui est ensuite traité au nitrate de plomb pour donner l'isothiocyanate correspondant[2]. Une autre méthode repose sur une décomposition des sels de dithiocarbamate générés dans la première étape ci-dessus[3] par le chlorure de tosyle
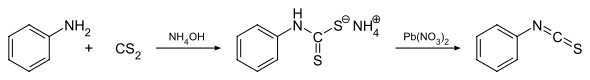 Synthèse d'isothiocyanate de phényle
Synthèse d'isothiocyanate de phényle
Les isothiocyanates sont également synthétisables par les réactions de fragmentation du 1,4,2-oxathiazoles induites thermiquement[4]. Cette méthodologie synthétique a été appliquée à une synthèse d'isothiocyanates sur polymère[5].
Goût et isothiocyanate
Les isothiocyanates sont largement présents dans la nature et présentent un intérêt pour l'industrie alimentaire et la recherche médicale[1]. Les aliments d'origine végétale aux saveurs caractéristiques dues aux isothiocyanates sont nombreux ; le bok choy, le brocoli, le chou, le chou-fleur, le chou frisé, le wasabi, le raifort, la moutarde, le radis, le chou de Bruxelles, le cresson, la papaye, les capucines, les câpres. Ces plantes produisent des isothiocyanates en différentes proportions et s'ils ont des goût différents, ont toutefois de ce fait des similitudes gustatives. La majorité des plantes précédemment citées font partie de la famille des brassicacées, qui se caractérise par une production importante de glucosinolates, et de l'enzyme myrosinase, qui agit sur les glucosinolates pour libérer les isothiocyanates[1].
Quelques isothiocyanates
- La sinigrine est le précurseur de l'isothiocyanate d'allyle.
- La glucotropaéoline est le précurseur de l'isothiocyanate de benzyle.
- La gluconasturtiine est le précurseur de l'isothiocyanate de phénéthyle.
- La glucoraphanine est le précurseur du sulforaphane.
Notes et références
- « Isothiocyanates », Micronutrient Information Center, Linus Pauling Institute, Oregon State University, (consulté le )
- Dains FB; Brewster RQ; Olander CP, Phenyl Isothiocyanate, Org. Synth. 6, coll. « vol. 1 », , 72 p., p. 447
- R Wong et SJ Dolman, « Isothiocyanates from tosyl chloride mediated decomposition of in situ generated dithiocarbamic acid salts », The Journal of Organic Chemistry, vol. 72, no 10, , p. 3969–3971 (PMID 17444687, DOI 10.1021/jo070246n)
- RJ O’Reilly et L Radom, « Ab initio investigation of the fragmentation of 5,5-diamino-substituted 1,4,2-oxathiazoles », Organic Letters, vol. 11, no 6, , p. 1325–1328 (PMID 19245242, DOI 10.1021/ol900109b)
- BA Burkett, JM Kane-Barber, RJ O’Reilly et L Shi, « Polymer-supported thiobenzophenone : a self-indicating traceless 'catch and release' linker for the synthesis of isothiocyanates », Tetrahedron Letters, vol. 48, no 31, , p. 5355–5358 (DOI 10.1016/j.tetlet.2007.06.025)