Perchlorate
L'anion perchlorate ClO4−, ou tétraoxochlorate, est principalement présent dans des sels (perchlorates), notamment dans le perchlorate d'ammonium, de potassium, de magnésium, ou de sodium[2], vendus sous des formes diverses, essentiellement depuis les années 1940.
Le perchlorate d'ammonium NH4ClO4 est très utilisé comme oxydant dans les munitions d'armes à feu, comme propulseur solide de missiles et de roquettes. On le trouve aussi dans les feux d’artifice ou encore pour produire le gaz qui doit gonfler instantanément les coussins gonflables (airbags) en cas d'accident. Ils sont aussi utilisés pour le traitement des cuirs (tannage et finition).
Les perchlorates, en tant que propulsifs (propergol composite à perchlorate d'ammoniums ou de potassium principalement) solides stables et sûrs, sont devenus dans les années 1950 un produit stratégique pour les militaires et la conquête de l'espace. Les boosters de la fusée Ariane utilisent par exemple du perchlorate d'ammonium coulé en Guyane dans les propulseurs vides[3].
| Perchlorate [1] | ||

| ||
 | ||
| Structure et dimensions, et modèle 3XD de l'ion perchlorate | ||
| Identification | ||
|---|---|---|
| Nom UICPA | Perchlorate | |
| No CAS | ||
| No ECHA | 100.152.366 | |
| DrugBank | DB03138 | |
| PubChem | ||
| SMILES | ||
| InChI | ||
| Apparence | poudre blanche | |
| Propriétés chimiques | ||
| Formule | ClO4− | |
| Masse molaire | 99.451 g mol-1 | |
| Propriétés physiques | ||
| T° fusion | Se décompose de façon exothermique avant de fondre vers 321,9 à 476,9 °C | |
| Unités du SI et CNTP, sauf indication contraire. | ||
Naturellement très rares dans les minéraux, les perchlorates commercialisés sont fabriqués à partir de chlorate de soude[4]. Leurs propriétés physiques et chimiques ont été très étudiées, dès le début du XXe siècle[5] par les chimistes pour les producteurs de propulseurs, poudres et explosifs et sont pour cette raison assez bien connues au moins depuis le milieu du XXe siècle[6]. Il a été étudié et utilisé comme médicament, bien avant qu'on ne s'intéresse à d'éventuels effets environnementaux[7] ou aux moyens d'en épurer les eaux qu'il a contaminées[7].
L'ion perchlorate est goitrogène et toxique. Sa toxicité s'exerce notamment via la glande thyroïde[8], en tant que perturbateur endocrinien de l'axe hypothalamo-hypophyso-thyroïdien chez l'animal et chez l'Homme[9] (mais pas à faible dose chez l'adulte en bonne santé selon une étude de Braverman et al. (2004)[10]). On sait depuis les années 1950 que l'inhibition compétitive de l'absorption d'iodures par les cotransporteurs sodium/iode (NIS) dans la thyroïde par le perchlorate semble être le facteur-clé expliquant les séquelles neurologiques et néoplasiques potentielles [11] - [12] - [13] - [2] ; A forte dose, l'inhibition de l'absorption d'iodure conduit à des baisses ultérieures de T4 et T3[14], pouvant elles-mêmes causer des déficits neurologiques irrécupérables.
Leur usage s'est banalisé, au point qu'ils sont devenus un problème environnemental important dans plusieurs grandes régions du monde. Détectés en 1997 dans plusieurs réserves d’eau dans l’ouest des États-Unis[15] ils ont provoqué une crise locale de l’eau potable[16]. Ils font maintenant partie des polluants et contaminants émergents, de plus en plus souvent trouvé dans les eaux, sols, plantes produits alimentaires et dans le lait humain aux États-Unis et dans le monde[17]. Ceci pose des défis importants sur le plan de la remédiation[18] et peut-être phytoremédiation[19].
Les ions perchlorate persistent dans l'environnement (nappes et eaux de surfaces notamment) durant des décennies[20]. Ils peuvent affecter la santé, même à faible dose. Leur effet inhibiteur de la production de certaines hormones thyroïdiennes (qui contribuent à réguler le métabolisme et la croissance) est connu depuis de nombreuses années, en faisant d'ailleurs un des moyens (sous forme de perchlorate de potassium) de traitement de l’hyperthyroïdie, avec quelques cas de thyrotoxicose[21].
Naturels ou synthétiques ?



Ici : "Forêt de Caliche" sur l'île San Miguel (Californie), naturellement riche en ions perchlorate. Au Chili, on s'en sert pour produire des engrais, qui deviennent une source supplémentaire de contamination environnementale par les perchlorates, mais ailleurs dans le monde, les engrais en contiennent très rarement[24].
La mission Phoenix de la Nasa détecte en 2008 des perchlorates sur Mars[25]. Ceci est confirmé en 2015 avec l'annonce par la NASA de la découverte d'eau liquide sur Mars, mais dans la géosphère terrestre, on en avait déjà découvert près de la vallée de la Mort (dans les dépôts de l'Amargosa River valley[23] et dans le désert de l'Atacama (désert le plus aride de la planète), où ils sont des composants mineurs d'évaporites formés en zones hyperarides, et où leur origine a d'ailleurs été longtemps sujette à spéculation[23] - [26] - [27]. Des analyses isotopiques ont ensuite montré que l'oxydation du chlore volatil par l'ozone (O3)[28] - [29] et la formation de HClO4 à partir du chlore atmosphérique en étaient la source (ceci peut poser question, car depuis plus d'un siècle, le chlore a été largement utilisé par l'industrie et les produits désinfectants domestiques, alors que depuis un demi-siècle, les taux d'ozone augmentaient à la suite de l'augmentation des UV induite par le trou de la couche d'ozone). Néanmoins, cette réaction chimique traduisant l’existence d'un « puits de chlore atmosphérique »[30] semble rare et très localisée dans la nature. De plus ce « puits » n'est pas nécessairement stable, car des microbes extrêmophiles ont appris à utiliser le perchlorate comme source d'eau et d'énergie. On a en effet découvert à environ deux à trois mètres sous la surface de l'Atacama, dans une zone abritée du soleil, plus fraiche et relativement anoxique, des colonies et biofilms de micro-organismes survivant dans un milieu hypersalin, milieu qui est en surface très hostile à la vie. Ici, les anhydrites et les perchlorates contenus dans les halites (sel gemme presque pur) permettent la vie d'espèces très résistantes aux sels, qui présentent l'intérêt par leur hygroscopie de retenir un peu d'eau[31].
Des perchlorates sont présents dans certains minéraux ultra-riches en nitrates[32]. De tels minéraux sont accessibles en grande quantité au Chili, où on les exploite pour faire des engrais azotés. Ces derniers sont une source de contamination environnementale via l'eau de ruissellement[33] commercialisés à grande échelle[34].
Ils apparaissent spontanément dans certaines réactions chimiques (et peuvent alors être source d'explosion[35]).
La chimie analytique permet maintenant clairement de différencier entre eux les perchlorates naturels, les perchlorates provenant des engrais chiliens et les perchlorates synthétiques industriels, grâce à leur signature isotopique, unique[36]. Ceci permet aussi de mieux tracer l'origine des perchlorates polluant l'eau.
Informations générales
L'anion perchlorate ClO–
4 a une masse moléculaire de 99,45 u.m.a. et le chlore qu’il contient a un degré d’oxydation de VII. Le n° CAS du ClO–
4 est 14797-73-0.
C’est un oxydant cinétiquement non labile, ce qui en fait un « polluant non organique persistant ». En effet, la réduction de l'atome de chlore central de cette molécule en un ion chlorure simple ne peut se produire dans l'environnement ou dans un organisme que très lentement[2]. La sorption n’atténue pas non plus ses impacts sanitaires ou environnementaux, car il s’adsorbe difficilement dans la plupart des sols et substrats[2]. Enfin, sa réduction chimique naturelle dans l'environnement ne semble pas être significative[2].
Il est très soluble dans l'eau, quel que soit le pH de celle-ci, par exemple selon la réaction :
NH4ClO4(s) NH+
4(aq) + ClO–
4(aq).
L'ion ammonium est probablement généralement biodégradé et le cation trouvé dans l'environnement sera alors le sodium Na+ ou éventuellement l'hydrogène H+, notamment pour des contaminations inférieures à 100 ppb. Mais sur des sites très pollués, des ions perchlorate pourraient conserver une petite fraction de l'ion ammonium[37] ; sur des sites pollués depuis plusieurs décennies, de faibles quantités d'ion ammonium sont trouvées, sans qu'on ait encore (en 2001) mesuré quels cations, et en quelle quantité, jouaient le rôle d'équilibre de charge dans l'eau[2].
État lacunaire de la connaissance
Les perchlorates en tant que produits stratégiques militaires, relèvent en partie de la Défense nationale et de l'industrie de l'armement.
Selon l'EPA, en 2002 (après une seconde revue des données disponibles), l'évaluation environnementale et sanitaire de produit reste empreinte d'incertitudes et de lacunes qui, n'ayant pu être comblées, ont jusqu'à ce jour justifié l'inaction législative des États, face à des enjeux industriels, militaires et économiques considérables.
Au début du XXIe siècle, ces incertitudes portent sur :
- le degré de contamination de l’environnement et du réseau trophique (chaines alimentaires), notamment en milieu aquatique, pour les animaux piscivores et ceux qui s'alimentant au sol et dans la litière (oiseaux, herbivores ou invertébrés mangeant dans la litière)[2] ;
- la validité des bases de données qualitatives, dont concernant la thyroïde (pas de nomenclature commune et cohérente ni système de notation histopathologique pour décrire finement les lésions du système thyroïdien). De même pour les données toxicologiques nécessaire à l'évaluer des impacts sanitaires pour les faibles doses, notamment pour l'embryon, le fœtus ou le jeune individu ;
- le manque de donnée sur la relation « dose-réponse » chez l'Homme (et son fœtus, embryon, enfant, personne âgée) ou en situation de grossesse ou d'allaitement ;
- manque de données sur la capacité des stations d'épuration et des stations de potabilisation à traiter efficacement ce polluant[2] ;
- le manque de compréhension de la sensibilité relative des tests sur animaux de laboratoire quant aux effets neurologiques, et des liens entre effets neurodéveloppementaux et neuropsychologiques observés ou potentiels chez l'Homme ;
- la méconnaissance de la cinétique environnementale et de la bioaccumulation via le plancton ou les algues et macrophytes qui n'avaient pas ou très peu été étudiés par les fabricants ou laboratoires publics[2]. Ex : on ignorait encore en 2002 les risques d'exposition via les installations de combustion ou devenir du perchlorate de eaux d'irrigation après évaporation et évapotranspiration (deux phénomènes pouvant contribuer à des phénomènes de concentration / salinisation / pollution des sols) ;
- la faiblesse des transferts technologiques permettant de protéger les citoyens et l'environnement[2] ;
- le manque d'étude publiées sur les effets à moyens ou long terme pour l'individu (animal ou humain) sain ou malade et pour sa descendance sur plusieurs générations (une seule étude, sur 2 générations, chez le rat avant 2001) [2].
La disponibilité récente de méthodes analytiques permettant des analyses fiables et précises[2] serait une des explications ; Plusieurs programmes portent sur ces points. Il y a peu de données sur les effets sur des individus ayant déjà des problèmes thyroïdiens. En particulier, en 2005, « aucune des études publiées n'a étudié la relation entre l'exposition au perchlorate et des affections présentes chez les groupes particulièrement vulnérables, telles que la progéniture de mères ayabnt eu un faible apport alimentaire d'iodure, ou des bébés de faible poids ou prématurés »[38].Les experts travaillant pour l'EPA ont jugé (en 2002) « extrêmement nécessaire » qu'on développe des études sur les facteurs de risques susceptibles d'exacerber la sensibilité des individus au perchlorate. Pour cela, le travail sur les modèles animaux utilisant des lignées dotées d'une insuffisance thyroïdienne avec déficit d'iodure chronique (« du berceau à la tombe » devrait être exploré[2] ; - Certaines données toxicologique ne proviennent que de test faits avec du perchlorate de sodium, alors que c'est le perchlorate d'ammonium qui a été le plus largement déversé dans l'environnement et qu'on a montré que la nature du contre-ion du perchlorate peut modifier sa toxicité ;
- Les études faites sur le rat ne sont pas entièrement extrapolables à l'Humain ; si les effets sous forme d'inhibition de la fonction thyroïdienne sont similaires, le rat récupère cependant beaucoup plus vite après l'arrêt de l'exposition[39].
Synthèse chimique
Industriellement, cet anion est exclusivement synthétisé selon l’oxydation électrochimique d'ions chlorates.
Toutefois, il existe d’autres méthodes de synthèse (moins économiques) telles que faire la décomposition thermique d’ion chlorate ou en oxydant chimiquement des ions chlorate.
Histoire
Son usage s'est fortement développé à partir du milieu des années 1940 pour les besoins militaires, en raison d'une sécurité d'usage améliorée face aux nitrates, à la nitroglycérine et nitrocellulose antérieurement utilisés, plus instables.
C'est un produit plus stable aux températures et pressions habituelles et face aux chocs et - après certains traitements - à l'humidité.
De plus il était produit aux États-Unis à très bas prix (moins d'un dollar par pound environ) quand toutes les alternatives étaient plus coûteuses ou moins disponibles [40].
Dans les années 1990, les États-Unis (EPA) ont classé le perchlorate comme contaminant nécessitant des recherches et données supplémentaires avant éventuelle prise de décisions réglementaires[2], puis il a été placé sur la liste des contaminants non réglementés mais à surveiller (UCMR) en [41] en attendant une évaluation scientifique plus précise des impacts (dont écoépidémiologique, ce qui nécessite un certain temps). Depuis , les grands distributeurs d'eau doivent dans ce pays faire régulièrement analyser un échantillon jugé représentatif des petits réseaux publics de distribution d'eau potable[2].
Usages
En tant qu'agent oxydant, il peut subir une large variété de réactions d'oxydoréduction intramoléculaire conduisant à la libération brutale ou explosive de produits gazeux, ce qui en fait selon l'EPA[2] ;
- un gaz propulsif idéal pour les boosters de poussée ; Le perchlorate d'ammonium représente 69,7 % des carburants propulseurs solides des moteurs de la navette spatiale, 65 à 75 % des moteurs de phase I de la fusée Minuteman III et 68 % de ceux des missiles Titan[42] ;
- une source de propulsion de plusieurs centaines de types de munitions de combat ou d'entrainement, d'explosifs sous-marin (dont mines, grenades sous-marines, torpille de combat ou d'exercice...)
- une source de propulsion pour les engins d'exploration spatiale (moteur de fusée, boosters)
- une source de gaz de gonflement quasi instantané (airbag)
- une source de propulsion de nombreux matériels pyrotechniques, dont feux d'artifice[40], sous forme d'ammonium (ammonium perchlorate ou AP), mais aussi sous forme de KP (Potassium perchlorate). Des perchlorates d'amonium, de baryum, de césium, de lithium, de potassium, de sodium et de strontium, peuvent ainsi être utilisés dans des dispositifs pyrotechnique, intégrés dans un gel[43], ou dans un polymère de type résine plastique (par exemple pour des dispositifs scintillants[44]) et/ou d'ailleurs comme activateur ou catalyseur de la réaction de polymérisation par exemple d'un polymère acrylique dans un dispositif pyrotechnique[45].
- pour ajuster la force ionique dans les bains électrolytiques[46].
Il est aussi utilisé
- sous forme de perchlorate de tétraéthylammonium comme électrolyte de support pour les études polarographiques de solvants non aqueux ; alors fabriqué à partir de bromure de tétraéthylammonium et de perchlorate de sodium, le perchlorate de tétraéthylammonium étant récupéré comme précipité insoluble dans l'eau[47].
- dans les réacteurs nucléaires[2], sous forme de perchlorate de potassium
- dans les tubes électroniques[2]
- comme additif d'huiles lubrifiantes[2]
- pour le tannage et la finition du cuir[2]
- comme mordant pour les tissus et les colorants[48]
- en galvanoplastie[2]
- pour le traitement du minerai d'aluminium[2]
- pour la fabrication de caoutchouc[2]
- pour la production de peintures[2]
- dans certains émaux[2].
- dans certains engrais chimiques (un rapport de 1998[49] a attiré l'attention sur les engrais comme sources de perchlorate, pondéré par des études montrant que seuls certains engrais (chiliens) posaient problème[50] ;
- dans des batteries militaires (sous forme de perchlorate de magnésium)[51] ;
- pour des usages de laboratoires, en moins grande quantité. Il est utilisé par des laboratoires médicaux (diagnostic de la fonction thyroïdienne) ou de chimie (avec l'acide perchlorique comme acide fort ou pour préparer des échantillons à minéraliser de matière organique, ou avec des ions perchlorates pour équilibrer des forces ioniques)[2] ;
- comme déshydratant (sous forme de perchlorate de magnésium Mg(ClO4)2 anhydre ou légèrement hydraté (anhydrone), pour recueillir et analyser les molécules d'eau formée dans les combustions[2]).
Dans les années 1990, selon les producteurs[52], son usage principal était celui de comburant (92 % des usages) ; lié à sa capacité à produire en peu de temps et à des températures inférieures à 300 °C une grande quantité de gaz, selon la réaction 4 NH4ClO4(s) → 2 Cl2(g) + 3 O2(g) + 2 N2O(g) + 8 H2O(g)[53], alors que 7 % des perchlorates étaient utilisés dans les explosifs, et 1 % consacrés à d'autres usages.
La production aux États-Unis a varié de 1 à 15 millions de lb par an[54] avec dans les années 1980 une production de 20 à 30 millions de livres par an[55].
Impacts environnementaux
Michael Hecht[56], qui a suivi les missions martiennes de la NASA rappelle qu'en haute montagne ou en milieu très sec (dans le sol ou la glace), le perchlorate là où il a été trouvé peut être déshydratant, jouer un rôle d'agglomérant de particules, mais aussi faire baisser la température de fusion de la glace (comme les autres sels)[25].
Le perchlorate anthropique a par contre été largement diffusé dans l'environnement.
Pollution par les perchlorates
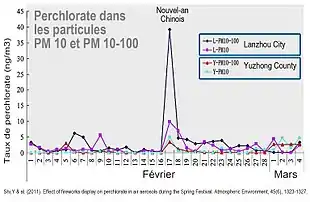
Plus de 90 % des perchlorates commercialisés sont utilisés comme comburants solides de fusées et munitions.
- Quand un explosif détone ou qu'une charge de gaz propulseur est libérée par la combustion d'un propergol, la charge énergétique n'est jamais complètement brûlée, surtout en présence de grandes quantités de matériaux incombustibles. On a ainsi montré que les fusées éclairantes, les propergols de fusées et certains explosifs (émulsion de perchlorate et de nitrate d'ammonium) sont des « sources anthropiques potentiellement importantes de contamination de l'environnement par le perchlorate ». Ainsi, 0,094 mg de perchlorate par gramme de propergol (de fusées) ne brûle pas, ou 0,012 mg de perchlorate par gramme d'explosif (AN explosifs à émulsion). Les formulations de propergols testées (2008-2009) ont généré 0,014 mg de résidus de perchlorate par gramme de propergol brûlé)[58].
- Pour des raisons de sécurité ou d'évolution des matériels ou stratégies de défense, de grandes quantités de munitions, missiles ou boosteurs en contenant doivent être régulièrement mises hors-circuit et changées. D'importants volumes de perchlorate ont ainsi été éliminés, souvent directement dans l'environnement (brûlage, mise en décharge, dépôts immergés de munitions) dès les années 1950, contaminant largement l'environnement et notamment les puits et des sources d'eau potable. L'élimination par brûlage en plein air est de plus en plus difficile en raison des pressions du public et de l'apparition de réglementations protégeant la qualité de l'air. Rien qu'aux États-Unis, en 2001, il y avait £ 55,000,000 de propergol solide en attente de destruction et ce chiffre devait atteindre £ 164 000 000 avant 2005 [59].
Des systèmes de récupération et recyclage du perchlorate d'ammonium ont été mis au point, avec récupération des propergols solides des moteurs-fusées par délavage à l'eau à haute pression, qui génère cependant de gros volumes d'eau à faibles quantités de perchlorate d'ammonium en solution. Sa récupération totale est coûteuse.
Presque tous les lieux très pollués par le perchlorate (eaux de surface ou souterraines) sont proches de sites de production, d'essais, ou de fabrication ou destruction de matériaux aérospatiaux ou parfois d'explosifs ou de feux d'artifice, et plus rarement (pour les cas connus) des laboratoires de chimie ou activités liées aux engrais. - Certaines activités minières ont fait ou font un usage abondant d'explosifs[48].
- Des contaminations ont été détectées près d'usines agrochimiques (dans le Nebraska par exemple[60]).
- pyrotechnie : la fabrication des feux d'artifice est une source majeure de perchlorate dans les zones de production [ex : Centre-sud de la Chine, où dans les années 2010, le fleuve Xiangjiang représentait 58,63 % des apports en perchlorate du fleuve Yangtze (2019), essentiellement à cause de l'industrie des feux d'artifice (et explosifs), en particulier dans la province du Xinjiang, spécialisée dans cette activité). L'air est ensuite contaminé durant et après les feux d'artifice[57].
- Localement (loin de sites industriels ou de retombées militaires) la source la plus plausible a été l'utilisation d'engrais chiliens nitrés naturellement contaminés par des perchlorates[61].
- l'utilisation d'eau de javel comme biocide pour désinfecter de l'eau peut produire du perchlorate (produit de dégradation de l'hypochlorite de sodium) et alors contaminer un approvisionnement en eau[62].
- Aux États-Unis ; C'est là que la situation semble la mieux connue ; L'utilisation pour les analyses - à partir d' - de la chromatographie ionique (dont les limites de détection atteignent 1 ppb) a montré que les sols et eaux de 20 États des États-Unis étaient largement contaminés par le perchlorate. En réponse à une demande d'inventaire des grands utilisateurs et producteurs, 40 États ont signalé des fabricants ou utilisateurs de perchlorate.
Dans le pays, des doses de 4 à 18 μg par litre ont fréquemment été trouvées. Ces taux sont considérés comme étant dans la gamme des « faibles doses », sans action sur la thyroïde chez l'Homme adulte et en bonne santé pour une exposition brève[63] - [64]). Selon, Lawrence et al. « Il est cependant possible que la consommation quotidienne de faibles niveaux de ClO4 dans l'eau potable sur une période de temps prolongée puisse affecter la fonction thyroïdienne, mais aucune preuve d'hypothyroïdie n'a été observée à 10 mg/jour de ClO4 dans une étude de 2 semaines. Il est maintenant intéressant de déterminer une dose sans effet d'inhibition de la thyroïde et sur le RAIU (Radioactive iodine uptake test) pour les perchlorates, en effectuant une étude sur les effets d'une exposition à long terme »[63].
Des contaminations plus élevées sont signalées en Californie, toujours près d'installations ayant fabriqué ou testé des propergol solide pour le ministère américain de la défense ou la NASA (National Aeronautics and Space Administration). Ils ont pollué des captages d'eau jusqu'à plus de 100 µg/L dans plusieurs cas, par exemple au sud et à l'Est de Sacramento ou autour de San Bernardino[65]. L'eau du Lac Mead et du fleuve Colorado a servi pour l'irrigation, la récréation et l'eau potable pour plus de 20 millions[66] d'habitants du Névada, de Californie, d'Arizona et des membres de tribus amérindiennes[67]. Dans certains forages industriels près d'une usine d'Henderson, NV le Perchlorate constituait jusqu'à 0,37 % de l'eau (3,7 millions ppb, le record dans l'eau de nappe étant en 2001 de 8 800 ppb dans un forage californien d'eau potable (fermé). Plusieurs réseaux californiens publics de distribution d'eau en contenaient plus de 100 ppb. C'est une des régions où la santé publique préoccupe l'EPA relativement au Perchlorate[68]. Une bioconcentration semble exister : des taux atteignant 200 µg/L ont été mesurés dans des laitues et du lait[69].
Un risque de contamination avec risque d'empoisonnement par du perchlorate produit lors de processus de nettoyages à sec a aussi été évoqué[70]. - En France, des perchlorates ont été trouvés en 2011 dans l'eau du robinet en Aquitaine, dans le Bordelais où 5 captages d'eau potable ont été pollués (jusqu'à 30 µg/L mesurés) par une usine du groupe Safran (fabrication de propulseurs pour missiles)[71]. Des taux dépassant la norme ont été également relevés dans les nappes d'eau potable en Midi-Pyrénées, dans la Garonne, dans la région Toulousaine (à la suite des rejets d'une usine appartenant au même groupe Safran)[71] puis dans le Nord-Pas-de-Calais (Communauté urbaine de Lille, Arrageois, région lensoise, Douaisis et région d'Hénin-Beaumont et dans quelques villages alimentés par des forages isolés, avec jusqu'à 4 µg/Litre à Douai en 2012), puis en Champagne-Ardenne. Dans plusieurs régions, l'Agence régionale de santé (ARS) a émis des préconisations vis-à-vis des personnes à risque (bébés et femmes enceintes et allaitantes). « Une campagne d’analyse dans 632 réseaux de distribution menée dans la Marne et les Ardennes révèle que 113 communes présentent un taux compris entre 4,1 et 15 µg/l et six communes un taux supérieur à 15 µg/l (...)au total plus d’un millier de communes sont touchées à l’échelle nationale notamment dans le Nord et la région bordelaise »[72]. Les données accumulées de 2011 à 2016 confirment une pollution étendue en Nord–Pas-de-Calais, concomitante avec le zones de combat de la Première Guerre mondiale. Une étude de 2016 a aussi recherché des composés concomitants et conclut à une pollution résultats « de plusieurs sources ponctuelles superposées à un bruit de fond de la nappe »[73]. Le traitement des nitrates par résines échangeuses d'ions (dénitratation) retient environ 40 % des perchlorates, mais le cycle de régénération cyclique de ces résines les relarguent en grande partie ; des chercheurs ont donc étudié le comportement de ces ions perchlorates relargués lors des régénérations. Ils l'ont fait in situ, dans 3 stations d’épuration (via l'analyse des éluats des cycles de régénérations, en différents points des réseaux acheminant ces éluats), avec des comparaisons entre les teneurs en entrée et sortie de ces installations[74]. Les effets de perturbation endocrinienne d’eaux souterraines contaminées ont aussi été étudiés (2016)[75], parallèlement à une évaluation de l'impact d’un traitement d’élimination des perchlorates par résine échange d’ions spécifique (via des biomarqueurs de perturbation thyroïdienne)[75].
Circulation des perchlorates dans les organismes et dans l'environnement
L'Écotoxicologie, la toxicocinétique et la toxicodynamique des perchlorates semblent mal connues.
En 2002, après une revue par les pairs des données existantes[76], les experts travaillant pour l'EPA ont estimé qu'au vu des données disponibles, le risque écologique ne pouvait ni être exclu, ni être précisément caractérisé[2].
Les perchlorates naturels (sauf le perchlorate de potassium, qui nécessite des conditions environnementales particulières pour se dissoudre complètement dans l'eau [77]) sont très solubles dans l’eau. Ils s'adsorbent très peu sur des surfaces minérales ni même sur le charbon activé[78].
L'exposition de la faune, flore et fonge et des microorganismes aux perchlorate est directe (par contact, inhalation, passage percutané (pour les animaux à peau très perméable, etc.) et indirecte via le perchlorate bioaccumulé ou intégré dans la nourriture des organismes.
Écotoxicologie
Dans les années 1980, l'EPA considérait que des indices d'écotoxicité existaient pour diverses plantes[79] et plusieurs animaux (aquatiques ou terrestres[2]), mais à mieux étudier ;
En 2012, l'écotoxicologie des perchlorates a progressé, mais elle reste très lacunaire, notamment concernant les synergies avec d'autres perturbateurs et les effets d'expositions chroniques durant l'embryogenèse, la croissance et le développement.
- Perturbation endocrinienne : L'effet perturbateur des perchlorates est le mieux connu. Il semble initié par l'inhibition de l'absorption des iodures par la thyroïde ; On a d'abord expérimentalement démontré des effets négatifs des perchlorates sur le développement, la reproduction (reprotoxicité)[2].
Chez les premières espèces testées, la sensibilité au perchlorate semblait approximativement la même chez toutes les espèces, mais les animaux s'y montrent cependant plus ou moins sensibles selon l'espèce (avec probablement aussi des différences selon le stade de développement) ; Ainsi seule la thyroïde semble affectée chez le lapin, alors que le développement des rats est aussi inhibé (à partir d'une exposition à 30 mg/kg/jour de perchlorate, Cf. LOAEL[80])[2] et que les effets sont plus globaux (changement de sexe) chez le poisson (Peut être en raison du caractère très soluble des perchlorates, certains organismes aquatiques y semblent plus sensibles) ;- Effet androgénique : À doses 1000 fois supérieures au seuil EPA de 2006 pour l'eau potable (24.5 ppb), mais présentes dans la nature, près d'usines rejetant du perchlorate[81], il est manifeste chez l'épinoche à trois épines (Gasterosteus aculeatus) exposée de manière chronique ; Les épinoche exposée développent des altérations d'organe, une moindre croissance, un développement et un comportement sexuel anormaux (avec « inhibition du comportement de cour[82] » et coloration du mâle atténuée au moment de la reproduction[82]). La femelle développe un « hermaphroditisme fonctionnel », Cet hermaphrodisme vrai est observé chez des « femelles génétiques » (il ne s'agit pas de mâles féminisés[82]), une pigmentation affadie (assez pour rendre les organes internes visibles) et une moindre survie ;
Il semble aussi pouvoir être hypermasculinisant pour le mâle[81]. - Perturbation de la dynamique de populations piscicoles ? Les femelles d'épinoches masculinisées présentent des "gonades intersexuées" (dits « ovotestes ») contenant à la fois des ovocytes et des cellules testiculaires produisant des spermatozoïdes mobiles et fécondants. La fécondation (tests in vitro) est effective à la fois dans le cas de l'autofertilisation et d'une fertilisation croisée, mais le sperme proviennent de femelles génétiques produit des embryons qui meurent durant la phase blastula ou en début d'organogenèse. Inversement, les spermatozoïdes provenant de vrais (mâles génétiques) produisent des alevins viables quand ils fécondent des œufs provenant de femelles génétiques (normale ou exposée au perchlorate). Comme le perchlorate est dans l'eau un polluant persistant, qui peut même "remonter à la source " via sa diffusion dans les nappes, il peut a priori affecter a la fitness des poissons ou d'autres espèces aquatiques qui y seraient sensibles.
- Effet androgénique : À doses 1000 fois supérieures au seuil EPA de 2006 pour l'eau potable (24.5 ppb), mais présentes dans la nature, près d'usines rejetant du perchlorate[81], il est manifeste chez l'épinoche à trois épines (Gasterosteus aculeatus) exposée de manière chronique ; Les épinoche exposée développent des altérations d'organe, une moindre croissance, un développement et un comportement sexuel anormaux (avec « inhibition du comportement de cour[82] » et coloration du mâle atténuée au moment de la reproduction[82]). La femelle développe un « hermaphroditisme fonctionnel », Cet hermaphrodisme vrai est observé chez des « femelles génétiques » (il ne s'agit pas de mâles féminisés[82]), une pigmentation affadie (assez pour rendre les organes internes visibles) et une moindre survie ;
- soupçons de génotoxicité (chez le rat) ; les premiers tests sur l'ADN n'ont pas révélé de génotoxicité (avec la batterie de tests utilisée[2]), mais des tumeurs observées à la seconde génération chez le rat exposé à long terme à des doses élevées, laisse supposer qu'il pourrait exister un mode indirect d'action sur la thyroïde[2]). Pour la thyroïde, le rat est considéré comme un modèle surpondérant plutôt le risque par rapport à l'Homme, en raison de différences de structure thyroïdienne et de demi-vie des hormones produites[2]. Des études plus approfondies sont donc nécessaires.
- Pas d'effets intergénérationnels directs connus (chez le modèle épinoche) : En 2010, très peu d'études avaient porté sur les effets sur plusieurs générations[83]. Chez l'épinoche exposée, la progéniture issue de parents contaminés ne présente plus ces problèmes si elle est élevée dans une eau sans perchlorate, ce qui laisse penser que - en aquarium - il n'y a pas d'effet intergénérationnel. Ces résultats ne peuvent cependant être extrapolés à d'autres groupes (plantes ou mammifères notamment).
- Effets cancérogènes et immunotoxiques ? Selon l'EPA, l'inhibition de la capture de l'iode par la thyroïde pourrait aussi avoir un rôle cancérigène[2] et immunotoxique (dont pour l'Immunité cellulaire peut-être) via la perturbation de l' « axe hormonal hypothalamo-hypophyso-thyroïdien »[2].
Degré de contamination des espèces non humaines
Il est peu connu. La présence de perchlorate étant généralisée dans des régions entières, on suspecte dans ces zones une contamination des espèces qui y sont sensibles. Les premières études de contamination d'espèces autres que l'homme ont été faites aux États-Unis après 1997, fondées sur des tests in vitro, uniquement faits sur des organismes modèles et ne portant pas sur la quantité de perchlorate présente ou active selon les tissus ou organes. Ces tests étaient jugés représentatifs des biointégrateurs de trois compartiments importants de l'environnement ; le sol, les sédiments et l'eau. Il s'agissait aussi, pour quelques espèces, d'évaluer la « toxicité brute » des perchlorates via la relation « dose-réponse » .
Une évaluation de ces tests a conclu à la nécessité d'une batterie de tests plus ciblés ou adaptés à l'évaluation des risques (ex: la laitue a remplacé la lentille d'eau, car elle est très cultivée le long du fleuve Colorado qui est l'un des plus contaminés).
Parmi les espèces testées figurent
- la daphnie (Ceriodaphnia magna), souvent utilisée en tant que modèle d'invertébré aquatique[2] ;
- la laitue (Lactuca sativa), choisie comme représentante des plantes vasculaires[2] ;
- des coquillages : en Mer de Chine méridionale, 178 coquillages de huit espèces, venant tous d'eaux aquacoles offshore ont été analysés en 2021: 99,4 % d'entre eux contenaient du perchlorate (jusqu'à 71,5 μg kg-1, avec une valeur médiane de 4,33 μg kg-1.)[84]. À eux seuls ces coquillages ne font pas dépasser l'apport quotidien estimé (DJE) ni les seuils risque pour la santé (HQ) ont été utilisés pour évaluer la dose d'exposition humaine et les risques pour la santé des consommateurs de coquillages, mais ces doses font évoquer une pollution généralisée des eaux littorales[84] ;
- des poissons : le Vairon à grosse tête (Pimephales promelas) comme représentant des vertébrés aquatiques[2] suivi du Danio rerio (effets marqués sur l'axe hypothalamo-hypophyso-thyroïdien dès 250 mg/L, chez des poissons exposés à des doses de 0 ; 62,5 ; 125 ; 250 ; 500 et 5 000 mg/L[85]) ;
Pour des raisons, non comprises, les poissons des lacs et cours d'eau proches d'un site d'armement américain[86], ont présenté (2006) des contaminations très variables selon l'espèce et l'individu. Mais quand un poisson est contaminé, le taux tissulaire de perchlorate dépasse toujours celui de l'eau[87] - deux espèces de tortues (Trachemys scripta et Chelydra serpentina) respectivement exposées à 200 et 177 mg/g de perchlorate de sodium, pour tester les effets sur l'œuf et l'embryon [88]. Les jeunes tortues issues d'œufs exposés ont été moins nombreuses à survivre (avec réduction du métabolisme, augmentation de la taille du foie et la thyroïde, perturbations hormonales réduites), avec des effets plus sévères chez T scripta[88].
- le ver de terre (Eisenia foetida) représentant les invertébrés du sol. Aux doses environnementales « habituelles », le perchlorate ne tue pas les vers de terre, mais il affecte leur reproduction (à partir de 100 picogrammes de perchlorate par gramme de sol[89]) ;
- le campagnol des champs (Microtus pennsylvanicus), représentant les petits mammifères omnivores/herbivores[2].
- quelques ligneux (saule, peuplier de l'Est, eucalyptus) ont été testés pour leurs éventuelles capacités d'absorption, dégradation et phytoremédiation (en systèmes expérimentaux, via des boutures enracinées exposées au perchlorate).
- Des tests de tératogenèse ont utilisé l'embryon de Grenouille Xénope (Test FETAX, dont la pertinence est discutée concernant la représentativité pour les animaux à sang chaud [90]).
Des études complémentaires in situ (6 sites) ou en laboratoire mais sur des pas de temps plus longs, ont porté depuis 1999 sur l'évaluation des effets chez des animaux aquatiques, une plante aquatique, une plante terrestre et un invertébré du sol[2].
- L'EPA en 2002 retenait pour les organismes aquatiques un « seuil de toxicité aiguë » de 5 mg/L pour l'exposition de court terme (en deçà de ce seuil 95 % des organismes aquatiques n'étaient pas affectés) et un seuil de 0,6 mg/L pour l'exposition chronique (calcul dérivé du seuil de 5 mg/L)[2]. Les données disponibles en 2002 montraient que le perchlorate « s'accumule dans les tissus des poissons exposés, des amphibiens et invertébrés », mais sans qu'on sache si des seuils critiques étaient dépassés[2].
- Les plantes terrestres peuvent bioconcentrer le perchlorate dans leurs parties aériennes (feuilles surtout), mais en 2002 les mécanismes et facteurs en jeu n'étaient pas encore compris. Des effets significatifs d’inhibition de croissance (sur le dernier quartile) ont été constatés au-delà de 78 mg/kg (293 mg/L) pour des plantes en terre et au-delà de 41 mg/kg (160 mg/L) pour des plantes poussant dans du sable. L’EPA a retenu 4 mg/kg de sol comme seuil de dépistage (rem : un engrais nitraté chilien contient un taux significatif de perchlorate naturel, ) ;
- Pour compenser le faible nombre de données toxicologiques pour les invertébrés du sol, une estimation prudente d'un seuil d’effets sur la communauté du sol a été posée à 1 mg/kg (2,8 mg/L étant l’indice équivalent de référence pour la phase aqueuse du sol
- Chez les mammifères terrestres, le perchlorate franchit facilement la barrière intestinale. La voie orale est considérée comme la première et principale voie d'exposition.
L'exposition par inhalation semble être négligeable en raison d'une pression de vapeur faible à température ambiante, et en raison de sa taille moléculaire et parce que faiblement liposoluble, il ne traverse pas facilement la barrière de la peau. - quelques études montrent de fortes variations de susceptibilité aux perchlorates selon les espèces, et ou des effets différents[91] (par exemple, l'Homme et le rat présentent une relation dose-réponse similaire pour l'inhibition de captation de l'iodure par la thyroïde, mais avec des réponses hormonales (T3, T4 et TSH) différentes. L'homéostasie thyroïdienne du rat semble plus sensible aux perchlorates que celle de la souris ou du lapin). Les tests sur les rats, souris et lapins pourraient ne pas convenir pour l'évaluation d'une partie des risques pour l'homme[91].
Persistance environnementale et intra-organisme
- Cinétique environnementale du perchlorate : Elle est très liée à sa faible dégradabilité et à sa haute solubilité dans l'eau.
Les manières dont il peut être bioaccumulés ou éventuellement biodégradés sont encore mal comprises, mais des progrès sont peu à peu faits dans les aspects biochimiques, microbiologiques (rôle des bactéries réductrices notamment[92] - [93] - [94]) et génétiques de sa cinétique dans les écosystèmes ou les organismes, laissant espérer des solutions de bioremédiation pour les sites, sols et eaux pollués par ce produit, en complément d'autres solutions basées par exemple sur des résines échangeuses d'ions hautement sélectives[40]. Des membranes de filtration utilisant des catalyseurs à base de titane sont également étudiées pour dépolluer des eaux claires[40]. - Persistance dans les organismes : Les ions perchlorates ne se dégradent pas spontanément dans l'organisme : l'énergie d'activation nécessaire à la réduction de perchlorate est si élevé qu'il ne se comporte pas comme oxydant dans les conditions physiologiques animales et humaines (c'est-à-dire en solution diluée, à des températures inférieures à 50 °C et en présence d'un pH neutre à légèrement acide ou plus acide dans l'estomac), ce que confirment les études disponibles sur l'absorption, la distribution, le métabolisme, et l'élimination des perchlorates ingérés qui sont excrétés pratiquement inchangés dans les urines[2] (ces études ont porté sur différentes espèces et visent notamment à produire des modèles extrapolables à l'Homme et à d'autres espèces).
Impacts sur la santé
Toxicologie, toxicocinétique chez l'Homme
Avec les nitrates et thiocyanates les perchlorates font partie des perturbateurs endocriniens de la thyroïde, en tant que molécules « goitrogènes »[95]. D'autres effets sur la santé humaine ou animale ont été détectés ou sont en discussion. La toxicologie (et l'écotoxicologie) des perchlorates est en cours de révision depuis aux États-Unis, sous l'égide de l'EPA, avec le Centre national des États-Unis pour l'évaluation environnementale (NCEA) qui a publié en 1999 un premier projet de révision[96] en 1998 et des recommandations (faites en 1999) pour des études et analyses complémentaires avec examen scientifique par les pairs. Le volet le plus important de ces évaluations portent sur l'eau potable[97].
Perturbation endocrinienne
Il y a un consensus sur le fait que le perchlorate est toxique pour la thyroïde humaine, récemment confirmés par les réévaluations et études de l'EPA ; il inhibe des hormones thyroïdiennes dont la TSH, de la thyroxine dite T4 (qui contrôle le développement neurologique et du cerveau) et la triiodothyronine T3 ; sans métabolisation du perchlorate dans la thyroïde ni dans les tissus périphériques.
Les perchlorates freinent ou bloquent la capacité de cette glande à capter l'iode qui lui est nécessaire, en interagissant avec les thiocyanates et les nitrates qui ont aussi cette propriété (bien que moindrement et moins durablement[95]), molécules avec lesquelles les nitrates peuvent développer des effets cumulatifs ou synergiques[95])
Seuils de toxicité
Au début du XXIe siècle, il n'y a cependant pas encore de consensus sur les seuils à ne pas dépasser pour qualifier une exposition sans danger[98].
La dose (provisoire) "no-observed-adverse-effect-level" ou NOAEL était aux États-Unis en 2001 de 0,14 mg/kg/jour.
Le nettoyage des nappes phréatiques est aux États-Unis recommandé à partir de 4 à 18 ppb[2]. Un examen par des pairs indépendants [99] a été commandé par l'EPA en pour évaluer une proposition de seuil de référence RfD ("Reference dose") ou de dose sans effet toxique observable (NOAEL) ;
Le manque de données toxicologique (manque d'études sur le rapport effet/dose, d'études de plus de 90 jours sur l'animal, d'études sur l'embryon ou sur les effets du lait contaminé, etc.) interdit d'analyser de manière crédible la totalité des risques pour l'Homme. Le contenu de la littérature publiée ne permet pas d'exclure des effets des perchlorates sur d'autres organes que la thyroïde ni même de garantir sans équivoque que l'effet sur la thyroïde est l'effet le plus critique. Le développement physique et neurologique pourrait être indirectement affectée in utero par une hypothyroïdie durant la grossesse, éventuellement gravement, ce qui n'avait pas encore été adéquatement étudié. Les pairs ont - en - émis des recommandations sur la manière de combler ces lacunes[2].
L'EPA continue à combler les lacunes de connaissance (dont par des études sur la souris, le rat, le lapin exposés à tous les âges, y compris à l'état fœtal et embryonnaire ou via l'allaitement), avec une étude ayant porté sur deux générations, portant sur la reprotoxicité du perchlorate chez le lapin (et sa toxicité sur la progéniture)[2]. Les tests de toxicité ont été accélérés en Amérique du Nord par un partenariat direct ministère américain de la Défense et l'EPA, suivi par les membres d'un comité directeur inter-Agence sur les perchlorate (ou « IPSC » [100]) comprenant des représentants gouvernementaux de l'Institut national de Environmental Health Sciences (NIEHS); des états et gouvernements locaux des États-Unis. L'IPSC doit faciliter et coordonner, sur la base des données physicochimiques disponibles (en partie aux mains de l’industrie de la défense), une évaluation précise des aspects technologiques (cadastres d’émission, enquêtes, évaluation sanitaire, écotoxicologique, traitabilité des perchlorates, manipulation des flux de déchets, détection analytique…)[2].
Les perchlorates ont initialement été suspectés d'être cancérigènes par voie orale et/ou inhalation ; hypothèse qui semble avoir été un temps abandonnée puis (à la suite des études sur l'animal) reconsidérée, au moins potentiellement pour l'Homme, pour des tumeurs de la thyroïde (avec dans ce cas altération possibles du neurodéveloppement[2]). En effet, des tumeurs thyroïdiennes sont apparues chez des rats exposés (à long terme) à de « forte dose » dans les premières études, puis une étude ayant porté sur deux générations de reproduction, a diagnostiqué des tumeurs de la thyroïde non seulement dans la première génération (F1) des adultes, mais aussi dans la seconde génération parentale [p. 2] (après 19 semaines)[2].
Les perchlorates sans être directement neurotoxiques, pourraient - in utero au moins - affecter le développement cérébral en tant que perturbateurs hormonaux. Une autre étude, basée sur la mesure du poids du cerveau de jeunes chiots exposés à diverses doses de perchlorate, a fait proposer une « Dose Minimale avec Effet Nocif Observé » (ou LOAEL Lowest Observed Adverse Effect Level) tenant compte des séquelles à la fois neurologiques et néoplasiques : 0,01 [mg]/kg-jour[2] ; au-delà de cette dose, une étude neurologique a mis en évidence des effets sur la morphométrie du cerveau de jeunes chiots (sacrifiés à divers stades de développement). Ces anomalies correspondaient à une moindre production d'hormones TSH T4 et à des changements histopathologiques de la thyroïde de chez ces mêmes chiots. Une évaluation postérieure de cette étude par le comité CNRC (2005) a conclu[101] - [102] que les données de cette étude étaient encore insuffisantes pour affirmer ou infirmer un lien de causalité entre l'exposition maternelle des chiots et les anomalies neurodéveloppementales observées ; de même pour une étude d'exposition subchronique (à 90 jours) qui avait aussi montré des effets sur l'immunotoxicité (hypersensibilité au contact cutané)[2]. La plausibilité de ces risques est reconnue, mais des évaluations plus précises ou statistiquement plus robustes sont souhaitées par divers experts.
Depuis les années 1980, les perchlorates (comme d'autres anion tels que pertechnetate et thiocyanate[103]) sont reconnus comme étant des perturbateurs endocriniens et plus précisément « des inhibiteurs compétitifs au processus de transport actif (pompe à iode) des iodures du sang jusqu’au follicule de la thyroïde »[104] Or, ces iodures sont nécessaires pour que la glande thyroïde produise des hormones nécessaires à la régulation du métabolisme et de la croissance. Ce même effet inhibiteur a d'ailleurs utilisé dans les décennies 1950 et 1960 pour traiter par du perchlorate l’hyperthyroïdie (maladie due à un excès de production d'hormones thyroïdiennes). Cet usage a conduit au décès de plusieurs patients, à la suite d'une thyrotoxicose fatale (anémie aplasique mortelle) induites par des doses très élevées (de 600 à 1 600 mg/j) de perchlorate[21]) qui ont fait qu'on a remplacé ce médicament par d'autres, bien que 2 études plus récentes n'aient pas détecté d'effets délétères « sérieux » dans le cas du traitement de la maladie de Graves-Basedow ou de traitement d'hypothyroidisme, à des doses inférieures à 1 000 mg/j durant jusqu'à un an[105] - [106].
Au-delà d'un certain seuil, le perchlorate ingérée provoque une hypothyroïdie (maladie correspondant à un déficit de production d’hormones thyroïdiennes), avec de nombreuses conséquences néfastes « Les fluctuations de courte durée des hormones thyroïdiennes ne sont pas un problème chez l'adulte en bonne santé »[107], mais les perturbations à long terme peuvent occasionner divers symptômes allant de la dépression aux pertes de mémoire et aux douleurs musculaires ; « Ces effets sont particulièrement préoccupants pour les personnes qui souffrent déjà d'hypothyroïdie ainsi que pour les femmes enceintes et les enfants »[107].
Chez l'adulte en bonne santé[104] une inhibition de la capacité de la thyroïde à capter l'iode du sang est observé à très faible exposition : dès 0,007 milligramme/jour/kg de poids (Pour tenir compte des individus vulnérables et de diverses incertitudes, on divise cette concentration par un facteur 10 pour établir la NOEL (la plus grande dose pour laquelle aucun effet n’est observé) ce qui équivaut à 0,000 7 mg/kg/j. C'est un facteur 10 qui est utilisé lorsque l'expérimentation porte sur l'espèce concernée, comme c’est le cas ici (typiquement les humains) et un facteur 100 si l’expérimentation a été faite sur une autre espèce (souvent les rats de laboratoire).
En utilisant le poids moyen d'un individu (70 kg) et la consommation d’eau moyenne (2 L/jour), l’agence de protection de l'environnement des États-Unis nommée EPA (« Environmental Protection Agency ») a déterminé que le DWEL (« Drinking Water Equivalent Level » ou le niveau équivalent en eau bue) du perchlorate correspondant à 0,000 7 mg/kg/j était de 24,5 ppb[108]. 14 adultes en bonne santé ont été exposés 6 mois à du perchlorate : jusqu'à 3 mg/j absorbés, les auteurs (2006) n'ont pas observé d'effets thyroïdiens (pas d'inhibition de la capture d'iode ni de modification des taux sanguins d'hormones TSH et Tg)[109].
De 4 à 16 µg/L dans l'eau du robinet, les populations ne semblent pas présenter de problèmes thyroïdiens particuliers, y compris les enfants. Une étude a comparé durant près d'un an ( à ) les taux sanguins de TSH de nouveau-nés (d'un pois de 2,5 à 4,5 kg à la naissance), ainsi que leur courbe de poids durant le premier mois de leur vie et les taux de mortalité, dans 2 ville : Las Vegas où l'on trouve jusqu'à 15 µg/L de perchlorate dans l'eau du robinet, et Reno où aucun perchlorate n'est détecté dans l'eau du robinet. Les auteurs n'ont pas notés d'impacts significatifs pour les bébés de Las Vegas (exposition environnementales de perchlorate via l'eau du robinet inférieure ou égale à 15 µg/L[110]. Dans la région d'Atacama, l'eau potable contient jusqu'à 100-120 µg/l de perchlorate. Une étude a porté sur les nouveau-nés et enfants d'âge scolaire et femmes enceintes de trois villes différemment touchées (Taltal où l'eau du robinet contient en moyenne 114 µg/L de perchlorate), Chañaral avec 6 µg/L, et Antofagasta avec 0,5 µg/L). On n'a pas dans ce cas détecté de différence entre les villes et le poids à la naissance, la longueur et circonférence de la tête étaient comparables entre les trois villes et aux mesures faites ailleurs en Amérique[111]., et dans une zone d'Israël où on trouve jusqu'à 300 µg/L de perchlorate dans l'eau du robinet, le taux sérique de thyroxine (T4) était normal chez les nouveau-nés[112]. Cependant, une autre étude a montré que les bébés nés dans deux villes dont l'une a une eau du robinet provenant du fleuve Colorado et du lac Mead, contaminée par du perchlorate d'ammonium (20.000.000 d'habitants concernés) présentent des différences concernant les anomalies hormonales (après ajustement pour l'âge, l'ethnie et divers facteurs connus ou suspectés d'influer sur les niveaux de TSH des nouveau-né) ; dans ce cas les auteurs ont conclu à une association statistiquement significative entre l'exposition au perchlorate et les taux néonataux de TSH [66], qui incite à mieux rechercher ou infirmer d'éventuels liens de cause à effet[66]. SH Lamm a ensuite (en 2003) estimé que les différences observées entre les deux villes sont dues à un biais induit par le fait que les deux villes choisies pour l'expérience n'ont pas la même altitude ni la même composition ethnique[113].
En 2017, une étude faite dans une vaste cohorte de femmes du comté de San Diego celles exposées perchlorate environnemental présentaient une augmentation du risque de naissance prématurée (≥ 2 500 g), uniquement chez leurs garçons, et une augmentation du poids à la naissance des garçons était également constatée, surtout chez le prématurés. Cette association est plus marquée chez les mères américaines que mexicaines. La diminution de l'hormone thyroïdienne maternelle pendant la grossesse pourrait être en cause[114].
Une partie significative des européens et des français (enfants y compris) manquent d'iode (ou l'absorbent mal), faisant que les doses détectées dans l'eau potable de certaines régions (et dans quelques préparations pour nourrissons) peuvent même au niveau de la dose journalière tolérable (DJT ; 0,7 μg kg-1 bw jour-1) poser problème : l'exposition des enfants de moins de 6 mois a été recalculée en 2016, montrant que la DJA pouvait en outre être dépassée chez certains enfants[115]. Les auteurs de cette étude invitent donc à « clarifier les sources de perchlorate, pour diminuer l'exposition de la population »[115].
Cancérogénicité
Peu d'études ont porté sur ce sujet.
- Celles qui ont exposé des rongeurs à des doses élevées de perchlorate ont observé des augmentations « statistiquement significatives » de nodules des cellules folliculaires (Fernandez Rodriguez et al. 1991), d'adénomes (Kessler et Kruskemper 1966), et de carcinomes (Pajer et Kalisnik 1991).
- Le perchlorate pourrait être un cofacteur de cancer selon d'autres études qui ont démontré que le perchlorate peut « promouvoir les tumeurs de la thyroïde initiées par des moyens chimiques ou par irradiation »[116]).
- Du perchlorate de potassium administré à 1 % dans de l'eau potable à des rats Wistar femelles durant 1 à 12 mois produit à partir du 6e mois de multiples nodules des cellules folliculaires (souvent bilatéraux, diffus et de morphologie complexe) dans la glande thyroïde[117]
- Du perchlorate de potassium administré à des rats mâles Wistar dans l'eau potable à 0 ou 1 % (~ 1 339 mg/kg/j) a induit « chez 4 des 11 rats ainsi traités des tumeurs bénignes de la glande thyroïde »[118].
- Du perchlorate de sodium a été administré à 0 ou 1,2 % (~ 2 147 mg/kg/j) dans l'eau potable à des souris Balb/c femelles durant au maximum 46 semaines. Il y avait 3 groupes de contrôles et 3 groupes de souris traitées, avec certaines souris sont le corps entier a également irradiée à des niveaux variables. Des carcinomes folliculaires thyroïdiens ont été observés chez cinq des six souris non irradiées et exposées au perchlorate, et chez toutes les 14 souris irradiées traitées au perchlorate[119].
- Une étude (1999) sur deux générations laisse penser que des tumeurs peuvent être induites dans la descendance[120].
- Diverses expériences ont conclu que ces cancers ne sont pas induits par des mutations de l'ADN (L'ion perchlorate ne s'est pas montré génotoxique, même en cas d'exposition à de fortes doses. L'origine de ces cancers semble plutôt due à son caractère de perturbateur endocrinien)[121].
Une évaluation EPA/IRIS a conclu que « le perchlorate n'est pas susceptible d'être cancérogène pour l'homme, au moins aux doses inférieures à celles qui sont nécessaires pour modifier l'homéostasie des hormones thyroïdiennes »[122].
Enjeu de santé environnementale
Pour ce qui est de la santé environnementale, le perchlorate préoccupe autant les acteurs de la santé (Agences de santé publique notamment) que de l'eau (Agences de l'eau, fournisseurs d'eau potable), car toxique et peu dégradable, ce produit est si soluble, qu'il tend à se disperser très rapidement dans les eaux superficielles et souterraines[123]. De plus, il résiste aux « procédés classiques de traitement de l'eau »[123].
Aux États-Unis, les puits proches de zones à risque ont été théoriquement fermés, mais des contaminations restent possibles localement. En 1997-1998, une évaluation[123] à grande échelle de la prévalence de perchlorate a été faite par l' American Water Works Association pour les nappes ou réservoirs d'eau potable du système de l'American Water[124], compagnie qui vend de l'eau à 16,2 millions de personnes dans 32 États américains et en Ontario, au Canada. Cette enquête a concerné 40 réservoirs en eau de surface situés dans 11 états, et 367 puits d'eau souterraine dans 17 états[123]. Dans aucun cas, le perchlorate n'a été présent au-dessus des seuils de détection dans les eaux de surface, mais il a été confirmée dans neuf (~ 2,5 %) des puits, tous situés en Californie ou au Nouveau-Mexique, avec des taux variant dans ces cas de moins de 4 à environ 7 mg/L (la valeur guide pour la santé, proposée par le du California Department of Health Services était alors de 18 ug/L. Dans ces cas, les responsables étaient des sites militaires ou d'autres sources importantes de perchlorate[123].
Enjeux environnementaux
Discrètement, mais en quelques décennies le perchlorate est devenu l'un des polluants les plus communs et un enjeu environnemental nouveau, pour la qualité de l'eau notamment[125], avec peut-être aussi des enjeux écotoxicologiques encore mal cernés. Il est identifié par l'EPA comme un des enjeux importants de santé publique (notamment en Californie où la contamination de l'eau semble la plus élevée et critique, et où les nappes souterraines et superficielles sont de plus en plus surexploitées), mais les données quantitatives sur les tonnages produits ou relargués dans l'environnement de ce produit dont le premier usage a été militaire (Sidewinder, AMRAAM, TOmahawk et autres missiles stratégiques tels que Minutemen et tous les booster de missiles et propulsifs de roquettes) et de "conquête spatiale" (propulsif solide) ont manqué. C'est en outre un polluant diffus dont les sources précises et facteurs de diffusion sont souvent difficiles à identifier. Souvent faute de pollueur bien identifié, les responsabilités sont difficiles à établir, et les processus basés sur le principe pollueur-payeur difficiles à mettre en œuvre. De plus les méthodes d'analyse et quantification de ce polluant dans l'eau n'ont pas été consensuelles et tendaient à produire des faux positifs quand il n'y avait pas de vérification, ce qui n'a pas encouragé à une lutte cohérente et coordonnée contre ce polluant émergent[40].
Deux enjeux importants pour le XXIe siècle sont de trouver des méthodes efficaces de dépollution et de trouver des alternatives moins toxiques à ce produit[40].
L’anion perchlorate est très soluble dans l’eau. Il se propage donc facilement et rapidement dans l’environnement, en surface ou dans les eaux souterraines qui deviennent des sources de contamination.
De plus, les perchlorates peuvent s'accumuler dans les végétaux[126], qui deviennent alors une autre source de contamination.
Les plantes aquatiques et des berge des eaux de surfaces sont celles qui ont les plus grandes probabilités d’être exposées aux perchlorates. On a cependant montré aux États-Unis que les perchlorates peuvent aussi s'accumuler dans les plantes terrestres (dont légumes).
Une étude récente effectuée sur des concombres, des laitues et des plants de soja tend à montrer que ces légumes peuvent accumuler respectivement jusqu’à 41, 780 et 18 ppm de perchlorate à partir d’un sol sablonneux et en présence d’engrais[127].
La forte capacité d'accumulation de perchlorates dans les feuilles de laitue questionne l'évaluation du niveau d’exposition des consommateurs. En effet, environ 90 % de la laitue consommée aux États-Unis durant l’hiver provient de la zone avoisinant le bas de la rivière du Colorado qui est contaminé par des perchlorates à des taux de 1,5 à 8 ppb et dont l’eau est utilisée pour l’irrigation des laitues[128].
À ce perchlorate biodisponible pour les laitues s’ajoute parfois celui apporté par les engrais chiliens nitratés[129] utilisés pour les faire croître. Les dépôts chiliens de minéraux « paléochimiques », salpêtres naturels riches en nitrate de sodium (NaNO3) sont connus depuis longtemps comme source naturelle de perchlorate. Or, ils sont utilisés par l'industrie (Sociedad QuõÂmica y Minera S.A. ou SQM et sa filiale Chilean Nitrate Corporation ou CNC[130] créée en 1999), produits dans leurs usines de MarõÂa Elena et de Pedro de Valdivia dans le nord du Chili), et vendus (sous le nom de « Bulldog Soda » en quantité significative aux États-Unis, à raison - à titre d'exemple de 75,000 tonnes en 1999[131] - [132]) et en quantités relativement faibles ailleurs dans le monde, d’où une contamination diffuse supplémentaire (Les autres engrais de ce type ne proviennent d'ailleurs que du Chili, ne contiennent a priori généralement pas de perchlorates en quantité significative[128]).
Les résultats de l’étude sur les différents types de laitue[127] montraient que pour une consommation standard de 55 g de laitue par jour, ceci correspondait à moins de 4 % de la dose quotidienne de perchlorate maximale recommandée par l’EPA et le système IRIS[133] de 0,000 7 mg·kg-1[128]. Toutefois, si on considère la nourriture consommée aux États-Unis dans son ensemble, une étude récente a montré que plus de la moitié de la dose maximale en perchlorate recommandée par l’EPA est atteinte chaque jour pour les Américains[134]. À ce nombre s’ajoutent les perchlorates présents dans l’eau consommée d'où l'ampleur de la problématique. En effet, plusieurs sites d’approvisionnement en eau potable aux États-Unis ont été rapportés comme ayant des concentrations en perchlorate plus grandes que 18 ppb[78] - [135] ce qui, combiné à l’apport de perchlorate de la nourriture, peut excéder la « NOEL » déterminée par l'EPA.
Analyse chimique et recherche des perchlorates
Les perchlorates sont assez dangereux pour qu'il soit nécessaire de les détecter fiablement, même à très faibles doses, dans les milieux (eau, air, sol) et dans les organes et organismes. En cela, ils présentent encore un défi analytique.
Diverses méthodes analytiques coexistent, souvent récentes, allant de la chromatographie en phase liquide à haute performance à la spectroscopie Raman ou à la chromatographie à échange d'ions[136]. La plupart ont des avantages et des inconvénients, celles qui sont adaptées aux fluides (eau, gaz) l'étant souvent moins à la matière organique. Les recherches à ce sujet sont encore nécessaires.
Aux États-Unis, l'EPA[137] utilise depuis peu la chromatographie à échange d'ions (IC) pour quantifier la teneur en perchlorate de l'eau potable. La technique utilisée est celle de la chromatographie à ions avec détection de conductivité supprimée par « electrospray ionization mass spectrometry » (ESI-MS)[137]. Ici, une colonne à échange d’anions est utilisée et les anions ClO4− sont séparés des autres ions en utilisant une phase mobile qui est une solution aqueuse de KOH[137] ; la plus petite concentration déterminée selon leurs standards de qualité est de 0,1 μg/L en utilisant l'ion à m/z = 101. La limite de détection de la méthode a été déterminée comme étant de 0,02 μg/L dans l’eau et un standard interne de Cl18O4− est utilisé. L'analyse se fait à m/z = 101 soit pour l’ion 37Cl16O4−, car ils ont déterminé qu’il y a moins d’interférences sur le spectre de masse qu’à m/z = 99, soit pour l’ion 35Cl16O4−. L’EPA a utilisé une solution aqueuse de 65 ou 75 mM en KOH pour la phase mobile ce qui assurait d’avoir la force d’élution désirée.
Cette limite de détection est particulièrement basse par rapport à d'autres, mais implique de disposer d'un couteux détecteur de spectromètre de masse.
Les méthodes alternatives aux méthodes basées sur la chromatographie à ions et/ou sur la spectrométrie de masse qui ont été établies jusqu’à maintenant moins sensibles.
La spectroscopie Raman a des limites de détection de l’ordre de 10 à 100 μg/L[138]. Une technique utilisant l'« attenuated total reflectance FTIR » a rapporté des limites de détection de l’ordre des 3μg/L[135].
Traitements des sols et eaux contaminées
Sols pollués : Les perchlorates sont à la fois stables et solubles dans l'eau. Leur destruction peut produire du chlore toxique. Ceci rend la décontamination de milieux pollués difficile à grande échelle. Des décontaminations sont testées ou mises en œuvre sur les « spots » de pollution industrielle, mais semblent encore difficiles ou irréalistes in situ pour les zones largement contaminées[139].
Eaux polluées : Leur traitement peut se faire dans les usines de production d'eau ou chez le consommateur final, mais il n'est parfois que partiellement efficace (ou sinon couteux) ; Les principaux modes de traitement testés et permettant (seuls ou associés) de réduire la teneur en perchlorate dans l’eau sont :
- résine échangeuse d'ions ; Certaines résines échangeuses d'ions permettent de capter tout ou partie des ions perchlorate de l'eau[140], mais « l'affinité exceptionnellement de l'ion ClO4− pour les résines échangeuses d'anions rend extrêmement difficile et coûteuse la régénération conventionnelle de la saumure de NaCl pour les applications pratiques »[141]. Une nouvelle méthode utilisant le Tétrachloroferrate (FeCl4-) permet de régénérer les résines sans significativement altérer leurs performances. Il faut encore gérer le perchlorate ainsi récupéré (stockage, dégradation[142], destruction...).
- Bioreacteur ; plutôt utilisé ex-situ et de type réacteur à lit fluidisé, il utilise des micro-organismes sélectionnés qui vont réduire le perchlorate de l'eau en chlorure et en oxygène en présence d'un donneur d'électron et de nutriments (acide acétique, éthanol, méthanol, hydrogène, ammonium, phosphore, urée) dans un milieu entretenu de manière à soutenir la croissance microbienne (la réaction est : ClO4− → ClO3 → ClO2 → Cl− + O2). Ils ont permis de descendre à moins de 4 ng/L. Une étude conclut qu'il faut aussi retirer les ions nitrates du mélange pour que la destruction du perchlorate soit complète (NAVFAC, 2000).
- adsorption sur carbone (charbon de bois activé) en phase liquide: rarement utilisé car peu efficace pour les perchlorates, pourrait améliorer la performance d'autres traitements, en association avec eux ;
- Compostage du sol pollué ; il se pratique alors sous serre et ex-situ, avec enrichissement du sol en fumier ou matière organique riche[143]
- Bioremédiation ; elle se pratique in situ en condition anaérobie et peut concerner l'eau et/ou le sol pollué. Les bactéries utilisées sont Ideonella dechloratans, Proteobacteria, Vibrio dechloraticans Cuzensove B-1168, et Wolinella succinogenes HAP-1 (Urbansky and Schock, 1999). D'autres souches bactériennes ont été utilisées dans le genre Dechloromonaset Dechlorosoma (ITRC, 2005; Coates et al., 1999; Coates et al., 2000). Ces bactéries sont cultivées dans le sol et nourries avec des sucres et des protéines leur convenant [143];
- Réduction catalytique assistée par électrodialyse (permettant de détruire plus de 80 % des perchlorates de l'eau, avec de l'hydrogène comme « donneur d'électron » et un catalyseur[144].
- Barrière réactive perméable[143]
- Phytotechnologies[143]
- ultrafiltration sur membrane[143]
- Autres solutions (expérimentales ou faisant l'objet d'études)[143]
Certaines de ces techniques sont accessibles aux particuliers.
Au niveau domestique
Les filtres à charbon de bois activé ne sont pas efficaces pour le perchlorate[78].
« Les systèmes de traitement municipaux et plusieurs systèmes domestiques certifiés de purification par osmose inversée [voir osmose inverse] permettent de réduire la teneur en perchlorate à 6 ppb ou moins. »[107]. Ce type d’appareil est parfois utilisé pour faire face à une contamination locale.
Aspects législatifs, normes, seuils, recommandations pour la santé
États-Unis
Ce pays est parmi les plus touchés par une contamination générale de l'environnement (à l'échelle de régions voire d'États entiers). Il n'y a cependant pas de seuil "fédéral" pour l'eau potable valable pour le pays ; chaque État fixe son seuil, en tenant ou non en compte les recommandations de l’EPA[40] (seuil variant selon les États de 4 à 18 ppb pour l'eau de nappe destinées à l'eau potable à la fin des années 1990[99]).
- Les ministères de la défense et/ou de l’Énergie (DoD aux États-Unis) ont probablement freiné dans de nombreux pays les législations qui auraient pu limiter la dissémination de ce produit dans l'environnement, car un relèvement des seuils d'action (par l'EPA par exemple) rendrait peut-être inutilisable des terrains d’entrainement militaires, obligerait à dépolluer de nombreux sites et à trouver des alternatives plus coûteuses à certains usages (ou à produire des entrainements moins "crédibles" pour les soldats à l'entrainement).
- Malgré les alertes de l'EPA qui a dès 1998 placé le Perchlorate comme polluant candidat à une nouvelle évaluation [2], à la suite de la détection de plus en plus fréquente de perchlorates dans l'eau potable dans les années 1990[145] - [146], et la confirmation au printemps 1997 d'une « contamination généralisée » des eaux des États-Unis à la suite de l'utilisation d'une méthode analytique plus précise (seuil de quantification à 4 ppb) [2], ce n'est tardivement, aux États-Unis que le Congrès s'est saisi de cette question, et plutôt en traitant le problème en aval (sites et sols pollués) qu'en amont (ou on aurait pu cherche à réduire la pollution à la source, en gérant mieux la destruction des munitions non explosées ou en fin de vie (par l'« élimination inadéquate »[2] par immersion par exemple) et en utilisant en amont des alternatives ou maitrisant mieux les processus de fabrication, stockage et élimination)[40].
Au début du XXIe siècle, dans le cadre du National Environmental Policy Act, et d'une meilleure gouvernance, le législateur américain, pour mieux assoir ses décisions a imposé plus de transparence (Information Quality Act Section 515 de la Public Law 106-554, 2004-12-15) et des évaluations toxicologiques, économiques et sociales des impacts plus scientifiquement crédibles, relues par des pairs indépendants (Information Quality Bulletin for Peer Review, 2004-12-15).
L'EPA doit encore mettre à jour la "dose de référence" (RfD, dose à ne pas dépasser par jour dans l'alimentation pour un humain moyen) ; En 2002, en tenant compte de différents facteurs de risque (dont haute solubilité de l’ion perchlorate, observation de tumeurs de la thyroïde à la seconde génération, et manque d’études sur les effets d'une exposition à moyen terme, absence d'étude d'exposition à long terme), l’EPA a révisé la dose (provisoire) de référence (RfD) en la réduisant à 0,000 03 mg/kg/jour (avec un degré de confiance encore considéré comme moyen, en attendant des études plus précises). Cette dose avait déjà été révisée en 1992 puis 1995 sur la base des avancées scientifiques disponibles[147].
En Europe
En 2014, l'EFSA a adopté un avis scientifique sur le perchlorate [148].
La Commission européenne a pris connaissance du fait que du perchlorate a été trouvé dans les fruits et légumes produits dans l'Union européenne « plus répandue qu'initialement prévu », en raison notamment de l'« utilisation d'engrais contenant des niveaux élevés de perchlorate », niveau qui « contribue largement à la présence de perchlorate dans les fruits et légumes », mais note que d'autres sources peuvent aussi contribuer à cette contamination.
Une Déclaration sur les ions perchlorate a été mise à jour le , avec des Recommandations[149]. Des recommandations ont été publiées le 29 avril 2015 pour les aliments et l'eau potable[150]. Il est notamment recommandé de collecter des données de contamination des denrées alimentaires par les ions perchlorate, dont pour permettre aux agences d’évaluation des risques sanitaires de mieux caractériser l’exposition des consommateurs à ces contaminants, susceptibles de présenter un risque sanitaire pour certaines catégories de population, et pour définir à terme des mesures de gestion des risques pertinentes.
Il était prévu que des limites maximales de perchlorate dans les aliments (ou certains aliments) soient fixées en 2016[62].
En France
« Au-delà de quatre microgrammes par litre, il existe des restrictions de l'usage de l'eau pour les nourrissons de moins de six mois »[151], Seuil plusieurs fois dépassé dans les années 2000 sur quatre des huit forages du champ captant de Flers-en-Escrebieux (fermés pour cette raison)[151].
À la suite des analyses d'eau de consommation humaine qui a montré une contamination assez large (dans le nord du pays notamment), l’Agence nationale de sécurité sanitaire de l'alimentation, de l'environnement et du travail (Anses) a recommandé en cas de dépassement du seuil de 4 μg/L de perchlorates dans l’eau de ne pas préparer de biberons pour les nourrissons de moins de 6 mois, et en cas de dépassement du seuil de 15 μg/L de ne pas consommer d’eau du robinet pour les femmes enceintes et allaitantes, ce qui a conduit e 2012 les préfets du Nord et du Pas-de-Calais à prendre un arrêté de restriction sur la consommation d’eau pour les nourrissons de moins de 6 mois et les femmes enceintes et allaitantes dans le Nord-Pas-de-Calais (205 communes concernées dans le nord et 338 dans le Pas-de-Calais)[152]. Certaines communes de la somme sont également touchées[153]
- Au Canada, Santé Canada « recommande une valeur-guide pour l'eau potable de 6 ppb, basée sur un examen des évaluations de risque courantes d'autres organismes »[154]. Du perchlorate a été repéré dans plusieurs sources de cours d'eau, mais jamais au-dessus de 6 ppb jusqu’à présent (oct 2012), selon les analyses dont dispose Santé Canada[154] - [107].
Recherche d'alternatives
Aux États-Unis, un Groupe de travail (Perchlorate interagency working group ou IWG) a été institué, coprésidé par L'office of science and technology policy et l'office of management and budget, avec l'assistance de l'Académie des sciences pour faciliter un travail interdisciplinaire et scientifique des agences fédérales sur ce polluant émergent en identifiant mieux ses enjeux, y compris financiers.
Le DOD a produit un guide sur les méthodes analytiques et l'échantillonnage des sites potentiellement pollués dont il a la charge, et il a introduit le perchlorate parmi les matériaux non réglementés à évaluer sur le plan des impacts des munitions militaires à tester ou utilisées à l'entrainement sur les terrains militaires d'exercice.
Des programmes de recherche de propulsif moins toxiques ("perchlorate-free") pour les munitions ont été lancés[155].
En chimie organique, on connaît également des perchlorates covalents qui ne sont pas les sels de l'acide perchlorique mais leurs esters[156].
Sur la planète Mars
En , la NASA annonce que deux échantillons de sol martien ont été analysés par le laboratoire de chimie humide de la sonde Phœnix (MECA) comprenant aussi des examens par microscopie optique et des mesures électrochimiques et de conductivité électrique. Les résultats laissent penser que ce sol pourrait contenir des traces de perchlorate (sous réserve qu'il ne s'agisse pas d'une contamination éventuelle du module d'atterrissage Phœnix par des gaz ou des aérosols libérés par les moteurs à ergols solides (boosters PCPA au perchlorate d'ammonium/aluminium métal) de la fusée au moment de son lancement, et si elles sont réellement confirmées dans les échantillons de sol analysés[157]). Il semble peu vraisemblable que ces traces de perchlorate proviennent de l'atterrisseur Phœnix lui-même qui n'a utilisé que des ergols liquides à base d'hydrazine pure. En outre, le perchlorate a été retrouvé sous la surface du sol et à des concentrations plus élevées que celles attendues en cas de contamination au moment des opérations de lancement terrestre[158]. De nouvelles mesures devraient permettre de trancher la question, mais aucune trace de perchlorate n'avait été détectée au moment de la calibration et des tests à blanc du laboratoire de chimie humide MECA peu après l'atterrissage de la sonde Phœnix. La question demeure alors ouverte.
En 2013, le robot Curiosity trouve également des ions perchlorate sur le site d'atterrissage[159].
En , la NASA confirme la présence d'eau et de perchlorate dans le sol martien, relançant le débat sur les conditions d'apparition d'une hypothétique vie bactérienne sur la planète rouge, présente ou passée car les perchlorates semblaient pouvoir augmenter l'habitabilité de la planète rouge (pour une vie de type bactérienne) ; en effet ils diminuent fortement le point de congélation de l'eau, et sont une possible source d'énergie pour des microorganismes qui s'y seraient adaptés.
En 2017, une nouvelle étude produite par des chercheurs du Centre d'Astrobiologie de l'Université d'Édimbourg (Écosse) conclut que le sol martien pourrait être finalement encore moins hospitalier pour la vie que les scientifiques l'avaient pensé, car dans ce contexte les ultraviolets solaires (très intenses sur Mars dont l'atmosphère est 100 fois plus ténue que celle de la terre, et dépourvue de couche d'ozone protectrice) "activent" les perchlorates du sol de la planète rouge, en les transformant en « puissants micro-tueurs »[160]. Des tests faits sur la bactérie Bacillus subtilis (contaminant spatial commun) meurt en quelques minutes quand elle est exposée à des perchlorates activés par des UV à des niveaux similaires à ceux trouvés à proximité de la surface martienne, et elle meurt en 60 secondes si on ajoute des oxydes de fer et du peroxyde d'hydrogène, deux autres composants communs du régolite martien[160]. Hormis pour d'éventuelles espèces extrémophiles, la photochimie du sol martien rend moins probable la vie qu'on a pu l'imaginer, en tout cas en surface et probablement en subsurface là où des rayonnements ionisants pénètrent le sol. Le robot ExoMars (russo-européen) prévu pour 2020 disposera d'une perceuse pour rechercher des traces de vie jusqu'à 2 m de profondeur)[160].
Références
- « Perchlorate - PubChem Public Chemical Database », The PubChem Project, USA, National Center for Biotechnology Information
- U.S. EPA (2002). Perchlorate environmental contamination : Toxicological review and risk charactéerization (External review draft) ; U.S. Environmental Protection Agency, Office of Research and Development, National Center for Environmental Assessment, Washington Office, Washington, DC, NCEA-1-0503, 2002.
- Capcom EspaceCSG ; L'Usine Propergol Guyane ; 32 segments EAP, soit 3000 tonnes de propulsifs permet le décollage de 8 lanceurs par an
- Canexus, Fiche Chlorate de soude, Canada
- George Frederick Smith, A study of the perchlorates of the alkali and alkaline earth metals, their preparation, solubilities, and use in quantitative analysis ... 1923 ; 34 pp
- Schumacher, J. C., Ed., Perchlorates-their properties, manufacture and uses; ; Reinhold Publishing Corporation: NewYork, 1960, (réimprimé en 2011, sous (ISBN 1245186337 et 9781245186339), 276 p)
- Lawrence E. Matthews 2011, Perchlorates : Production, Uses and Health Effects ; Nova Science Pub Incorporated; 1 janv. 2011 ;359 pages
- Crump, K. and Goodman, G. (2003). Benchmark analysis for the perchlorate inhibition of thyroidal radioiodine uptake utilizing a model for the observed dependence of uptake and inhibition on iodine excretion. Prepared for J. Gibbs, Kerr-McGee Corporation. January 24, 2003 (presentation at the Fifth Meeting on Assess the Health Implications of Perchlorate Ingestion, July 29-30, 2004, Washington, D.C.)
- Brabant, G.P., Bergmann, P., Kirsch, C.M., Kohrle, J., Hesch, R.D., von zur Muhlen, A. 1992. Early adaptation of thyrotropin and thyroglobulin secretion to experimentally decreased iodide supply in man. Metabolism 41(10):1093-1096.
- Braverman, L.E., He, X., Pino, S., Magnani, B., Firek, A. 2004. Effects of low dose perchlorate on thyroid function in normal volunteers [abstract]. Thyroid 14(9):691.
- Halmi, N. S., R. G. Stuelke and M. D. Schnell (1956), "Radioiodide in the thyroid and in other organs of rats treated with large doses of perchlorate." Endocrinology 58(5): 634-50.
- Wolff, J. (1964). "Transport of Iodide and Other Anions in the Thyroid Gland." Physiol Rev 44: 45- 90.
- Carrasco, N. (1993). "Iodide transport in the thyroid gland." Biochim Biophys Acta 1154(1): 65-82. Cass, L. A., S. A. Summers, G. V. Prendergast, J. M. Backer, M. J. Birnbaum and J. L. Meinkoth (1999). "Protein kinase A-dependent and -independent signaling pathways contribute to cyclic AMPstimulated proliferation." Mol Cell Biol 19(9): 5882-91.
- Greer, M.A., Goodman, G., Pleus, R.C., Greer, S.E. 2002. Health effect assessment for environmental perchlorate contamination: The dose response for inhibition of thyroidal radioiodide uptake in humans. Environ. Health Perspect. 110:927-937.
- Richardson, D.S. et A.T. Ternes, Water analysis : Emerging Contaminants and Current Issues, Anal. Chem., 2005, 77, 3807-3838.
- Wu, J., Unz, R.F., Zhang, H. et B.E. Logan, Persistence of Perchlorate and the Relative Numbers of Perchlorate- and Chlorate-Respiring Microorganisms in Natural Waters, Soils, and Wastewater, Biorem. J., 2001, 5 (2), 119-130.
- Baohua Gu, John D. Coates ; Perchlorate: environmental occurrence, interactions and treatment, Ed : Springer ; 2006, e- (ISBN 0-387-31113-0) ([avec Google book])
- Damian, P., Pontius, F.W., 1999. From rockets to remediation: the perchlorate problem. Environ. Prot. 20, 24±3
- Nzengung, V., Wang, C., 2000. Influences on phytoremediation of perchlorate-contaminated water. In: Urbansky, E.T. (Ed.), Perchlorate in the Environment, Chapter 21. Kluwer/Plenum, New York
- source :EPA "Perchlorate is exceedingly mobile in aqueous systems and can persist for many decades under typical groundwater and surface water conditions", in Notice EPA ; Peer Review of EPA Draft Human Health and Ecological Risk Assessment of Perchlorate ; 2002/02/01
- Barzilai D, Sheinfeld M 1966 Fatal complications following use of potassium perchlorate in thyrotoxicosis. Isr J Med Sci 2:453–456 (Résumé)
- Jackson WA, Böhlke JK, Gu B, Hatzinger PB, Sturchio NC, Isotopic composition and origin of indigenous natural perchlorate and co-occurring nitrate in the southwestern United States ; Environ Sci Technol. 2010 Jul 1; 44(13):4869-76.
- Ericksen, G. E.; Hosterman, J. W.; St. , Amand, P. (1988), Chemistry, mineralogy and origin of the clay-hill nitrate deposits, Amargosa River valley, Death Valley region, California, U.S.A, Chemical Geology, 67: 85 - 102
- Hunter, W. J. Perchlorate is not a common contaminant offertilizers. J. Agron. Crop Sci. 2001, 187, 203-206
- Nature (News), Perchlorate found on Mars ; Unexpected chemical discovery intrigues mission scientists; aout 2008 ; doi:10.1038/news.2008.1016
- Ericksen, G. E. Geology and origin of the Chilean nitrate deposits. U.S. Geological Survey Professional Paper P 1188, 1981
- Mikhailov, I. S. Exogenesis and soil formation in the Atacama region. Eurasian Soil Sci. 2000, 33, 1255-1262 (Résumé Inist-CNRS)
- Johnston, J. C.; Thiemens, M. H. The isotopic composition of tropospheric ozone in three environments. J. Geophys. Res. [Atmos.] 1997, 102, 25395-25404.
- Johnson, D. G.; Jucks, K. W.; Traub, W. A.; Chance, K. V. Isotopic composition of stratospheric ozone. J. Geophys. Res. [Atmos.] 2000, 105, 9025-9031
- Simonaitis, R.; Heicklen, J. Perchloric acid. Possible sink for stratospheric chlorine. Planet Space Sci. 1975, 23, 1567-1569
- Victor Parro, Graciela de Diego-Castilla, Mercedes Moreno-Paz, Yolanda Blanco, Patricia Cruz-Gil, José A. Rodríguez-Manfredi, David Fernández-Remolar, Felipe Gómez, Manuel J. Gómez, Luis A. Rivas, Cecilia Demergasso, Alex Echeverría, Viviana N. Urtuvia, Marta Ruiz-Bermejo, Miriam García-Villadangos, Marina Postigo, Mónica Sánchez-Román, Guillermo Chong-Díaz, Javier Gómez-Elvira. A Microbial Oasis in the Hypersaline Atacama Subsurface Discovered by a Life Detector Chip: Implications for the Search for Life on Mars. Astrobiology, 2011; 11 (10): 969 DOI: 10.1089/ast.2011.0654 (résumé par Science Daily : Microbial Oasis Discovered Beneath the Atacama Desert(Feb. 16, 2012)])
- Ericksen, G. E. The Chilean nitrate deposits. Am. Sci. 1983, 71, 366-374.
- ET Urbansky, SK Brown, ML Magnuson, Perchlorate levels in samples of sodium nitrate fertilizer derived from Chilean caliche ; Environmental Pollution, 2001 - Elsevier, PDF
- Susarla, S., Collete, T.W., Garrison, A.W., Wolfe, N.L. et S.C. McCutcheon, Perchlorate identification in fertilizers, Environ. Sci. Technol., 1999, 33, 3469-3472.
- INRS, Jacques Leleu (mis à jour par Jérôme Triolet), Réactions chimiques dangereuses, INRS, Ref ED607, 407 pages, 2003 PDF, 2e Ed 2003, réédité 2004, (ISBN 2-85599-778-X)
- Huiming Bao & Baohua Gu, « Natural Perchlorate Has a Unique Oxygen Isotope Signature »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (consulté le ) ; American Chemical Society
- Urbansky, 1998a cité par EPA, 2002
- Voir chapitre "I.A.2. Principal and Supporting Studies (Oral RfD)" in EPA/IRIS Perchlorate and Perchlorate Salts : Integrated Risk Information System
- Voir chap "I.A.4. Additional Studies/Comments (Oral RfD)", in EPA / IRIS (Integrated Risk Information System) Perchlorate and Perchlorate Salts
- Baohua Gu, John D. Coates ; Perchlorate: environmental occurrence, interactions and treatment, Ed : Springer ; 2006, e- (ISBN 0-387-31113-0)
- Unregulated Contaminants Monitoring Rule (UCMR) Federal Register, 1999
- Rogers, D. E., Lt. Col. (1998) Perchlorate user and production information [memorandum with attachments to Annie M. Jarabek]. Wright-Patterson Air Force Base, OH: Department of the Air Force, Air Force Materiel Command Law Office; October 30.
- Exemple de brevet déposé aux États-Unis par Philipe J. Keifel te al. intitulé "Gelled pyrotechnic flare composition containing water-soluble carboxyl vinyl..", Patente N° 3461006, invention déposée 1967-10-27 et protégée depuis 1969
- Brevet (États-Unis), Richard P. Cornia et al , Compositions for producing flickering signals , ; N° de patente : 3983816, pour une invention déposée 1974-01-16 et brevetée à partir de 1976-10-05
- Brevet (États-Unis), Bernard E. Douda et al ;, Plastic pyrotechnic compositions containing Strontium perchlorate and Acrylic polymer Patente n°3258373 pour une invention déposée le 9 juillet 1964 et brevetée à partir de 1966-06-28
- Anses (2013) Campagne nationale d’occurrence de polluants émergents dans les eaux destinées à la consommation humaine ; Perchlorates et Nitrosamines (299 échantillons d’eaux analysés, dont 2/3 d’origine souterraine); PDF, 56 p ; oct 2013, Ed scientifique ; URL : https://www.anses.fr/fr/system/files/LABO-Ra-PolluantsEmergents-T01Ra.pdf |voir p 18/56
- I. M. Kolthoff and J. F. Coetzee (1957). "Polarography in acetonitrile.1 I. Metal ions which have comparable polarographic properties in acetonitrile and in water." J. Am. Chem. Soc. 79 870-874. J. Am. Chem. Soc., Fev. 1957, 79 (4), pp 870–874, DOI: 10.1021/ja01561a023 (Lien vers étude et/ou résumé)
- Siddiqui et al., 1998 cités dans l'étude (Review) APA 2002, présentée dans la bibliographie
- TRC Environmental Corporation, 1998 cité par l'EPA dans son évaluation 2002 (voir bibliographie)
- Urbansky, 17 2000; U.S. Environmental Protection Agency, 2001a,b; Urbansky and Collette, 2001, cités par l'évaluation 2002 de l'EPA (voir bibliographie);
- Rogers, 1998 cité par le rapport EPA 2002, présenté dans la bibliographie du présent article
- source : American Pacific Corporation, 1998 cité par EPA, 2002
- Schilt, 1979a cité par le rapport EPA 2002 de la bibliographie du présent article.
- Rogers, 1998 cité par EPA 2002
- Kerr-McGee Chemical LLC, 1998; American Pacific Corporation, 1998
- membre du Jet Propulsion Laboratory de Pasadena
- Y. Shi, N. Zhang, J. Gao, X. Li, Y. Cai (2011) Effect of fireworks display on perchlorate in air aerosols during the Spring Festival | Atmos. Environ., 45 , pp. 1323–1327|résumé
- Jimmie C. Oxley & al., Efficiency of perchlorate consumption in road flares, propellants and explosives ; https://dx.doi.org/10.1016/j.jenvman.2009.06.014,Journal of Environmental Management ; Volume 90, Issue 11, August 2009, Pages 3629–3634 (résumé)
- Siddiqui et al., 1998 cité par EPA 2002
- Williams, 2000, cité par EPA, 2002
- Dasgupta PK, Martinelango PK, Jackson WA, Anderson TA, Tian K, Tock RW, Rajagopalan S, 2005 The origin of naturally occurring perchlorate: the role of atmospheric processes. Environ Sci Technol 39:1569–1575 (Résumé)
- Commission Européenne ; Fiche Perchlorate, consulté 10 12 2017
- Lawrence, J.E., Lamm, S.H., Pino, S., Richman, K., Braverman, L.E. 2000. The effect of short-term low-dose perchlorate on various aspects of thyroid function. Thyroid 10(8):659-663.
- Lawrence, J., Lamm, S., Braverman, L.E. 2001. Low dose perchlorate (3 mg daily) and thyroid function. Thyroid 11(3):295.
- Données 2001, citées par EPA, avec cartes in EPA Review, 2002
- Brechner RJ, Parkhurst GD, Humble WO, Brown MB, Herman WH., Ammonium perchlorate contamination of Colorado River drinking water is associated with abnormal thyroid function in newborns in Arizona. J Occup Environ Med. 2000 ; Aug;42(8):777-82. (Résumé)
- ZPA, 2002, pages 61 sur 534 de la version PDF
- CalEPA (California Environmental Protection Agency). 2004. Public Health Goal for Chemicals in Drinking Water, Perchlorate. Office of Environmental Health Hazard Assessment, California Environmental Protection Agency.
- U.S. Food and Drug Administration 2004 ; Exploratory data on perchlorate in food. ; College Park, MD: Center for Food Safety and Applied nutrition/Office of Plant, Dairy Foods
- Ugeskr Laeger (1977), Hvor mange endnu? Perklorforgiftning i møntrenserier ; How many more? Perchlorate poisoning after dry-cleaning ; Ugeskrift for Laeger, Korn J. ; janvier 1977 31;139(5):303-4.[Article en Danois]
- Le parisien, Bordeaux : l'eau potable pourrait rester polluée pendant des années ; 2011-07-20
- HydroPlus info (2014) Alerte aux perchlorates en Champagne-Ardenne , brève du 4 juin 2014
- É. Blain-Lefèvre, S. Jacob, C. Douché, S. Gaudré, J.-J. Hérin et Y. Van Es (2016) Recherche de sources de perchlorates dans les ressources en eau du Nord–Pas-de-Calais ; TSM, 9 (2016) 14-28, publié: 28 septembre 2016 ; DOI: https://dx.doi.org/10.1051/tsm/201609014
- S. Jacob, C. Douché, S. Gaudré, M. Chaumontet et Y. Van Es (2016) Étude du comportement des perchlorates dans trois systèmes d’assainissement du Pas-de-Calais ; TSM, 9 (2016) 30-39, mais en ligne : 28 septembre 2016 DOI: https://dx.doi.org/10.1051/tsm/201609030
- Perchlorates : mesure des effets de perturbations endocriniennes dans des eaux souterraines contaminées D. Du Pasquier, S. Jacob, C. Douché, S. Gaudré, J.-J. Hérin et Y. Van Es TSM, 9 (2016) 41-49 Publié en ligne : 28 septembre 2016 DOI: https://dx.doi.org/10.1051/tsm/201609041
- Review convened by the Agency in February, 1999 (Research Triangle Institute, 1999, in EPA, 2002.
- Voir doc U.S. EPA (2002) ; Perchlorate environmental contamination : Toxicological review and risk charactéerization (External review draft), cité en bibliographie, page 48/534 du pdf.
- Logan, E.B., Assessing the outlook for perchlorate remediation, Environ. Sci. Technol., 2001, 35, 482 A-487 A.
- Williams, T. L.; Martin, R. B.; Collette, T. W. Raman spectroscopic analysis of fertilizers and plant tissue for perchlorate. Appl. Spectrosc. 2001, 55, 967-983
- lowest observed adverse effect level
- « A new fish study in the August 2006 issue of Environmental Toxicology and Chemistry indicates that perchlorate may also disrupt sexual development by overmasculinizing both males and females. » in Rebecca Renner, Reproductive Toxicity: New Take on Perchlorate Effects Environ Health Perspect. 2006 November; 114(11): A637. PMCID: PMC1665403 ()
- Richard R. Bernhardt, Frank A. von Hippel et William A. Cresko, https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3252384/ Perchlorate induces hermaphrodisism in threespine sticlkebacks] ; Environ Toxicol Chem. Author manuscript ; available in PMC 2012 January 5. Published in final edited form as : Environ Toxicol Chem. 2006 August; 25(8): 2087–2096. PMCID: PMC3252384 NIHMSID: NIHMS345735 (résumé)
- Richard R. Bernhardt, Frank A. Von Hippel et Todd M. O’Hara, Chronic perchlorate exposure causes morphological abnormalities in developing stickleback ; Environ Toxicol Chem. PMC 2012 January 4. Environ Toxicol Chem. 2011 June; 30(6): 1468–1478 ; En ligne 2011-04-04 ; doi:10.1002/etc.521
- (en) Yining Chen, Zhou Zhu, Yang Zhao et Xiaoling Wu, « Perchlorate in shellfish from South China Sea and implications for human exposure », Marine Pollution Bulletin, vol. 170, , p. 112672 (ISSN 0025-326X, DOI 10.1016/j.marpolbul.2021.112672, lire en ligne, consulté le ).
- Florian Schmidt, Sarah Schnurr, Raoul Wolf, Thomas Braunbeck, Effects of the anti-thyroidal compound potassium-perchlorate on the thyroid system of the zebrafish ; Aquatic Toxicology, Volume 109, March 2012, Pages 47-58
- Naval Weapons Industrial Reserve Plant (NWIRP) in McClellan County, TX
- Christopher Theodorakis, Jacques Rinchard, Todd Anderson, Fujun Liu, June-Woo Park, Filipe Costa, Leslie McDaniel, Ronald Kendall, Aaron Waters, Perchlorate in fish from a contaminated site in east-central Texas ; Environmental Pollution, Volume 139, Issue 1, janvier 2006, Pp 59-69 (résumé)
- Karen M. Eisenreich, Karen M. Dean, Mary Ann Ottinger, Christopher L. Rowe, Comparative effects of in ovo exposure to sodium perchlorate on development, growth, metabolism, and thyroid function in the common snapping turtle (Chelydra serpentina) and red-eared slider (Trachemys scripta elegans); Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, Volume 156, Issues 3–4, November 2012, Pages 166-170< ([résumé])
- Mindy Landrum, Jaclyn E. Cañas, Gopal Coimbatore, George P. Cobb, William A. Jackson, Baohong Zhang, Todd A. Anderson, Effects of perchlorate on earthworm (Eisenia fetida) survival and reproductive success ; Science of The Total Environment, Volume 363, Issues 1–3, 15 June 2006, Pages 237-244
- Fetax est l'acronyme de Frog Embryo Teratogenesis Assay-Xenopus, désignant un test utilisant l'embryon d'une grenouille. la Xénope est un animal modèle de laboratoire. Ce test est fondé sur l'observation d'anomalies de développement de l'embryon (durant 96-heures). Une évaluation de ce tests, commandée par l'EPA dans le cadre du programme national américain de toxicologie du Département américain de la santé l'a jugé insuffisant pour des enjeux impliquant une législation
- Lewandowski, M.R. Seeley, B.D. Beck, "Interspecies differences in susceptibility to perturbation of thyroid homeostasis: a case study with perchlorate", Regulatory Toxicology and Pharmacology, volume 39, issue 3, June 2004, pages 348-362 T.A. (résumé) Déclaration de conflit d'intérêt : « L'un des auteurs (BDB) a été embauché par la société Lockheed Martin comme un expert dans les litiges impliquant le perchlorate. Une partie de la recherche initiale présentée dans cette étude a été réalisée en collaboration avec son rôle dans cette affaire »
- Coates, J.D., Michaelidou, U., Bruce, R.A., O'Connor, S.M., Crespi, J.N., Achenbach, L.A., 1999. The ubiquity and diversity of dissimilatory (per)chlorate-reducing bacteria. Appl. Env. Microbiol. 65, 5234±5241.
- Coates, J.D., Michaelidou, U., O'Connor, S.M., Bruce, R.A., Achen- bach, L.A., 2000. The diverse microbiology of (per)chlorate reduction. In: Urbansky, E.T (Ed.), Perchlorate in the Environment, Chapter 24. Kluwer/Plenum, New York.
- Logan, B.E., 1998. A review of chlorate- and perchlorate-respiring microorganisms. Biorem. J. 2, 69-79
- Tonacchera M, Pinchera A, Dimida A, Ferrarini E, Agretti P, Vitti P, Santini F, Crump K & Gibbs J. Relative potencies and additivity of perchlorate, thiocyanate, nitrate and iodide on the inhibition of radioactive iodide uptake by the human sodium iodide symporter. Thyroid 2004 14 1012–1019 (résumé).
- EPA / National Center for Environmental Assessment (NCEA), First released an external review draft, 1998
- Site d'information de l'EPA sur le perchlorate dans l'eau potable
- Urbansky ET., Perchlorate as an environmental contaminant; Environ Sci Pollut Res Int. 2002;9(3):187-92.
- Joan Dollarhide, M.S., MSTC, J.D. , Présentation : Toxicology Excellence for Risk Assessment, par "TERA" (ONG ayant étudié ce sujet en 1997/1998), PDF, 20 diapositives
- Interagency Perchlorate Steering Committee, ou IPSC
- Argus Research Laboratories, Inc. 1998. A neurobehavioral developmental study of ammonium perchlorate administered orally in drinking water to rats [report amendment: July 27]. Horsham, PA: Argus Research Laboratories, Inc.; protocol no. 1613-002.
- Argus Research Laboratories, Inc. 2001. Hormone, thyroid and neurohistological effects of oral (drinking water) exposure to ammonium perchlorate in pregnant and lactating rats and in fetuses and nursing pups exposed to ammonium perchlorate during gestation or via maternal milk. Horsham, PA: Protocol no. ARGUS 1416-003.
- Saito K, Yamamoto K, Takai T, Yoshida S 1983 Inhibition of iodide accumulation by perchlorate and thiocyanate in a model of the thyroid iodide transport system. Acta Endocrinologica 104:456–461 résumé et texte complet
- Greer, M.A., Goodman, G., Pleus, R.C. et S.E. Greer, Health Effects Assessment for Environmental Perchlorate Contamination: The Dose Response for Inhibition of Thyroidal Radioiodine Uptake in Humans, Environ. Health Perspect., 2002, 110 (9), 927-937.
- Wenzel KW, Lente JR 1984 Similar effects of thionamide drugs and perchlorate on thyroid-stimulating immunoglobulins in Graves’ disease: evidence against an immunosuppressive action of thionamide drugs. J Clin Endocrinol Metab 58:62–69 (Résumé et texte complet)
- Martino E, Mariotti S, Aghini-Lombardi F, Lenziardi M, Morabito S, Baschieri L, Pinchera A, Braverman L, Safran M 1986 Short term administration of potassium perchlorate restores euthyroidism in amiodarone iodine-induced hypothyroidism. J Clin Endocrinol Metab 63:1233–1236 (Résumé et texte complet)
- Santé Canada, Le perchlorate et la santé humaine, 2008-01-07 (en ligne)
- P.B., Susan, U.S. EPA Memorandum [En ligne]. 26 janvier 2006 [19 mars 2008]. Disponible sur Web : http://www.epa.gov/fedfac/pdf/perchlorate_guidance.pdf
- Lewis E. Braverman, Elizabeth N. Pearce, Xuemei He, Sam Pino, Mara Seeley, Barbara Beck, Barbarajean Magnani, Benjamin C. Blount et Anthony Firek, Effects of Six Months of Daily Low-Dose Perchlorate Exposure on Thyroid Function in Healthy Volunteers ; in The Journal of Clinical Endocrinology & Metabolism July 1, 2006 vol. 91 no. 7 2721-2724 ; online 2006-04-24, avant publication papier ; doi:10.1210/jc.2006-0184
- Feng Xiao Li & al., Neonatal thyroid-stimulating hormone level and perchlorate in drinking water, Teratology, Volume 62, Issue 6, pages 429–431, December 2000 ; online:2000-11-17 ; DOI: 10.1002/1096-9926(200012)62:6<429::AID-TERA10>3.0.CO;2-I (Résumé)
- Tellez RT, Chacon PM, Abarca CR, Blount BC, Landingham CB, Crump KS, Gibbs JP 2005 Long-term environmental exposure to perchlorate through drinking water and thyroid function during pregnancy and the neonatal period. Thyroid 15:963–975 (Résumé)
- Amitai Y, Sack J, Wasser J, Winston G, Leuis M, High concentrations of perchlorate in drinking water did not affect neonatal thyroxine levels. Proc Annual Meeting of the North American Congress of Clinical Toxicology, Orlando, FL, September 9–14, 2005 (Résumé)
- Lamm SH, Perchlorate exposure does not explain differences in neonatal thyroid function between Yuma and Flagstaff, in J Occup Environ Med. ; 2003 Nov;45(11):1131-2. Lien PubMed
- Rubin, R., Pearl, M., Kharrazi, M., Blount, B. C., Miller, M. D., Pearce, E. N., ... & Steinmaus, C. (2017). Maternal perchlorate exposure in pregnancy and altered birth outcomes. Environmental Research, 158, 72-81 (résumé).
- Vigreux-Besret, C., Mahé, A., Ledoux, G., Garnier, A., Rosin, C., Baert, A., ... & Rivière, G. (2015). Perchlorate : water and infant formulae contamination in France and risk assessment in infants. Food Additives & Contaminants: Part A, 32(7), 1148-1155 |résumé.
- (Hiasa et al 1987, Fernandez-Santos et al 2004;.. Pajer et Kalisnik 1991 cités par EPA / IRIS (Integrated Risk Information System)
- Fernandez Rodriguez et al. (1991) cités par EPA / IRIS (Integrated Risk Information System)
- Kessler et Kruskemper (1966) cités par Perchlorate and Perchlorate Salts, EPA / IRIS (Integrated Risk Information System)
- Pajer et Kalisnik (1991), cités par Perchlorate and Perchlorate Salts, EPA / IRIS (Integrated Risk Information System)
- Argus, 1999 cité par Perchlorate and Perchlorate Salts, EPA / IRIS (Integrated Risk Information System)
- Voir chapitre "II.A.4. Supporting Data for Carcinogenicity " in Perchlorate and Perchlorate Salts EPA / IRIS (Integrated Risk Information System)
- IRIS (Integrated Risk Information System), Perchlorate and Perchlorate Salts, page mise à jour 2011-03-07, consultée 2011-10-02
- Gullick Richard W. ; Lechevallier Mark W. ; Barhorst Twila S.(2001), Occurrence of perchlorate in drinking water sources; vol. 93, no1, pp. 66-77 (40 ref.) Langue / Language Anglais Ed: American Water Works Association
- Company History ; American Water Corporate Information
- SE. Cunniff, RJ Cramer et HE Mautpin, in "Perchlorate : Challenges and Lessons" (in Baohua Gu, voir bibliographie de cet article)
- Smith, N.P., Yu, L., McMurry, S.T., et T.A. Anderson, Perchlorate in water, soil, vegetation, and rodents collected from the Las Vegas Wash, Nevada, USA, Environ. Pollut., 2004, 132, 121-127.
- Yu, L., Cañas, J.E., Cobb, G.P., Jackson, W.A. et T.A. Anderson., Uptake of perchlorate in terrestrial plants, Ecotoxicol. Environ. Saf., 2004, 58, 44-49.
- Sanchez, C.A. Krieger, R.I., Khandaker, N., Moore, R.C., Holts, K.C. et L.L. Neidel, Accumulation and Perchlorate Exposure Potential of Lettuce Produced in the Lower Colorado River Region, J. Agric. Food. Chem., 2005, 53, 5479-5486.
- Renner, R., 1999. Study finding perchlorate in fertilizer rattles industry. Environ. Sci. Technol 33, 394A-395A.
- [Chilean Nitrate Corporation (CNC) [http:// www.cncusa.com website] 1999
- Renner, R., 1999. Perchlorate-tainted wells spur government action. Environ. Sci. Technol. 33, 110A-111A..
- Renner, R., 1999b. Studying perchlorate in fertilizer rattles industry. Environ. Sci. Technol 33, 394A-395A
- IRIS (Integrated Risk Information System), Perchlorate and Perchlorate Salts, page mise à jour 2011-03-07, consultée 2011-10-02
- Renner, R., Perchlorate in food, Environ. Sci. Technol. [En ligne]. 13 février 2008 [20 mars 2008]. Disponible sur Web : « http://pubs.acs.org/subscribe/journals/esthag-w/2008/feb/science/rr_perchlorate.html »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?)
- Hebert, G.N., Odom, M.A., Bowman, S.C., Strauss, S.H., Attenuated Total Reflectance FTIR Detection and Quantification of Low Concentrations of Aqueous Polyatomic Anions, Anal. Chem., 2004, 76, 781-787.
- Liu, Y. et S. Mou, Determination of trace levels of haloacetic acids and perchlorate in drinking water by ion chromatography with direct injection, J. Chromatogr., 2003, 997, 225-235.
- Hedrick, E. et T. Behymer, U.S. EPA Determination of Perchlorate in Drinking Water by Ion Chromatography with Suppressor Conductivity and Electrospray Ionization Mass Spectroscopy En ligne. Mars 2005 [21 mars 2008]
- Gu, B., Tio, J., Wand, W. Ku, Y.-K. et S. Dai, Raman Spectroscopic Detection for Perchlorate at Low Concentrations, Appl. Spectrosc., 2004, 58, 741-744.
- Damian, P.; Pontius, F. W. From rockets to remediation: the perchlorate problem. Environ. Protect. 1999, June issue, 24-31.
- Gu, B.; Brown, G. M.; Alexandratos, S. D.; Ober, R.; Dale, J. A.; Plant, S. Efficient treatment of perchlorate (ClO4 -)-contaminated groundwater with bifunctional anion-exchange resins. Environ. Sci. Res. 2000, 57, 165-176.
- Gu B, Brown GM, Maya L, Lance MJ, Moyer BA., Regeneration of perchlorate (ClO4-)-loaded anion exchange resins by a novel tetrachloroferrate (FeCl4-) displacement technique ; Environ Sci Technol. 2001 Aug 15;35(16):3363-8 (résumé)
- Gu B, Dong W, Brown GM, Cole DR. Environ Sci Technol. 2003 May 15; 37(10):2291-5, Complete degradation of perchlorate in ferric chloride and hydrochloric acid under controlled temperature and pressure
- EPA, Federal Facilities Forum Issue Paper Perchlorate Treatment Technology Update, 2005-05-36, PDF , 84 pages
- D.M. Wang, C.P. Huang, Electrodialytically assisted catalytic reduction (EDACR) of perchlorate in dilute aqueous solutions; Separation and Purification Technology, Volume 59, Issue 3, 1 March 2008, Pages 333-341 (résumé)
- Perciasepe, R., 1998. Part III. Environmental Protection Agency. Announcement of the drinking water contaminant candidate list; notice. Fed. Regist. 63 (40), 10273-10287, see also Drinking Water Contaminant Candidate List, Feb. 1998, EPADoc.No. 815-F-98-002.
- Browner, C.M., 1999. Part II. Environmental Protection Agency. 40 CFR Parts 9, 141 and 142. Revisions to the unregulated contaminant monitoring regulation for public water systems ; final rule. Fed. Regist. 64 (180), 50 555-50 620.
- EPA, 2002, page 64/534 de la version PDF (voir bibliographie)
- Scientific Opinion on the risks to public health related to the presence of perchlorate in food, in particular fruits and vegetables (Avis scientifique sur les risques pour la santé publique liés à la présence de perchlorate dans les aliments, en particulier les fruits et légumes), EFSA, septembre 2014
- Commission européenne (2015) [https://ec.europa.eu/food/sites/food/files/safety/docs/cs_contaminants_catalogue_perchlorate_statement_food_update_en.pdf Statement as regards perchlorate agreed at the Standing Committee on 10 March 2015 (updated 23 June 2015) ; Déclaration relative au perchlorate approuvée lors de la réunion du Comité permanent du 10 mars 2015 (mise à jour le 23 juin 2015)
- Commission européenne 2015, Commission Recommendation 2015/682 (EU), on the monitoring of perchlorate in food (including drinking water) in 2015 (and 2016) 29 April
- Pascal Forciolo, directeur général adjoint de l'Agence régionale de la santé (ARS), interrogé par la Voix du Nord
- Arrêté du 25 octobre 2012 portant restriction d'usage, à des fins alimentaires, de l'eau distribuée par les réseaux publics (PDF 0,13 Mb) & Arrêté complémentaire du 12 septembre 2014 fixant les listes de communes concernées par la restriction d'usage de l'eau résultant de l'arrêté du 25 octobre 2012 précité (PDF, 1,87 Mb)
- Site sur le taux de perchlorates par communes dans la Somme, et liste
- Santé environnement, Santé de l'environnement et du milieu de travail ; Le perchlorate et la santé humaine, consulté 2012-10-17, susceptible de mises à jour.
- environnemental reserach and development program CP-1404. Robust, Perchlorate-free propellands with reduced pollution. 2004
- (en) P. O. Markov, N. V. Yashin et E. B. Averina, « Covalent Organic Perchlorates: Synthesis and Properties », Reviews and Advances in Chemistry, vol. 12, no 3, , p. 178–193 (ISSN 2634-8276 et 2634-8284, DOI 10.1134/S2634827622600153, lire en ligne, consulté le )
- http://www.nasa.gov/mission_pages/phoenix/news/phoenix-20080804.html
- Miles O'Brien and Kate Tobin (2008-08-04). « Toxin in soil may mean no life on Mars », CNN. Accédé le 2008-08-05.
- Internationale Herald Tribune (2 octobre 2013) « Surprises in the soil of Mars »
- Mike Wall (2017) Toxic Compounds May Sterilize Martian Soil Microbes could be killed off by perchlorates exposed to ultraviolet radiation on the planet’s surface ; 07 juillet 2017
Voir aussi
Articles connexes
Liens externes
- (fr) Ministère de la santé (français) Perchlorates dans l’eau du robinet : Questions/réponses , 2012
- (fr) INRS, Fiche toxicologique de l'INRS sur l'acide perchlorique
- (fr) CDC, Fiche internationale de sécurité de l'acide chlorique
- (fr) Santé-Canada, Santé Canada : Le perchlorate et la santé humaine
- (en) « Perchlorates dans l'alimentation aux USA »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (Une nouvelle étude de la FDA donne des moyennes mais n'inclut pas les populations très exposées, Environmental Science & Technology, 13/02/08,)
- (en) EPA, Méthode d’analyse des perchlorates dans l’eau (pour l'EPA)
Avis Anses
- Anses (2011) ; Avis relatif à la présence d’ions perchlorate dans le lait infantile et dans l’eau destinée à la consommation humaine en France ; Saisine no 2011-SA-0208 et no 2011-SA-0336 URL : https://www.anses.fr/fr/system/files/EAUX2011sa0336.pdf
- Anses (2012) Avis "relatif aux études épidémiologiques portant sur les associations entre une exposition aux ions perchlorate dans l’eau de boisson et la fonction thyroïdienne dans des populations spécifiques" Saisine 2012-SA-0119 ; Maisons-Alfort, le , PDF, 16 p. URL : https://www.anses.fr/fr/documents/EAUX2012sa0119.pdf
- Anses (2013) Campagne nationale d’occurrence de polluants émergents dans les eaux destinées à la consommation humaine ; Perchlorates et Nitrosamines (299 échantillons d’eaux analysés, dont 2/3 d’origine souterraine); PDF, 56 p ; oct 2013, Ed scientifique ; URL : https://www.anses.fr/fr/system/files/LABO-Ra-PolluantsEmergents-T01Ra.pdf
Bibliographie
- Baohua Gu, John D. Coates ; Perchlorate: environmental occurrence, interactions and treatment, Ed : Springer ; 2006, e- (ISBN 0-387-31113-0)
- Clark, J.J.J., 2000. Toxicology of perchlorate. In: Urbansky, E.T. (Ed.), Perchlorate in the Environment, Chapter 3. Kluwer/Plenum, New York (Extraits avec Google Book).
- Clewell, R.E., Chaudhuri, S., Dickson, S., Cassady, R.S., Wallner, W.N., Eldridge, J.E., Tsui, D.T., 2000. Analysis of trace lever perchlorate in drinking water and ground water by electrospray mass spectrosmetry. In: Urbansky, E.T. (Ed.), Perchlorate in the Environment, Chapter 6. Kluwer/Plenum, New York.
- Hubé D (2013) Potentialités d'un marquage des eaux souterraines par des substances pyrotechniques en relation avec les zones de combats de la première guerre mondiale. Le cas des perchlorates. Rapport final, BRGM/RP-62008-FR, 26 p.
- Jackson, P.E., Laikhtman, M., Rohrer, J., 1999. Determination of trace level perchlorate in drinking water and ground water by ion chromatography. J. Chromatogr. A 850, 131-135.
- Jackson, P.E., Gokhale, S., Rohrer, J.S., 2000. Recent developments in the analysis of perchlorate using ion chromatography. In: Urbansky, E.T. (Ed.), Perchlorate in the Environment, Chapter 5. Kluwer/Plenum, New York.
- Magnuson, M.L., Urbansky, E.T., Kelty, C.A., 2000. Determination of perchlorate at trace levels in drinking water by ion-pair extraction with electrospray-mass spectrometry. Anal. Chem. 72, 25-29.
- Magnuson, M.L., Urbansky, E.T., Kelty, C.A., 2000. Microscale extraction of perchlorate in drinking water with low level detection by electrospray-mass spectrometry. Talanta.
- Urbansky, E. T. Perchlorate chemistry: implications for analysis and remediation. Bioremediation J. 1998, 2, 81-95.
- U.S. EPA (1998). Perchlorate Environmental Contamination: Toxicological Review and Risk Characterization Based on Emerging Information, External Review Draft. Washington, DC, EPA Doc. No. NCEA-1-0503.
- U.S. EPA (2002). Perchlorate environmental contamination : Toxicological review and risk charactéerization (External review draft) ; U.S. Environmental Protection Agency, Office of Research and Development, National Center for Environmental Assessment, Washington Office, Washington, DC, NCEA-1-0503, 534 pages, 2002 (Présentation)
- VIGREUX-BESRET C., MAHÉ A., LEDOUX G., GARNIER A., ROSIN C., BAERT A., JOYEUX M., BADOT P.M, PANETIER P. et RIVIÈRE G. (2015), Perchlorate: water and infant formulae contamination in France and risk assessment in infants. Food Additives & Contaminants, Part A, vol. 32, no 7, p. 1148-1155.
- EPA, Comment-Response Summary Report, REPORT Peer Review of Drinking Water Health Advisory for Perchlorate ; Contract No. EP-C-07-021 ; Work Assignment No. 1-06 Prepared for U.S. Environmental Protection Agency, Office of Water, Office of Science and Technology ; Health and Ecological Criteria Division
- U.S. FDA (2002) Perchlorate: Questions and Answers (from the FDA), 94 pp
- INRS, Jacques Leleu (mis à jour par Jérôme Triolet), Réactions chimiques dangereuses, INRS, Ref ED607, 407 pages, 2003 PDF, 2e Ed 2003, réédité 2004, (ISBN 2-85599-778-X)



