Argile
L’argile est une matière rocheuse naturelle à base de silicates ou d'aluminosilicates hydratés de structure lamellaire, provenant en général de l'altération de silicates à charpente tridimensionnelle, tels que les feldspaths. Elle peut être une matière localement abondante, très diverse, traitée ou raffinée avant emploi, à la fois meuble ou plastique (souvent après addition d'eau) ou à pouvoir desséchant, absorbant ou dégraissant, voire à propriétés collantes ou encore réfractaires, pour servir par exemple autrefois selon des usages spécifiques, souvent anciens, au potier et au briquetier, au maçon et au peintre, au teinturier et au drapier, au verrier et à l'ouvrier céramiste.
En réalité, le terme issu du latin argilla peut s'appliquer au choix à un minéral argileux et à un ensemble de minéraux argileux, ainsi qu'à diverses roches composées pour l'essentiel de ces minéraux[n 1]. Les roches de la classe des lutites peuvent être l'argilite, l'argilolite ou argilotithe, les shales à l'exclusion des schistes métamorphisés. Les argiles sont des roches sédimentaires clastiques. Lorsqu'elles renferment du calcaire, trois sous-classes sont définies entre le pôle argile et le pôle calcaire en fonction de l'augmentation de la teneur en calcaire : argile calcaire puis marne et enfin calcaire argileux. Les argiles riches en silice gélatineuse, soluble dans les alcalis, se nomment gaizes. Le limon ou le lehm désignent des argiles renfermant des particules siliceuses et accessoirement des pigments minéraux comme la limonite ou la goethite. Le lœss est un dépôt de couleur jaunâtre d'origine paléoglaciaire composé principalement d'argiles et de fines particules calcaires et siliceuses.
Dans un sens étendu, il s'agit aussi d'un sédiment composé de particules fines issues de l'altération de diverses roches (processus appelé argilisation), parfois des roches sédimentaires argileuses métamorphisées en schistes. C'est pourquoi le monde paysan conscient de cette matière divisée fondamentale pour le développement de la vie par sa rétention d'eau qualifiait d'argiles au sens générique les limons et les terres grasses ou dégraissantes, molles ou malléables suivant leur degré d'humidité, susceptibles de se durcir à sec en plaques qui se rétractent et fendillent au soleil ou bien de libérer au vent ou par grattage léger de fines poussières de cette matière devenue friable et cassable, de s'amollir à l'eau et de générer en milieux humides après tassements répétés des boues colorées plus ou moins liquides, plus ou moins salissantes, plus ou moins collantes[n 2]. Il savait que l'adjonction d'argiles rend plus ou moins rapidement les terres imperméables, au contraire du sable fin perméable. Une terre argileuse peut être lourde et compacte, résistante et difficile au labour, se durcissant en croûtes épaisses parfois plus ou moins craquelées lors des sécheresses.
Le potier et le maçon savaient reconnaître l'argile verte ou la terre glaise des argilières, avec laquelle ils pouvaient préparer une matière de base pour leur art, le premier une forme pour une poterie spécifique, le second en fabricant un ciment ou une chaux hydraulique[n 3]. Les hommes des métiers du feu distinguaient les argiles fusibles, comme les argiles figulines appréciés pour les faïences communes, les briques et les tuiles et les argiles smectiques, en usage pour dégraisser les draps comme terre à foulon, des argiles infusibles, telles que le kaolin ou diverses argiles plastiques. Les peintres antiques connaissaient déjà les argiles ocreuses tout comme les modestes constructeurs en terres argileuses utilisaient sans le savoir les propriétés de l'argile colloïdale.
L'argile en géologie, minéralogie et pédologie
Historiquement, en géologie et science du sol, le terme argile correspond à l’ensemble des minéraux présentant une taille inférieure à 2 µm dans une roche. Cette coupure granulométrique invisible à l'œil est héritée des études pétrographiques effectuées par microscopie optique à la fin du XIXe siècle. Les cristaux présentant alors une taille inférieure à 2 µm n'étaient pas reconnaissables et classés sous l’appellation argile[1]. Aujourd'hui, l’appellation argile diffère en fonction des domaines d'étude. Ainsi, en géotechnique, où l’on s’intéresse avant tout au comportement mécanique des sols, on désigne par argile les matériaux de granulométrie inférieure à 4 µm (entre 4 et 50 µm, on parle de limon). En science des argiles, l'argile ne correspond pas à une coupure granulométrique, mais à des minéraux. Le terme est alors utilisé pour décrire les phyllosilicates et plus particulièrement les minéraux argileux.
Minéraux argileux
Ces derniers sont classés en trois grandes familles selon l'épaisseur des feuillets (0,7 ; 1,0 ou 1,4 nm), qui correspondent à un nombre de couches d'oxydes tétraédriques (Si) et octaédriques (Al, Ni, Mg, Fe2+, Fe3+, Mn, Na, K, etc.). L'interstice entre feuillets peut contenir de l'eau ainsi que des ions. Il en résulte des variations de la distance entre feuillets, et donc des variations dimensionnelles macroscopiques de l'argile quand elle s'hydrate (dilatation) ou s'assèche (contraction) pouvant provoquer des fissures. Un matériau sec qui contient beaucoup de minéraux argileux « happe à la langue » (absorbe de l'eau en formant une pâte plastique)[2].
Les phyllosilicates se présentent sous forme de petits cristaux micrométriques, en plaquettes hexagonales ou en (micro)fibres. Ce sont les minéraux phylliteux halloysite, kaolinite, montmorillonite, illite et bravaisite, la glauconite, les smectites, les interstratifiés comme les vermiculites, les minéraux fibreux tels que les attapulgites ou les sépiolites, enfin les chlorites et les micas, ces dernières en très petits morceaux souvent altérés pouvant être assimilés à des argiles[n 4].
Leur origine est variée : altération de roches ou résidus de roches suivant des conditions locales suivant les zones d'altération des roches endogènes[3], sols à apport sédimentaire, diagenèse, éruption volcanique, météorites spécifiques. L'essor des études par rayons X (radiocristallographie, diffraction X, etc.) a permis l'étude et la caractérisation des argiles.
Roches argileuses
Les roches argileuses sont des roches sédimentaires ou résiduelles à grains très fins (classe des lutites), contenant au moins 50 % de minéraux argileux. Ces roches tendres, rayables à l'ongle, fragiles à sec et durcissantes à la chaleur ou à la cuisson, imperméables et faisant pâte à l'eau, sont abondantes dans les formations sédimentaires, tant continentales que marines. Elles se divisent en argiles calcaires, argiles sableuses, micacées, etc. Elles peuvent être déposées en horizon ou couches de faible puissance, alternant avec d'autres couches rocheuses telles que calcaires, grès, évaporites, etc. en structures litées (shale), rubanées ou varvées. Elles peuvent aussi constituer des masses par empilement quasi-continus de couches épaisses, parfois même sans stratification apparente (argilite). En présence de minéraux détritiques, les argiles contiennent souvent des débris, morceaux ou clastes de roches divers. Dans tous les cas, les formations argileuses jouent un rôle majeur pour les ressources en eau et en hydrocarbures, car elles entravent ou stoppent l'écoulement parfois lent de ces derniers minéraux liquides.
Par exemple, l'argilite est une roche argileuse composée pour une large part de minéraux silicates d'aluminium plus ou moins hydratés présentant une structure feuilletée (phyllosilicates) expliquant leur plasticité, ou fibreuse (sépiolite et palygorskite) expliquant leurs qualités d'absorption.
Structure des minéraux argileux
Les minéraux argileux sont tous constitués à partir d'un empilement de feuillets tétraédriques et octaédriques entrecoupés par un espace appelé espace interfoliaire :
- les feuillets tétraédriques sont agencés en mailles hexagonales et sont constitués de tétraèdres d'oxygène entourant un atome de silicium ou d'aluminium ([SiO4]4−, [AlO4]5−) ;
- les feuillets octaédriques sont composés d'octaèdres formés par deux plans d'oxygènes-hydroxyles encadrant des atomes plus larges tels que : Al, Fe, Mg, Li, etc. Les cations constituants du feuillet octaédrique induisent, selon leur valence, une modification du taux de remplissage de la couche. Ainsi, pour une couche octaédrique purement magnésienne par exemple, constituée donc d'ions Mg2+, un taux de remplissage de 100 % est constitué. Tous les octaèdres sont occupés : on parle d'argile trioctaédrique. À l'inverse, pour une couche octaédrique purement alumineuse par exemple, constituée donc d'ions Al3+, le taux de remplissage sera aux 2⁄3. Deux octaèdres sont remplis et un est laissé vide : on parle de vacance ;
- des substitutions isomorphiques peuvent intervenir entre les différents atomes constituants de la couche tétraédrique ou octaédrique (notamment Si4+ par Al3+ dans la couche tétraédrique, Al3+ partiellement substitués par des ions Mg2+ et/ou Fe3+ ou Fe2+ dans la couche octaédrique). Ces substitutions induisent un déficit de charge permanent, faisant de beaucoup d'argiles des espèces stablement chargées négativement. Ces charges sont compensées par l'incorporation de cations (anhydres, hydroxylés ou hydratés) soit dans l’espace interfoliaire des minéraux (c'est le cas pour les minéraux argileux de type smectite ou vermiculite) et/ou à la surface externe des particules (cas de la kaolinite)[4]. Ces cations (K+, Na+, Ca2+, etc.) dans l'interfeuillet, appelés « compensateurs de charges » ou « cations échangeables », rétablissent la neutralité électrique de l'édifice[5] ;
- les groupements OH− présents en bordure des argiles induisent également une capacité d'échange et d'adsorption d'espèces chargées. Ces groupements hydroxyles sont cependant dépendant du pH ainsi : À bas pH, les hydroxyles de surfaces sont entièrement protonés (OH) l'argile montre une charge de bordure globalement positive. À haut pH, les hydroxyles se déprotonent, la surface est globalement négative (O2−). On parle alors ici de charges variables. Ces dernières sont nettement moins importantes que les charges permanentes, mais jouent tout de même un rôle dans la capacité d'échange de l'argile ;
- exemple de calcul de la charge permanente : Si on considère une Kaolinite, de formule Si4Al4O10(OH)8, le bilan de charge est le suivant : 4 atomes Si4+ + 4 atomes Al3+ + 18 atomes O2− + 8 atomes H+ = . Cette argile n'a pas de charge permanente et donc aucun cation interfoliaire pour neutraliser la charge. La totalité de la capacité d'échange de cette argile est liée à ses charges variables de bordure. À l'inverse, une Montmorillonite de formule (Na)0,6(Al3.4, Mg0.6)Si8O20(OH)4•nH2O montre le bilan suivant : 8 atomes Si4+ + 3,4 atomes Al3+ + 0,6 atomes Mg2+ + 24 atomes O2− + 4 atomes H+ = ce déficit est comblé par l'incorporation de 0,6 cations monovalent, ou 0,3 cations divalent (dans l'exemple on considère Na0.6). La totalité de la capacité d'échange de cette argile est liée à ses charges permanentes ainsi qu'à ses charges de bordure.
Propriétés de gonflement et d'échange
Certaines argiles présentent la capacité d'augmenter leurs espaces interfoliaires. Cette propriété provient de l'incorporation de cations hydratés (Na, Ca, etc.) permettant de compenser les déficits de charges permanents. Ce phénomène n'existe plus si la charge de l'argile est trop forte (ex. : micas : charge totale de l'argile de -1 parfaitement contrebalancé par les cations déshydratés (K)) ou nulle (ex. : pyrophyllite, talc : charge totale de l'argile de 0, aucun cation interfoliaire). Les espèces expansibles sont celles dont la charge varie de 0,3 à 0,8 ce qui comprend la sous-classe des smectites ainsi que les vermiculites. C'est l'eau incorporée via les cations hydratés qui permet le gonflement de l'édifice cristallin. Le gonflement est d'autant plus important que l'humidité est élevée. À un état parfaitement sec, une smectite n'aura aucune molécule d'eau, la distance feuillet + interfolaire = 10 Å, comme une pyrophyllite. La distance feuillet + interfolaire d'une smectite peut ainsi aller de 10 Å à 18 Å.
Les cations qui compensent les charges permanentes et variables de l'argile restent, pour la plupart, échangeables dans l'environnement. Chaque argile a ainsi une CEC propre témoignant de leur appartenance à une des grandes familles de minéraux argileux. À titre indicatif, les smectites ont une capacité d'échange bien plus grande que les kaolinites, car, pour ces dernières, leur capacité d'échange est uniquement dictée par les charges variables
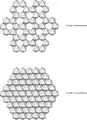 Différence de structure entre un feuillet octaédrique dioctaédrique et trioctaédrique.
Différence de structure entre un feuillet octaédrique dioctaédrique et trioctaédrique. Structure atomiques d'une argile TOT trioctaédrique.
Structure atomiques d'une argile TOT trioctaédrique. Structure des feuillets d'une argile TOT trioctaédrique.
Structure des feuillets d'une argile TOT trioctaédrique. Vue du feuillet tétraédrique arrangé en mailles pseudo-hexagonales.
Vue du feuillet tétraédrique arrangé en mailles pseudo-hexagonales. Vue d'un empilement de 10 feuillets.
Vue d'un empilement de 10 feuillets.
Floculation
La plupart des minéraux argileux ont la particularité de posséder une charge de surface négative. En conséquence, les feuillets se repoussent entre eux, et l'apport de cations réduit cette répulsion électrique, ce qui entraîne l'agglomération des particules argileuses, phénomène appelé floculation. Un des buts du chaulage des sols est la floculation stable du complexe argilo-humique[6]. Dans les estuaires, le taux de salinité de la mer (dû en partie au cation Na+) favorise la floculation bien en amont de l'embouchure. Les particules argileuses floculent et forment un amas de vase, le bouchon vaseux. « Pendant les périodes de mortes-eaux, on constate une phase d'accumulation pendant laquelle les vases vont se consolider partiellement pour former la crème de vase[7] ».
Classification des minéraux argileux
On différencie les argiles par leur type de combinaison d'empilement des feuillets tétraédriques et octaédriques, le cation de la couche octaédrique, la charge de l'argile et le type de matériel interfoliaire[8] - [9].
Les minéraux argileux se répartissent en plusieurs grandes familles :
- les minéraux argileux dits 1:1 ou TO : Ces derniers sont constitués d'un feuillet tétraédrique surplombant une couche octaédrique. Ils présentent typiquement une taille de 7 Å (TO+interfoliaire). En fonction de la nature du feuillet octaédrique, on distingue les argiles TO à feuillet trioctaédrique (feuillet de type brucite, Mg(OH)2) et les argiles TO à feuillet dioctaédrique (feuillet de type gibbsite, Al(OH)3) ;
- les minéraux argileux dits 2:1 ou TOT : Ces derniers sont constitués de deux feuillets tétraédriques encadrant une couche octaédrique. Ils présentent en fonction de l'espèce une taille allant de 10 Å à 18 Å (TOT+interfoliaire). Comme pour les argiles TO, on distingue les argiles TOT à feuillet dioctaédrique et les argiles TOT à feuillet trioctaédrique ;
- les minéraux argileux dits 2:1:1 ou TOT:O : Ces derniers sont constitués de deux feuillets tétraédriques encadrant une couche octaédrique, l'espace interfoliaire est rempli par un feuillet octaédrique. Ce feuillet interfoliaire octaédrique possède la même structure que la brucite, on parle dans ce cas de feuillet brucitique. Les argiles 2:1:1 présentent typiquement une taille de 14 Å (TOT+O). Ce groupe est constitué par le grand groupe des chlorites. On les classe également selon l'aspect dioctaédrique ou trioctaédrique du feuillet octaédrique et du feuillet brucitique.
Tableau récapitulatif des argiles
Nomenclature utilisée : Te/Si = rapport entre le nombre de cations Si tétraédriques par maille qu'il y aurait en l'absence de substitution dans le feuillet tétraédrique et le nombre de cations Si tétraédriques par maille existant réellement, Oc = rapport entre la charge totale des cations par maille dans le feuillet octaédrique, et la charge totale des cations par maille qu'il y aurait dans le feuillet octaédrique en l'absence de substitution . Les parenthèses indiquent le(s) cation(s) octaédrique(s). Les crochets indiquent le(s) cation(s) de compensation dans l'espace interfoliaire
Explication du classement : exemple d'une montmorillonite de charge 0,6 (avec sodium interfoliaire) : (Na)0,6(Al3.4, Mg0.6)Si8O20(OH)4• nH2O : La couche tétraédrique est entièrement Si ; on a donc Te/Si=8, à l'inverse l'octaèdre montre (par définition) une substitution Al↔Mg on a donc le bilan des charges positives (dans cet exemple) = 3,4 × 3+0,6 × 2 = 11,4 ; or la charge parfaite de l'octaèdre d'une argile TOT est de 12. On se retrouve alors dans le cas Oc<12/12. Attention, il n'est pas rare de trouver les formules par demi-maille des argiles, la montmorillonite de l'exemple devient alors (Na)0,3(Al1.7, Mg0.3)Si4O10(OH)2• nH2O
| dioctaédrique | dioctaédrique | trioctaédrique | trioctaédrique |
| Te/Si = 4
Oc = 12/12 |
Te/Si = 4
Oc = 12/12 |
Te/Si = 4
Oc = 12/12 |
Te/Si < 4
Oc > 12/12 |
| Espacement stable | Espacement variable | Espacement stable | Espacement stable |
| Kaolinite (Al), Nacrite (Al), Dickite (Al) | Halloysite (Al) | Antigorite (Mg), Chrysotile (Mg), Lizardite (Mg, Al) | Cronstedtite (Fe2+, Fe3+), Berthiérine (Al, Fe2+), Amésite (Al, Mg) |
| Te/Si = 8 | Te/Si = 8 | Te/Si < 8 | Te/Si < 8 | Te/Si < 8 |
| Oc = 12/12 | Oc < 12/12 | Oc = 12/12 | Oc < 12/12 | Oc = 12/12 |
| Espacement stable | Espacement variable | Espacement variable | Espacement variable | Espacement stable |
| Pyrophyllite (Al) | Smectites : Montmorillonite* (Al) | Smectites : Beïdellite (Al, Fe), Nontronite (Fe3+) | Vermiculite*** (Al) | Muscovite (Al), [K], Illite** (Al), [K], Séricite (Al), [K], Damouzite (Al), [K], Paragonite (Al), [Na], Glauconite (Al, Fe), Céladonite (Al, Fe) |
- Le terme « smectite » souvent utilisé de manière abusive représente l'ensemble des espèces TOT, gonflantes, ayant une charge par demi-maille comprise entre −0,2 et −0,6.
- Quand Te/Si < 8 cela implique que les cations Si4+ de la couche tétraédrique sont substitués, généralement par des cations de valence inférieure (Al3+, Fe3+, etc.), et donc cela implique l'existence d'une charge négative à la surface du feuillet (avec des cations de compensation qui sont souvent des alcalins comme Na+).
- De même, quand Oc <12/12, cela implique que les cations de la couche octaédrique (généralement Al3+ ou Fe3+) sont substitués, généralement par des cations de valence inférieure (Mg2+, etc.), et donc cela implique également l'existence d'une charge négative à la surface du feuillet.
| * La montmorillonite, dont une forme, qui a pour formule Si4O10Al5/3Mg1/3Na1/3(OH)2, est connue sous l'appellation de « terre de Sommières » utilisée comme détachant ou comme bentonite employée en génie civil en raison de ses propriétés colloïdales (plastifiant dans les mortiers). À la différence de l'halloysite, plusieurs couches d'eau peuvent prendre place entre deux feuillets de montmorillonite et par conséquent la séparation entre deux feuillets peut aller de 0,96 nm à la séparation complète. ** L'illite (1 nm), de formule approximative K0.9Al2(Al0.9Si3.1O10)(OH)2, possède une charge par demi-maille de −0,75 à −0,9. Elle peut servir à la fabrication des objets en terre cuite. La structure des illites est proche de celle des micas mais en diffère par le degré de substitution Si/Al (inférieur dans l'illite), la présence de potassium (inférieure dans l'illite) et pour un certain degré de désordre dans l'empilement des feuillets. | ||||
| Te/Si = 8 | Te/Si = 8 | Te/Si < 8 | Te/Si < 8 | Te/Si < 8 |
| Oc = 12/12 | Oc < 12/12 | Oc = 12/12 | Oc < 12/12 | Oc = 12/12 |
| Espacement stable | Espacement variable | Espacement variable | Espacement variable | Espacement stable |
| Talc(Mg), Minnésotaïte (Mg, Fe2+) | Smectites : Stevensite (en) (Mg), Hectorite (Mg, Li) | Smectites : Saponite (Mg), Bowlingite (uk) (Mg, Fe2+), Sauconite (en) (Mg, Zn) | Vermiculite (Ni2+), Batavite (Mg) | Phlogopite (Mg), Illite (Mg, Fe), [K], Biotite (Mg, Fe), [K], Lépidolite (Mg, Fe), [K], Ledikite (Mg, Fe), [K] |
| Feuillet TOT | Dioctaédrique | Dioctaédrique | Trioctaédrique | Trioctaédrique |
| Feuillet 'brucitique' O interfoliaire | Dioctaédrique | Trioctaédrique | Dioctaédrique | Trioctaédrique |
| Donbassite | Cookéite, Sudoïte | Franklinfurnacéite | Diabantite (uk), Penninite (uk), Chamosite, Brunsvigite, Clinochlore, Thuringite, Ripidolite, Shéridanite (uk) | |
- Le groupe Tri-Tri est le plus répandu sur terre. Les groupes Di-Tri et Di-Di sont plus rares. Le groupe Tri-Di reste encore inconnu, aucun minéral de ce type n'a encore été découvert.
Diffraction des rayons X
Une des techniques utilisées pour reconnaître les argiles est l'analyse par diffraction de rayons X. Cette technique nécessite une préparation spécifique de l'échantillon. Chacune des méthodes de préparation permet d'obtenir des informations différentes sur la structure du minéral.
La préparation désorientée se fait, comme son nom l'indique, à partir d'une poudre compacte dont les constituants auront été désorientés. Plusieurs méthodes sont utilisées : la poudre arasée, le « side loading », le « back loading » ou encore le « spray-dried ». La désorientation « parfaite » d'une poudre reste une technique délicate, pouvant être fortement influencée par les éventuelles orientations préférentielles induites par certains minéraux. La poudre désorientée reste la méthode de préparation majoritairement utilisée pour l'identification des phases dans un échantillon minéral. Cette dernière permet d'obtenir l'ensemble des plans de diffraction des phases constituantes. Les argiles, quant à elles, sont plus difficilement différentiables par cette technique, car leurs plans cristallographiques sont pour beaucoup identiques d'une famille à l'autre. Les diffractogrammes montrent alors des pics superposés rendant la lecture et l'identification des phases plus complexes. Cependant, bien que présentant certains inconvénients (pour les phyllosilicates) la vision globale des plans de diffractions permet d'atteindre des paramètres tels que le taux de remplissage de la couche octaédrique, etc.
Une variante de la préparation désorientée consiste à placer la poudre dans un capillaire. Cette technique donne des résultats semblables, mais permet de travailler avec des quantités de matières bien inférieures.
La préparation de lames orientées est une méthode mise en place pour discerner les différents phyllosilicates d'un échantillon. Elle consiste à laisser sédimenter un échantillon pendant un laps de temps (loi de Stokes) donné afin d'en récupérer uniquement la fraction <2 µm, considérée comme étant la fraction renfermant la phase argileuse « pure ». Cette fraction en solution est ensuite déposée sur une lame de verre, puis séchée. Lors du séchage les particules lamellaires d'argiles vont toutes s'orienter selon leur plan cristallographique (001) (à l'image d'une pile de papier tombant à terre, toutes les pages finissent grande face vers le sol). Lorsque l'on soumet cette lame à la diffraction, on n'obtient donc que les raies 00l (c'est-à-dire 001, 002, etc.). Ces raies sont caractéristiques des grandes familles de minéraux argileux.
Dans certains cas, les pics de diffractions sont fatalement superposés. Pour différencier les argiles, on effectue alors divers traitements visant à modifier l'espace inter-feuillets : chauffage, acidification, remplacement du cation interfoliaire, etc. En regardant l'évolution des pics de diffraction aux faibles angles selon le traitement, on peut reconnaître l'argile.
Outre en géochimie, cette technique est également utilisée par la police scientifique pour essayer de déterminer l'origine des traces de terre qui peuvent constituer un indice lors d'une enquête.
Essai au bleu de méthylène
Pour reconnaître les différents types d'argile on peut pratiquer un essai au bleu de méthylène. En dosant la concentration de bleu de méthylène après un contact avec une argile, on en déduit indirectement la CEC de cette dernière. Ce qui permet de classer globalement le minéral.
Couleurs
Les particules d'argile ne sont nullement responsables de la couleur du sol. La couleur rouge, orange, jaune, vert, bleu d'un sol (argileux ou non) est due à l'état du fer dans le sol (Fe3+ dans les trois premiers cas et Fe2+ dans les deux derniers). Lorsque le sol est d'une couleur tendant vers le blanc, c'est que cet élément a été dissous et évacué hors du profil.
Argile peut désigner une couleur d'un gris neutre très pâle tirant sur le blanc.
Chimie
Dans l'eau, les particules d'argile se comportent comme des gouttes d'huile dans la vinaigrette : elles se regroupent et forment des « micelles » en suspension : on dit que l'argile est à l'état « dispersé ». La présence de sels minéraux dissous portant des charges positives (Ca, Mg, K, Na, NH4, Fe, Mn, Cr, Ti, Al, Ba, Sr, etc.) provoque la liaison des micelles entre elles : l'argile est floculée. Cette propriété des argiles va lui permettre d'être liquide à l'état dispersé, pâteuse dans la boue et solide dans un sol sec. L'argile est un colloïde qui flocule avec des cations.
Formation géologique
Les argiles désignent de très fines particules de matière arrachées aux roches par l'érosion ainsi que les minéraux argileux ou phyllosilicates (ces dernières observées au microscope ont la forme de plaquettes, ce qui explique leur plasticité). La plupart de ces particules proviennent de la désagrégation de roches silicatées (altération des silicates) : du granite (mica et feldspath), du gneiss ou encore des schistes. Ces particules sont transportées par le vent ou l'eau sous forme de limon ou de vase. Les fleuves véhiculent des argiles qui finissent par se déposer en alluvions, dans le cours d'eau lui-même, à son embouchure, dans un lac ou dans la mer. Les dépôts peuvent alors sédimenter et former une roche argileuse par diagenèse : déshydratation et compactage. En tant que roches sédimentaires, les affleurements argileux présentent une succession de strates empilées les unes sur les autres.
Les éruptions volcaniques produisent aussi des argilolithes, parfois sous d'éjecta de pierre vitreuse ou de tuf.
Argiles néo-formées
Les terres argileuses sont composées d'éléments très fins, provenant de la dégradation mécanique et chimique de roches préexistantes (en particulier les micas et les feldspaths). Les argiles résultant peuvent rester sur les lieux mêmes de leur formation, comme le kaolin. Elles sont le plus souvent entraînées par les eaux ou le vent, se déposant sous forme de masses stratifiées ou parfois en poches lenticulaires ou sphériques. On trouve ainsi les bancs d'argile dans les sédiments depuis l'ère Tertiaire, au pied des montagnes et dans les grandes vallées fluviales. Après la dissolution d'un calcaire, des argiles peuvent également se former puis tapisser les dépressions karstiques (les dolines). Lors de leurs déplacements, elles peuvent entraîner des minéraux rencontrés sur leur chemin. D'où une très grande variété de finesse, de coloration et de composition, selon les niveaux successifs d'un même gisement et à plus forte raison de l'un à l'autre[10].
Argiles et plantes
Les racines des plantes, par hydrolyse et en symbiose avec la pédofaune, se nourrissent des roches, et sécrètent pour les dissoudre des acides : les racines, grâce aux sucres issus de leur photosynthèse, fournissent l'énergie nécessaire aux micro-organismes pour qu'ils transforment la roche en éléments absorbables par les racines. Les besoins des plantes en silice, fer et aluminium sont infimes, or ce sont les éléments constitutifs de la croûte terrestre majoritaires (silicium 26 %, aluminium 7 %, fer 4 %). Donc à mesure que les autres éléments sont prélevés et exportés définitivement (recyclage constant) en surface pour nourrir la plante et le sol, ces trois derniers restent et se concentrent jusqu'à saturation — d'autant plus vite que ces éléments sont déjà majoritaires. Ils recristallisent alors en argiles (formation d'un précipité). La formation biologique de l'argile serait maximale dans la zone du sol située entre 5 et 25 cm de profondeur. La production annuelle serait de 0,000 01 à 0,002 g par 100 g de matériaux par an, ce qui est relativement lent. En considérant qu'un mètre de terre pèse environ 10 000 tonnes à l'hectare, cela correspond à une production annuelle de 3 à 60 kg à l'hectare sur 30 cm de sol.
Les facteurs influençant positivement la formation de l'argile sont une humidité édaphique élevée (drainage modéré), une température élevée, la grande finesse de grain de la roche-mère, sa richesse en bases et sa friabilité. Plus le sol est ancien plus la formation d'argile est rapide, et c'est finalement le type de sol, donc de climat et de communautés biologiques, qui influe le plus sur la quantité d'argile produite[11].
Utilisation et usages

L'argile est un des plus anciens matériaux utilisés par l'homme. Pétrie avec de l'eau, elle donne une pâte plastique qui peut être facilement moulée ou mise en forme. Le modelage s'effectuait selon trois techniques fondamentales, par colombin, par plaque ou par estampage. De nombreuses sculptures ont été réalisées en terre crue, ou terre séchée, comme dans l'art gréco-bouddhique, au Gandhara (Nord Pakistan et Afghanistan), ou dans les oasis du Xinjiang. Les sculptures de gardiens de temples bouddhiques au Japon de l'époque de Nara ont été réalisé avec ce matériau en raison de sa souplesse d'utilisation. Les sculpteurs européens des XVIIIe et XIXe siècle ont conservé cet état de certaines sculptures.
Après cuisson, elle donne un objet résistant et (si argile de haute température, émaillé ou porcelaine) imperméable. Ces propriétés remarquables sont à l'origine de son utilisation très ancienne pour réaliser des objets en céramique, en porcelaine, etc.
Elles peuvent également être utilisées pour leurs propriétés thérapeutiques.
Terre cuite et céramique
L'argile hydratée est malléable, elle peut être mise en forme ; après séchage, elle devient solide, et le reste de manière permanente après un passage au four (« cuite »). Ces propriétés en font un matériau de choix pour la fabrication d'objets céramiques.
Une terre argileuse destinée à la cuisson est souvent appelée « glaise » ou « terre glaise ». Suivant sa destination, on lui a donné des noms divers : terre à four, terre à brique, terre à pipe, terre à potier, terre à porcelaine (le kaolin), etc. En céramique, l'argile est une terre de composition variable, souvent savamment préparée, qui fait pâte avec l'eau, se façonne aisément et durcit au feu, parfois simplement au soleil et au vent chaud desséchant.
On peut nommer la plus grande partie des argiles grasses et plastiques par les termes « terres à faïence commune» , « argiles communes », « argile(s) à biscuit ». Ces argiles contiennent assez de fer et autres impuretés minérales pour devenir solides, cuites de 950 à 1 300 °C environ, sur une échelle pratique de température de basse température (950 à 980 °C) à haute température (1 280 à 1 300 °C). À l'état naturel, elles sont grises, verdâtres, rouges ou brunes à cause des oxydes qu'elles contiennent, oxyde de fer, oxyde de titane et autres. Ces argiles figulines se colorent au feu.
La couleur de l'argile cuite peut aller du blanc ou du rose au noir en passant par toutes les nuances de jaune, rouge, brun, plus rarement vert ou bleu, suivant la qualité particulière de chaque argile (teneur en oxydes métalliques) et les conditions de cuisson. La majorité des poteries dans le monde est réalisée avec ce genre d'argile, ainsi que les briques, les tuiles, les tuyaux et autres productions similaires.
L'argile commune peut être très plastique, et même trop plastique et trop collante pour être employée seule ; d'autre part, il arrive qu'elle ne le soit pratiquement pas à cause de la présence de sable ou d'autres débris rocheux.
Le potier et le sculpteur recherchent une terre à faïence douce et plastique, qu'ils peuvent éventuellement modifier en ajoutant un peu de sable d'argile non plastique, de la chamotte, ou des fibres de cellulose.
Le briquetier, lui, recherche une terre moins fine contenant du sable et d'autres débris non plastiques, qu'il pourra presser, sécher et cuire, sans crainte de gauchissement, de fentes ou de retrait excessif. Briques et tuiles sont aujourd'hui fabriquées industriellement à partir d'un mélange d'argile et d'eau moulé sous pression et cuit à température suffisamment élevée (1 000 à 1 300 °C).
Enfin on peut pratiquer une « minéralurgie » pour éliminer ou ajouter les éléments indésirables ou nécessaires sur les argiles, afin de leur donner les caractéristiques nécessaires à leur utilisation plus ou moins industrielle.
Argiles infusibles ou réfractaires, porcelaine
Les argiles réfractaires sont des argiles qui résistent sans se vitrifier aux températures les plus élevées, par exemple à la fusion des céramiques. Elles servent à réaliser des fours en métallurgie ou sidérurgie, en céramique.
Considérant les trois composants essentiels des argiles : alumine, silice et fondants, plus l'argile est riche en alumine plus elle est réfractaire. Par contre la silice[12] peut jouer un double rôle : elle augmente la fusibilité et augmente l'influence des fondants à haute température ; mais elle peut aussi élever le point de fusion, particulièrement si elle est à l'état non combiné[13].
Les principales argiles réfractaires ont une constitution très uniforme (autrement dit, ses constituants sont répartis uniformément) ; et elles sont très pures, exemptes d'inclusion de quartz ou autres matières mélangées[13].
Un certain nombre d'argiles plastiques, douces, onctueuses au toucher, peuvent être mises en forme pour réaliser des matériaux réfractaires (poterie, briques, creusets, faïences, etc.). Ces argiles spécifiques sont utilisées en fonderie, pour réaliser une grande diversité de moules de cuisson.
Le kaolin présent en abondance à Saint-Yrieix et servant à la porcelaine de Limoges ou celui à la porcelaine de Saxe, est friable, blanc et se délaye facilement à l'eau. C'est la terre à porcelaine des anciens, la matière de base pour la porcelaine.
Argiles dites colorantes, charges ou agents rhéologiques en peinture, dans l'industrie du bâtiment, dans l'industrie du forage
Certaines argiles contenant des oxydes métalliques ont un pouvoir colorant et un pouvoir couvrant remarquable, ainsi certaines argiles contenant différents hydroxydes de fer qu'on nomme l'ocre. Les ocres colorent encore parfois les façades des maisons.
L'usage des argiles dans l'art pictural est très varié. Selon leurs natures, elles peuvent être des pigments, des charges, des épaississants ou fluidifiants, des opacifiants ou minorants de coloration, etc.
Dans les peintures comme sur les champs de forage modernes, l'ajout de charges minérales comme la bentonite permet d'obtenir la rhéologie souhaitée et améliore aussi la stabilité des suspensions (cataphorèse).
L'argile colloïdale est un silicate d'alumine de granulométrie inframicrométrique employé comme ciment dans les argiles pour en agréger les éléments sablonneux. Lorsque la teneur en argiles colloïdales croît, la plasticité s'accroît.
Argiles en association avec la chaux
Associée intimement à la chaux en fines proportions, par exemple par cuisson directe avec la pierre à chaux, elles permettent la fabrication des chaux hydrauliques et de ciments spécifiques.
Argiles dégraissantes ou adsorbantes
Ce sont les argiles smectiques ou terres à foulon. Elles peuvent dégraisser les draps. La sépiolite peut être employée comme terre absorbante pour litière animale, par exemple à chats.
Sculpture
La saponite est une argile utilisée comme pierre à savon, à l'instar de la stéatite. L'écume de mer est une sépiolite qui est facilement taillée pour élaborer statuettes ou pipes.
Argiles médicinales
Différents types d'argiles (verte, blanche et rouge principalement), notamment pour leurs propriétés couvrantes et adsorbantes, sont utilisés pour leurs propriétés thérapeutiques (en cas de lésions, d'infections, d'aérophagie, etc.)[14] - [15]. Cette utilisation est ancestrale et perdure dans de nombreuses cultures[16]. Elle revient dans les pratiques médicales. Les impuretés sont piégées entre les feuillets.
En usage externe, elles sont alors utilisées en cataplasme, parfois avec adjonction de miel, que l'on peut faire soi-même mais que l'on commence à trouver en pharmacie. Ces cataplasmes peuvent être prescrits par certains chirurgiens lors de cicatrisations difficiles. Les argiles médicinales sont largement utilisées pour les masques de beauté en cosmétique.
L'usage interne doit se faire avec précaution, notamment parce que certaines argiles sont naturellement contaminées par des métaux toxiques tels que le plomb. Les smectites sont déjà largement utilisées pour calmer les muqueuses intestinales ou dermiques irritées. Ce sont elles que l'on trouve en pharmacie dans les sachets de diosmectite. Il faut alors prendre des argiles ultraventilées pour éviter les particules de micas blessant, mais surtout éviter la prise de médicaments et les matières grasses.
L'aluminium contenu dans l'argile ne migre pas dans le sang[17].
Des compléments alimentaires à base d'une argile appelée « octalite » et commercialisés sous les marques « Terrafor ventre plat »[18] ou « Defiligne » ont été interdits en France en 2016 en raison de leur teneur trop élevée en plomb[19].
La terre-argile est un terme ésotérique associé notamment à l'emploi de l'argile pour ses propriétés thérapeutiques.

Terre crue
L'argile, premier des bétons au sens étymologique, est employée dans la fabrication de briques de terre crue, matériau de construction naturel essentiel des régions du globe où la végétation est rare, et notamment de la plupart des rivages méditerranéens[20]. C'est aussi le matériau principal dans les techniques de torchis, bauge, pisé, béton de terre, adobe, etc.
La terre-papier est une argile contenant des fibres de cellulose, qui présente une grande résistance lorsqu'elle est sèche. La terre-papier, utilisée crue, est un matériau de création et de décoration qui adhère sur toute surface poreuse et peut recevoir des peintures, pigments et patines. Elle peut aussi être utilisée cuite ; elle est alors moins lourde que les autres argiles, plus résistante aux chocs thermiques, mais plus fragile contre les impacts.
La vermiculite est un excellent isolant thermique.
Jardin et champs aux sols argileux, agriculture
Les argiles peuvent être modélisées comme des colloïdes constituées de fines particules (micelles) portant chacune une charge électrique de même signe en suspension dans un milieu, l'autre colloïde du sol étant l'humus. Ces deux éléments s'associent grâce en particulier à l'action des lombrics pour former le complexe argilo-humique qui est la base du système permettant aux racines des plantes de puiser les éléments nourriciers du sol (cf. double-circuit descendant et ascendant de la sève).
L'argile a la propriété de se retrouver dans deux états réversibles :
- elle peut être dispersée. Dans ce cas elle s'infiltre entre les éléments sableux et ne se soude pas en agrégat. Avec la pluie, l'argile se gonfle et empêche l'eau et l'air de pénétrer dans le sol. Le sol se glace. En séchant le sol se crevasse ;
- elle peut être floculée. L'argile est agrégée en petites mottes. Dans cet état elle n'est pas diluée par l'eau. L'eau et l'air peuvent passer entre les agrégats. Avec la présence de l'argile les agrégats retiennent de l'eau.
Dans le sol, le calcium (apporté si nécessaire par un chaulage) permettra de floculer l'argile (entre autres). Ce calcium peut provenir de sels calciques ou de chaux. Le calcium Ca2+ ayant deux charges positives va pouvoir retenir deux micelles d'argile qui elle est chargée négativement.
Une fois ces paramètres intégrés, on comprend aussi que les actions mécaniques en eux-mêmes n'ont aucune influence sur ce phénomène. On peut, par exemple, laisser geler des mottes sans action à long terme sur les micelles d'argile, dès la première pluie le phénomène va se reproduire. Il sera nécessaire de prendre le problème dans son ensemble : une couverture appropriée (litière) qui protège et nourrit le processus humique, un travail racinaire qui décompacte et aère, un apport de matière organique et d'amendements à vocation structurante.
Dans tous les cas, lors d'une culture sans labour, la fragmentation n'est pas l'objet premier recherché, même s'il évite la traditionnelle semelle de labour ; celle-ci (la fragmentation), est le résultat de l'activité racinaire, soutenue par tous les échanges de la rhizosphère. C'est aussi un des intérêts majeurs du recours à certains engrais verts. Notons encore que le taux d'humus et l'usage d'amendements appropriés, outre le travail radiculaire, peut-être un recours complémentaire pour fragmenter un sol argileux compacté. En tout état de cause, chaque sol à son profil et son histoire, et « la » solution doit intégrer l'ensemble des données[21]. Si les vers de terre apportent aussi leur contribution à ce travail d'aération et de fragmentation en creusant leurs galeries, leur apport déterminant se situent dans le brassage des composés minéraux, argileux, avec les composés humiques. Le composé humique (humus) pour sa part est le fruit d'un travail complexe qui se développe depuis la litière et toute sa vie (faune et flore), associant aussi les champignons, (notamment pour décomposer la cellulose et la lignine), et les bactéries incroyablement actives et irremplaçables au niveau de la rhizosphère qui permet l'humification des matières organiques et par suite, la constitution du complexe argilo-humique.
Le CAH (complexe argilo-humique) permet l'association des deux colloïdes du sol et est beaucoup plus stable que la floculation unique, toujours grâce à l'action des liens ioniques.
À l'instar de n'importe quel paillage sur un sol vivant, l'incorporation de bois raméal fragmenté est utile de ce point de vue, si l'on respecte l'ensemble du processus, les matières ligneuses doivent en effet se décomposer lentement en surface, pour relancer la création d'humus. Le facteur taille est important — on parle de « chips » —, car si on ajoute profondément dans le sol de grosses particules non décomposées, elles ne généreront pas l'humus recherché et les micelles d'argile en dispersion continueront à gonfler, asphyxier et se rétracter.
Les engrais verts peuvent permettre de limiter le phénomène mais un bon drainage du sol argileux peut aussi s'avérer nécessaire, qu'il passe par un travail mécanique, par un amendement restructurant régulateur de son comportement hydrique, ou par l'adjonction d'arbres ou arbustes à enracinement plus profond.
Par ailleurs, un sol argileux présente l'inconvénient de se réchauffer moins vite au printemps. En effet, l'air chauffe plus vite que l'eau et un sol gorgé d'eau n'a plus d'air, donc se réchauffe moins vite. tout ce qui va aérer et restructurer ce sol sera donc utile.
Alimentation
L'argile a été utilisée pour permettre la consommation par l'homme d'aliments sauvages tels les glands non doux [22] - [23] - [24] ou les pommes de terre sauvages. Si ces aliments étaient mangés seuls ils causeraient des problèmes digestifs, mais mangés avec de l'argile ils deviennent consommables. Dans les Andes, les pommes de terre sont trempées dans de l'argile avant d'être ingérées[25] - [26]. Dans cette optique, l'argile a été consommée par les Américains natifs, au Pérou, et en Italie[27].
En l'absence de lessivage, les Amérindiens Pomos de Californie (États-Unis) et les paysans de la Sardaigne (Italie) ont mis au point la même recette : ils ajoutent de l’argile à la farine de glands dans une proportion de 10 à 15 %[28] - [23]. Cuire les glands mélangés à l'argile réduit la toxicité des glands jusqu'à 77 %[23].
Autres utilisations

Des chercheurs en science des matériaux travaillent sur l'intégration d'argile comme « charges dites actives » dans des polymères.
Les plaquettes d'argiles peuvent produire un renforcement (déviation des fissures dans les polymères « choc », c'est-à-dire devant résister aux chocs). Par ailleurs, elles peuvent gêner la diffusion de gaz, et notamment de gaz combustibles issus de la pyrolyse lors d'un feu, améliorant ainsi la résistance au feu du polymère.
Certaines kaolinites très pures blanchissent la pâte à papier ; mais ce procédé est de moins en moins utilisé, au profit d'ajout de carbonate de calcium précipité (ou de Dioxyde de titane).
En raison de la qualité et de l'épaisseur de la couche d'argile située à Bure, à la limite de la Meuse et de la Haute-Marne, le laboratoire souterrain de l'Andra[29] étudie l'implantation d'un centre de stockage profond pour les déchets dits de haute activité (HA) et de moyenne activité à vie longue (MA-VL) à environ 500 mètres de profondeur. C'est une couche sédimentaire, compacte et imperméable, de couleur grise, d'âge callovo-oxfordien au sein du Jurassique ; elle date d'environ 160 Ma (millions d'années).
Risques de contamination
Des argiles fines (blanches et vertes, notamment), grâce à leur grand nombre de feuillets, forment une grande surface développée d’adsorption. Elles sont pour cette raison utilisées comme complément alimentaire, ou dans la composition (autour de 5,5 %) du chewing-gum[30], comme produit à appliquer sur la peau ou comme agents nettoyants ou adsorbants. Ces argiles, notamment si elles proviennent de sédiments ou de carrières polluées, peuvent contenir des contaminants, comme du plomb ou des dioxines, en quantité très significative. Un industriel français a dû abandonner l'argile verte surfine ultra-ventilée qu'il utilisait car sa teneur en plomb (11 à 26 mg/kg selon les analyses d'autocontrôle) dépassait systématiquement la teneur maximale règlementaire[31] de 3 mg de plomb par kg ainsi que pour les dioxines (4,4 à 8,7 ng TEQ OMS98/kg de produit à 12 % d'humidité). Selon Förstner et Wittmann (1979), le plomb est le métal qui a la plus forte capacité d’adsorption sur les argiles (en moyenne 18 mg/g[32]), maximale à pH 7 selon Eloussaief et Benzina (2010)[33]. Les sédiments argileux marins des grandes profondeurs en contiennent 80 mg/kg[32] et les argiles utilisées dans les chewing-gums de 11 à 26 ppm[34]. Des dioxines y ont aussi été trouvées ; les sols de France en contiennent de 0,02 à 1 pg TEQ OMS98/g (sol rural sec) et de 0,2 à 17 pg TEQ OMS98/g pour des sols secs urbains, et 20 à 60 pg TEQ OMS98/g sur sol sec en contexte industriel[34]. Les argiles ingrédients de chewing-gums en contiennent de 4,4 à 8,7 ng TEQ OMS98/kg ou pg TEQ OMS98/g, soit une teneur comparable à celle d'un sol urbain français[30].
Selon les modèles in vitro de digestion humaine, 4 à 68 % (selon le type de sol) du plomb adsorbé sur argile ingérée est bio-accessible[35] (l'ANSES estime que moins de 10 % du plomb de l'argile verte d'un chewing-gum est désorbé dans l'organisme du consommateur). Chez plusieurs espèces de mollusques comestibles testés par Amiard[36], ce taux variait de 19 à 52 %. Il y a peu de données sur la bio-accessibilté des dioxines fixées sur des argiles, mais il existe des données sur les PCB (dans ce cas la désorption lors de la digestion est de 30 à 40 %[35] - [37].
L’Anses recommande « de limiter autant que possible tout apport additionnel et intentionnel en plomb. En conséquence, l’Anses ne peut émettre un avis favorable quant à l’usage alimentaire de telles argiles »[30].
Histoire des argiles, savoirs, croyances et religions
L'argile de poterie était utilisée par la civilisation summéro-akadienne (les Sumériens de Mésopotamie). De petites boules d'argile étaient aplaties pour former un rectangle approximatif afin de pouvoir y inscrire de l'écriture cunéiforme. Les Sumériens utilisaient également des sortes de sceau-cylindre. Ces cylindres étaient gravés à l'intaille et lorsqu'on les faisait rouler en appuyant sur l'argile, ils laissaient une empreinte en relief.
La cuisson en durcissant stabilisait les signes et entravait toute falsification de réécriture partielle.
Histoire des sciences
La notion commune d'argile, aujourd'hui paradoxalement polysémique et très complexe, provient de la science conquérante ou vulgarisée au XIXe siècle. Dans les manuels de chimie, tel celui de Louis Troost, l'argile pure était présentée comme une matière type blanche, compacte, douce au toucher, plus ou moins difficilement fusible, avec quelques propriétés emblématiques, dont la plasticité, la contraction et le retrait dimensionnel à la chaleur, l'avidité d'eau de cette matière après calcination et même de surcroît une composition chimique moyenne Al205.2 SiO2. H2O.
Une argile est en effet plus ou moins plastique car elle peut former après humidification superficielle ou mélangée avec l'eau une pâte liante, facile à pétrir, à façonner avec précision, à l'instar d'une véritable pâte à modeler pour enfants. Cette pâte, en se desséchant, se contracte et se fendille. L'argile chauffée subit un retrait dimensionnel, d'autant plus important qu'elle a été chauffée ou portée à une température élevée. Le grand céramiste Wedgwood a utilisé cette propriété de rétraction pour la construction d'un pyromètre. L'argile calcinée absorbe l'eau avec rapidité, les glycochimistes disent qu'elle happe la langue, c'est-à-dire qu'appliquée sur leur langue, cette matière desséchée s'empare de la salive qui l'humecte.
Cette approche essentialiste est antérieure à l'essor de la reconnaissance des multiples structures atomiques complexes dévoilé par l'usage des spectres et l'imagerie aux RX entraînant à son tour les progrès nécessaire dans l'analyse chimique. Il est logique que cette démarche unitaire qui tente de regrouper les multiples produits de la décomposition en milieu aqueux du feldspath ou de multiples roches à une dégradation argileuse plus ou moins partielle avec les gisements de kaolin ou terre à porcelaine, soit obsolète dans le monde scientifique actuelle. L'argile y est souvent soit oubliée soit considérée comme un nom générique ancien, soit un simple mot encore utilisé dans un registre familier ou argotique.
Cette approche imprécise qui marque encore l'enseignement élémentaire et provient surtout à sa base de l'observation scientifique des arts et métiers spécifiques à l'argile sur une longue durée n'est pourtant pas à oublier, car elle s'accompagne toujours d'une déclinaison en argiles ordinaires, où l'argile pure définie plus haut se retrouve avec des proportions variables de :
- divers oxydes ou hydroxydes de fer, de manganèse, etc. ou autres hydroxydes métalliques, pigments minéraux qui colorent la matière en jaune, vert, etc. ;
- la chaux et des alcalis ;
- la présence de matière calcaire dispersé et de sables.
Les scientifiques observateurs des métiers expliquent globalement les propriétés par ces mélanges et justifient les noms techniques ou traditionnels (argiles plastiques, argiles smectiques, argiles figulines, marnes ou limons) que les professionnels ou les artisans ou maîtres paysans emploient, avec des indications complémentaires de pureté ou de proportions, de propriétés des matières additives naturelles ou artificielles. Plus une argile technique contient de chaux ou d'oxydes de fer, plus sa fusibilité est grande.
Argiles plastiques
Ce sont les argiles ordinaires, relativement pures selon les critères chimiques du XIXe siècle, qui forment avec l'eau une pâte liante. Placées à la chaleur ou chauffées, elles acquièrent une dureté sans fondre ni s'écouler. Les argiles de Dreux, de Forges-les-Eaux ou de Montereau étaient souvent citées en exemple en France.
Elles servent communément aux fabriques de poteries, aux tuileries et aux briqueteries. Si ces argiles sont réfractaires à la cuisson, elles peuvent être employées pour fabriquer des briques réfractaires, des creusets, des dalles ou éléments de parois de fours… Les argiles réfractaires mélangées à la plombagine donnaient des pâtes réfractaires et résistantes pour les creusets de four à acier.
En réalité, aussi loin que remontent les historiens spécialistes des métiers et arts du feu, en particulier en poterie et en céramique, les pratiques connues font état de mélanges de deux ou plusieurs matières argileuses différentes provenant de diverses poches d'argiles parfois distantes de plus de 40 km dès l'époque antique, mélanges utilisés uniquement après des mises au point par test empirique et observation. Les diverses argiles faisaient l'objet de traitements parfois complexes, si les argiles de base ne convenaient pas directement :
- elles pouvaient être lavées de diverses façons, puis séchées ;
- elles sont parfois raffinées (sélection des fines) durant le lavage ou par soufflage ;
- elles pouvaient être broyées, voire re-broyées (pour accroître leur pouvoir collant) ;
- elles étaient parfois laissées pourrir pendant plus de deux années ;
- elles peuvent être stockées, étendues sur des plans de séchage et mise au repos à températures variées.
Cet art né de la manipulation, de l'observation et de la pratique complète et concrète du métier, du façonnage (test plastique à la main) à la sortie du four (test de cuisson, observation de surface type), a évolué suivant les époques et les contrées[n 5]. Les artisans les plus modestes anticipaient évidemment la tenue à la cuisson et la résistance de l'argile cuite en formulant leurs mélanges d'argiles, surtout s'il n'y avait qu'une cuisson pour garantir un aspect impeccable. En faïence et dans le champ des supports d'émaux, les propriétés thermo-mécaniques anticipées étaient moins exigeantes au niveau des surfaces pour les biscuits céramiques, car comme leur nom l'indique, ils sont cuits deux fois (bis), la seconde fois avec une couverte qui doit définir les caractéristiques de surface.
Argiles smectiques
Ce sont les argiles ordinaires, considérées alors comme plus impures que les argiles plastiques, qui ne forment avec l'eau qu'une pâte peu liante. Leur fusion est plus élevée. Les terres d'Issoudun dans l'Indre et de Villeneuve en Isère sont citées en exemple.
Elles servent traditionnellement de terres à foulons ou de terres dégraissantes.
Argiles figulines
Ces argiles ordinaires qui forment également une pâte peu liante avec l'eau sont extrêmement fusibles. L'explication proposée est celle déjà citée la présence non négligeable de chaux et d'oxydes de fer. Les Parisiens connaissaient les argiles de Vanves et de Vaugirard.
Elles sont employées pour garnir en couches imperméables le fond des bassins, pour la fabrication des poteries grossières et des terres cuites banales. Certaines améliorées sont la terre glaise des sculpteurs.
Marnes
Au sens ancien, déterminée logiquement de manière globalement imprécise par une multiplicité d'usages paysans, il s'agit d'un mélange, parfois naturellement rocheux, d'argile et de craie, voire de terres argileuses et de calcaires friables. Elles sont depuis l'époque gauloise valorisées en agriculture, pour l'amendement argileux, par exemple des champs trop sableux ou à complexe argilo-humique défectueux. L'opération se nomme encore marnage.
Limons
Cette terminologie paysanne ou biblique a été revue par les scientifiques, qui ont observé, dans leurs grandes éprouvettes en verre transparent remplies d'eau distillée, les limons les plus fins, qui une fois agités, restent indéfiniment en suspension. Les scientifiques, à l'instar des hommes de la mer observant les eaux boueuses des fleuves se mélanger aux eaux salées, ont remarqué que l'adjonction de sels par exemple de calcium ou de magnésium, avaient un effet d'agrégation catastrophique sur ces particules fines engendrant leur précipitation et la formation de sédiments. Il s'agit, par ces coagulations singulières, des premiers pas en chimie-physique des colloïdes.
Mythologies
Bien avant les religions monothéistes, les mythologies de certains peuples ont placé l'argile ou le limon au fondement de la vie. Prométhée crée les hommes avec l'argile du potier.
Calendrier républicain
- Dans le calendrier républicain, l’Argile était le nom attribué au 12e jour du mois de nivôse[38] - [39].
Religions

D'après les religions abrahamiques, les ancêtres de l'humanité (Ève et Adam) auraient été créés en argile par Dieu.
D'après la Bible, il s'agit de la terre en poussière :
« L'Éternel Dieu forma l'homme de la poussière de la terre, il souffla dans ses narines un souffle de vie et l'homme devint un être vivant. »
— Genèse 2:7
D'après le Coran :
« Nous avons certes créé l'homme d'un extrait d'argile, puis Nous en fîmes une goutte de sperme dans un reposoir solide. Ensuite, Nous avons fait du sperme une adhérence, et de l'adhérence Nous avons créé un embryon, puis, de cet embryon Nous avons créé des os et Nous avons revêtu les os de chair. Ensuite, Nous l'avons transformé en une tout autre création[40]. »
— (Sourate 23, Al-Muʾminūn)
Notes et références
Notes
- Le mot latin Argilla, argillae provient du grec άργιλος / árgilos, « argile de potier ». Le genre du mot latin ou français est féminin. Mais les prosateurs et les poètes l'ont mis parfois au masculin. Les adjectifs argileux, argilacé, argilifère marquent respectivement « ce qui contient de l'argile ou tient ses propriétés de l'argile », « ce qui a l'aspect de l'argile », « ce qui contient ou apporte de l'argile ».
- Le terme générique savant d'argile, en dehors de l’argile commune du potier ou parfois de l'argile nécessaire à la terre battue, n'est usité que par les hommes de l'art ou par les élites de ce monde très hiérarchisé. Aussi il existe une multitude de mots communs en usage, déclinée en une multitude de parlers vernaculaires : terre forte ou terrefort, terre lourde (à charrier ou labourer), terre froide (argileuse et humide), terres humides ou sèches, boueuses, sales, craquelées (selon la saison), terre à chênes (indicateur de végétation ou à installation de drainage), terre glaiseuse ou glaise, terre bieffeuse (venant de l'argile à silex, nommé bief), grou ou groie (terre plus ou moins argileuse avec pierrailles, parfois réservé à la vigne), arbue (argileuse et de moindre valeur en fin de finage), terre morte (vases incluant parfois gravier venues des cours d'eau ou encore formations argileuses facilement ravinées), etc. Les artisans distinguent la terre à pot ou argile à potier, la terre de pipe (argiles blanches et claires), la terre à pisé ou terre à construire, la terre à fouler (glaise onctueuse au toucher et dégraissante, à base de smectites), etc. Le mot latin lūtum correspond au mot gaulois bawa ou baua, les deux décrivant la boue, la fange, la matière salissante, etc. ou la texture argileuse fine.
- L'argile verte est à distinguer des argiles blanches, à propriétés réfractaires comme le kaolin, qui ne devient la matière première de la porcelaine qu'au XVIIIe siècle.
- On exclut ici les zéolithes car leurs structures d'assemblage restent tridimensionnelles quelles que soient leurs tailles et leurs propriétés.
- Y compris les plus lointaines. Lire les liens internes.
Références
- (en) Bruce Velde et Alain Meunier, The Origin of Clay Minerals in Soils and Weathered Rocks, Springer, (ISBN 3540756337).
- « Identification macroscopique des minéraux et roches », sur academia.edu.
- L'illite se forme en zone tempérée, la kaolinite dans les milieux tropicaux. Il existe des argiles d'altération et des argiles résiduelles.
- (en) Faïza Bergaya, B.K.G. Theng, G. Lagaly, Handbook of Clay Science, Elsevier, , p. 40-43.
- Isabelle Cojan et Maurice Renard, Sédimentologie, Dunod, , p. 76-79.
- Philippe Duchafour, Précis de pédologie, Masson & Cie, , p. 13 et 33.
- Daniel Caminade, Principes d’implantation et d’aménagement des ports maritimes, éditions Techniques Ingénieur, , p. 10.
- (fr+en) Alain Meunier, Argiles, Springer, , 472 p. (ISBN 978-3-540-21667-4).
- (en) Rossman F. Giese et Carel J. Van Oss, Colloid and surface properties clays and related minerals, Dekker, , 312 p. (ISBN 978-0-8247-9527-6).
- Hélène Balfet, « La céramique comme document archéologique », Bulletin de la Société préhistorique française, vol. 63, no 2, , p. 291.
- http://www.clays.org/journal/archive/volume%206/6-1-110.pdfPDF.
- [Bischof 1906] Carl Bischof, Les Argiles réfractaires, gisements, composition, examen, traitement et emploi au point de vue des produits réfractaires en général, Paris, éd. H. Dunod et E. Pinat, , sur ateliercarthuses.fr (lire en ligne), p. 85.
- Bischof 1906, p. 86.
- L'argile qui guérit - Mémento de médecine naturelle, Raymond Dextreit, (ISBN 978-2-7155-0067-9).
- Plus de 120 Témoignages sur l'Argile qui Guérit, Raymond Dextreit, (ISBN 978-2-7155-0166-9).
- Jade Allègre, Les silicates d’alumine (argiles) en thérapeutique : Une pratique coutumière ancienne relayée dans la médecine moderne (thèse de médecine), (lire en ligne).
- « Votre santé no 47 - / usage interne argile » [PDF].
- « Terrafor Ventre plat - Nouveaux produits », Le Moniteur des pharmacies (en ligne), (lire en ligne, consulté le ).
- « Décision du 16/08/2016 portant suspension de fabrication, de mise sur le marché, de distribution, d'exportation et d'utilisation des dispositifs médicaux TERRAFOR et DEFI LIGNE, fabriqués et mis sur le marché par le Laboratoire CLAYTONE-TERRAFOR ainsi que retrait de ces produits », ANSM, (consulté le ).
- Jean-Pierre Adam, La construction romaine matériaux et techniques, Picard, , p. 61
- Cf. les semis directs sous couvert végétal C.Bourguignon et INRA.
- (en) Timothy Johns et Martin Duquette, « Traditional detoxification of acorn bread with clay », Ecology of Food and Nutrition, vol. 25, no 3, , p. 221–228 (ISSN 0367-0244, DOI 10.1080/03670244.1991.9991170, lire en ligne, consulté le ).
- (en) T. Johns et M. Duquette, « Detoxification and mineral supplementation as functions of geophagy », The American Journal of Clinical Nutrition, vol. 53, no 2, , p. 448–456 (ISSN 0002-9165, PMID 1989412, lire en ligne, consulté le ) :
« The Pomo Indians in California and natives of Sardinia used similar methods to make acorn bread (2, 2 1). The Pomo mixed clay with the ground meal of bitter acorns (principally Quercus lobata) in a ratio of 1 : 10-1 :20 by volume. Water was added to make a dough, and small loaves were baked gently in an earth oven for 12 h. Breads were made without clay from nonbitter acorns or from meal from which tannic acid was removed through a leaching process. (…) Recipes used by the Pomo called for clay: acorn ratios of 1: 10-1:20 by volume (“- 1 :5- 1:10 by weight). (…) Cooking acorns with clay reduces the toxicity of acorns caused by protein precipitation by as much as 77% . »
- Voyages en Corse, à l'Ile d'Elbe, et en Sardaigne par M. Valery, Hauman, (lire en ligne).
- (en) « The Ancient Andean Tradition of Eating Clay May Have Helped To Protect Health », sur NPR.org (consulté le ).
- Tony Dunnell, « Pourquoi les paysans de l’Altiplano mangent de l’argile avec leurs patates », sur vice.com, (consulté le ).
- (en) D D Lakudzala et J J Khonje, « Nutritive potential of some ‘edible’ soils in Blantyre city, Malawi », Malawi Medical Journal (en) : The Journal of Medical Association of Malawi, vol. 23, no 2, , p. 38–42 (ISSN 1995-7262, PMID 23074810, PMCID 3627697, lire en ligne, consulté le ).
- Jade Allegre, « LES SILICATES D’ALUMINE (ARGILES) EN THERAPEUTIQUE » [PDF].
- site de l'ANDRA.
- ANSES (2012) AVIS de l’Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail relatif aux risques sanitaires liés à la consommation de chewing-gums dans lesquels de l'argile verte contenant des teneurs élevées en plomb et en dioxines a été mise en œuvre (seul usage connu pour l'utilisation d'argile verte, outre celui réglementé dans le cadre des compléments alimentaires[PDF]) ; Saisine no 2011-SA-0133.
- règlement (CE) no 1881/2006 portant fixation de teneurs maximales pour certains contaminants dans les denrées alimentaires.
- Förstner U, Wittmann GT (1979). Metal Pollution in the Aquatic Environment. Springer-Verlag, Berlin.
- (en) Eloussaief M & Benzina M (2010). Efficiency of natural and acid-activated clays in the removal of Pb(II) from aqueous solutions. J Hazard Mat (de), 178:753–757.
- INSERM (2000) Dioxines dans l’environnement, quels risques pour la santé ? Expertise collective.
- (en) Oomen AG, Sips AJ, Groten JP, Sijm DT, Tolls J (2000). Mobilization of PCBs and Lindane from Soil during in Vitro Digestion and Their Distribution among Bile Salt Micelles and Proteins of Human Digestive Fluid and the Soil. Environ Sci Technol, 34 : 297-303.
- (en) Amiard JC, Amiard-Triquet C, Charbonnier L, Mesnil A , Rainbow PS, Wang WX (2008). Bioaccessibility of essential and non-essential metals in commercial sh ellfish from Western Europe and Asia. Food Chem. Toxicol., 46 , 2010-2022.
- (en) Hack A, Selenka F (1996). Mobilization of PAH and PCB fro m contaminated soil using a digestive tract model ; Toxicol Lett (en), 88 : 199-210.
- Ph. Fr. Na. Fabre d'Églantine, Rapport fait à la Convention nationale dans la séance du 3 du second mois de la seconde année de la République Française, p. 22.
- « https://web.archive.org/web/20150204234719/http://www.louisg.net/calendrier_republicain.htm »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?)
- Sourate 23, Al-Muʾminūn (les Croyants).
Voir aussi
Bibliographie
- [Farges 2013] François Farges, À la découverte des minéraux et pierres précieuses (collection dirigée par Alain Foucault sous l'égide du muséum d'histoire naturelle), éd. Dunod, coll. « l'Amateur de nature », (réimpr. 2015 (complétée)), 208 p. (ISBN 978-2-10-072277-8), p. 80-81.
- [Folk 1954] (en) Robert L. Folk, « The distinction between grain size and mineral composition in sedimentary-rock nomenclature », Journal of Geology, vol. 62, no 4, , p. 344-359 (ISSN 0022-1376, DOI 10.1086/626171, résumé).
- [Folk 1966] (en) Robert L. Folk, « A review of grain-size parameters », Sedimentology, vol. 6, no 2, , p. 73-93 (résumé).
- [Folk & Ward 1957] (en) Robert L. Folk et William C. Ward, « Brazos River bar : a study in the significance of grain size parameters », Journal of sedimentary Petrology, vol. 27, no 1, , p. 3-26 (lire en ligne [PDF] sur aqqua.uqam.ca, consulté en ).
- [Foucault & Raoult 1988] Alain Foucault et Jean-François Raoult, Dictionnaire de géologie. Géophysique, Préhistoire, paléontologie, pétrographie, minéralogie, Paris, Dunod, (réimpr. 1984, 1988, 1995, 2000, 2005), 7e éd. (1re éd. 1980), 388 p. (ISBN 978-2-10-054778-4, BNF 42257692), p. 28-29.
- [Lacroix 1977] Alfred Lacroix, Minéralogie de la France et de ses anciens territoires d'Outremer, description physique et chimique des minéraux, étude des conditions géologiques et de leurs gisements, vol. 1 (6 vol. ; réédition de l'ouvrage en un volume publié en 1892), Paris, Librairie du Muséum, , p. 472-478 (argile) et 479 (compléments sur les argiles plastiques et réfractaires).
- [Millot 1964] Georges Millot, Géologie des Argiles, altérations, sédimentologie, géochimie, Paris, Masson, , 499 p. (résumé).
- [Poirot 2004] Jean-Paul Poirot, Mineralia, Minéraux et pierres précieuses du monde, éd. Artemis, , 224 p. (présentation en ligne), p. 264-265 (minéraux argileux).
- [Wenworth 1992] (en) Chester K. Wenworth, « A scale of grade and class terms for classioc sediments », Journal of Geology, vol. 30, no 5, , p. 377-392 (lire en ligne [PDF] sur journals.uchicago.edu, consulté en ).
- [Wilkins 2010] (en) Anne D. Wilkins, « Terminology and the classification of fine grained sedimentary rocks - is there a difference between a claystone, a mudstone and a shale? », project « Paleocene of the Central North Sea: regional mapping from dense hydrocarbon industry datasets », (lire en ligne [sur researchgate.net], consulté en ).
- articles de l’Encyclopædia Universalis : « Argiles et minéraux argileux », « Poteries », « Ciments », « Céramiques » et « Céramiques industrielles ».
Articles connexes
- Adobe (brique)
- Akadama
- Anmoor
- Archéomagnétisme
- Argile blanche
- Argile calcaire
- Argiles de Kimmeridge
- Argile de Londres
- Argile du Gault
- Argile à blocaux ou boulder clay
- Argile expansée
- Argiles grésantes
- argile lacustre
- argile à silex
- argiles rouges tapissant les fonds océaniques
- Argile de Yixing
- Argilite
- Ball clay ou terre de pipe
- Bentonite
- Boulette de graines
- Capacité d’échange cationique
- Chamotte
- Complexe argilo-humique
- Derle
- Dickite
- Doline (argile karstique)
- Engobe
- Faïence
- Formation marno-calcaire
- Géophagie
- Hagi-yaki
- Hakuji
- Halloysite
- Hectorite
- Illite
- Kaolinite,
- Kaolin, terre à porcelaine
- Limon (roche)
- Loam
- Mare de boue
- Marne
- Montmorillonite
- Mudstone
- Nacrite
- Ocre
- Pansement gastrique
- Pédogenèse (géologie)
- Pernette
- Phyllosien (argile sur Mars)
- Poterie
- Porcelaine
- Sol argileux constructible
- Sol argilo-calcaire
- Terre-argile
- terre à pipe, argile plastique fine et blanche
- Terre battue (bâtiment)
- Terre cuite
- Terre-papier
- Terra rossa
- Țest
- Tomette
- Torchis
- Tuilerie
- Vases argileuses, vases littorales
- Vertisol
- Pontage des argiles
Liens externes
- « Argile », définition, sur cnrtl.fr (consulté en ).
- « Les argiles, genèse et utilisations », cours d'initiation, sur normalesup.org (consulté en ).
- « Cours en ligne de géologie des argiles », Université de Liège (consulté en ).
- « Préparation et collecte de l'argile »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?), sur paleosite.free.fr (consulté en ).
- « Retrait-gonflement des argiles », dossier thématique, avec carte de France des sols argileux dans la section « Exposition du territoire au phénomène », sur georisques.gouv.fr (consulté en ).



