Altération des silicates
L’altération des silicates, qui représentent 97 % des roches de la croûte terrestre, est un phénomène majeur de la géologie. Il est à l’origine de la formation :
- des sédiments détritiques : argiles, silts, sables…
- et, à la suite de la mise en solution dans l’eau des ions sodium, potassium, calcium, magnésium, fer ferreux, et partiellement de la silice, à l'origine d’une grande partie des roches carbonatées, évaporitiques et siliceuses.
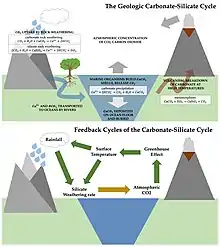
L’altération des silicates est un ensemble de réactions grandes consommatrices de CO2 (puits ou « pompe à CO2 ») ce qui en fait un processus important pour comprendre le cycle du carbone et l’évolution des climats du passé (paléoclimats) et actuels.
Processus de dissolution
C’est un processus qui se fait essentiellement en phase aqueuse[1] - [2]. Après son passage au travers des sols superficiels, l’eau chargée de dioxyde de carbone (CO2) et d’acides organiques, comme les acide humiques et fulviques, s'acidifie et attaque les silicates au niveau du sol et du sous-sol, en particulier aux endroits où l’eau stagne (contact sol/sous-sol, fissures du sous-sol…).
Par altération, les ions des minéraux silicatés (Na+, K+, Ca2+, Mg2+, Fe2+…) sont en partie remplacés par des ions H+. Les ions non remplacés (aluminium, fer ferrique et une partie de la silice) recristallisent en place.
Les mesures en laboratoire du potentiel d'altération des cristaux concordent bien avec la série de dissolution de Goldich (en) qui indique que les minéraux les derniers formés par différenciation magmatique (série de réactions de Bowen) sont les plus stables vis-à-vis des agents de l'altération météorique[3]. Ces résultats expérimentaux obtenus en laboratoire ne reflètent pas complètement les processus de dissolution survenant dans la nature qui sont dix fois plus rapides en moyenne, notamment en raison de l'altération microbienne[4].
La vitesse moyenne d'altération chimique des silicates est de l'ordre de 5 à 100 millimètres par millénaire (bien inférieure à la vitesse d'altération mécanique qui peut atteindre plusieurs mm par an)[5].
| Minéral | Formule chimique | Durée de vie (en années) |
|---|---|---|
| Anorthite (Ca) | CaAl2Si2O8 | 112 |
| Néphéline | Na3KAl4Si4O16 | 211 |
| Diopside | CaMgSi2O6 | 6 800 |
| Enstatite | Mg2Si2O6 | 8 800 |
| Albite (Na) | NaAlSi3O8 | 80 000 |
| Feldspath potassique | KAlSi3O8 | 520 000 |
| Forstérite | Mg2SiO4 | 600 000 |
| Muscovite | KAl2(AlSi3O10)(OH,F)2 | 2 700 000 |
| Quartz | SiO2 | 34 000 000 |
L’altération des silicates comme puits ou « pompe à CO2 »
En prenant l’exemple d'un minéral silicaté de la croûte terrestre, appartenant à la famille des feldspaths, le plagioclase, et en considérant le pôle calcique des plagioclases, l’anorthite (CaAl2Si2O8), le bilan de son altération est le suivant[7] :
- 2 CaAl2Si2O8 + 4 CO2 + 6 H2O → 2 Ca2+ + 4 HCO3− + Si4O10Al4(OH)8.
L’anorthite en consommant de l’eau et du CO2 dissous dans l’eau libère des ions calcium, des ions bicarbonates et produit la plus simple des argiles, la kaolinite : Si4O10Al4(OH)8.
Il faut souligner que cette consommation de 4 CO2 pour libérer 2 Ca2+ est le double de celle nécessaire à la dissolution des carbonates :
- CaCO3 + CO2 + H2O → Ca2+ + 2 HCO3−,
où un seul CO2 est nécessaire à la dissolution d’un ion Ca2+[7]. De même, mais dans le sens inverse, la précipitation des carbonates, processus émetteur de dioxyde de carbone, ne produit qu’un CO2 à partir d’un ion Ca2+ :
- Ca2+ + 2 HCO3− → CaCO3 + CO2 + H2O.
C’est cette forte consommation de CO2 qui confère à l’altération des silicates un rôle majeur dans l’évolution géologique du climat.
Impact sur l'acidité du sol
L'altération des roches acides libère un excès d'acide silicique qui produit des ions hydronium H+ contribuant en grande partie à l'acidité du sol[8] - [9]
L'autre facteur principal rendant compte de la formation de sols acides est l'altération des aluminosilicates (notamment les feldspaths et les micas des roches siliceuses, les minéraux argileux et phylliteux) qui libère des ions Al3+ dont l'hydrolyse conduit à la formation d'hydroxyde d'aluminium. Cette réaction fixe des ions hydroxyles et produit également des ions H+, selon la réaction[5] :
- Al3+ + 3(H2O) → Al(OH)3 + 3H+
Impact sur les phases de réchauffement global
À l’échelle des temps géologiques les périodes chaudes sont favorables à cette altération donc à la capture, à terme, de grandes quantités de CO2. De tels phénomènes ont été analysés lors des événements hyperthermiques du Paléogène, comme le maximum thermique du passage Paléocène-Eocène (PETM) il y a environ 56 millions d’années. La durée de ces processus de piégeage du CO2 émis lors des réchauffements rapides de la Terre est de l’ordre d’au moins 100 000 ans (PETM)[10] - [11].
Notes et références
- Philippe Amiotte Suchet & Jean-Luc Probst, « Flux de CO2 atmosphérique consommé par altération chimique continentale : Influence de la nature de la roche », C. R. Acad. Sci., Ser. II, vol. 317, 1993, p. 615–622
- (en) Philippe Amiotte Suchet, Jean-Luc Probst, Wolfgang Ludwig, « Worldwide distribution of continental rock lithology: Implications for the atmospheric/soil CO2 uptake by continental weathering and alkalinity river transport to the oceans », DOI: 10.1029/2002GB001891, http://onlinelibrary.wiley.com/doi/10.1029/2002GB001891/full
- (en) C.A.J. Appelo, Dieke Postma, Geochemistry, groundwater and pollution, CRC Press, (lire en ligne), p. 395.
- (en) Brantley, S.L. (2008). Kinetics of Mineral Dissolution, In Kinetics of Water-Rock Interaction S.L. Brantley, J.D. Kubicki, & A.F. White (eds.), pp. 151-210, Springer, NewYork, Chapter 5.
- (en) Yousif K Kharaka, Ann S Maest, Water-rock Interaction, A.A. Balkema, , p. 253-271.
- Calcul selon les estimations des taux de dissolution expérimentaux. Cf. (en) Antonio C. Lasaga, « Chemical kinetics of water‐rock interactions », Journal of Geophysical Research, vol. 89, no B6, , p. 4009-4025 (DOI 10.1029/JB089iB06p04009).
- http://planet-terre.ens-lyon.fr/image-de-la-semaine/Img145-2006-01-09.xml
- (en) R. S. Khoiyangbam, Introduction to Environmental Sciences, Energy and Resources Institute, , p. 136-137.
- (en) Thounaojam Thomas Meetei, Yumnam Bijilaxmi Devi, Thounaojam Thorny Chanu, Hrishikesh Upadhyay, « Acid soil: Unwanted but unavoidable consequences of natural processes », Journal of Emerging Technologies and Innovative Research, vol. 5, no 12, , p. 1088.
- (en) Zachos, J., Rohl, U., Schellenberg, S., Sluijs, A., Hodell, D., Kelly, D., Thomas, E., Nicolo, M., Raffi, I., Lourens, L., et al., « Rapid acidification of the ocean during the Paleocene-Eocene thermal maximum », Science, vol. 308, 2005, p. 1611, http://www.whoi.edu/cms/files/zachos05sci_133124.pdf
- (en) Nunes, F. and Norris, R., « Abrupt reversal in ocean overturning during the Palaeocene/Eocene warm period », Nature, vol. 439, 2006, p. 60–63, http://www.nature.com/nature/journal/v439/n7072/abs/nature04386.html