Brucite
La brucite est le corps chimique minéral naturel composé ionique des cations magnésium Mg2+ et des anions hydroxyles OH−, soit l'hydroxyde de magnésium de formule chimique Mg(OH)2.
Catégorie IV : oxydes et hydroxydes[1] | |

| |
| Général | |
|---|---|
| Numéro CAS | |
| Classe de Strunz | 04.FE.05
|
| Classe de Dana | 06.02.01.01
|
| Formule chimique | Mg(OH)2 |
| Identification | |
| Masse formulaire[2] | 58,3197 ± 0,0013 uma H 3,46 %, Mg 41,68 %, O 54,87 %, |
| Couleur | blanc, vert pâle, vert clair, bleu, gris à bleuâtre, mais aussi jaune ambré à rougeâtre pour les variétés manganésifères |
| Classe cristalline et groupe d'espace | Hexagonal scalénoédrique 32/m groupe d'espace P3m1 |
| Système cristallin | trigonal |
| Réseau de Bravais | réseau de Bravais hexagonal, a = 3,147 Å, c = 4,769 Å, Z = 1; V = 40,90 ų (a = 3,15 Å, c = 4,74 Å) |
| Clivage | parfait sur {0001} |
| Cassure | irrégulière (se coupe au couteau) ou esquilleuse |
| Habitus | cristaux lamellaires pseudo-hexagonaux, cristaux tabulaires grands ou larges soit en lamelles flexibles non élastiques, élastiques soit en fibres fines, cluster, agrégats en plaques feuilletées ou fibreuses, masses rarement granulaires, masses feuilletées ou fibreuses dans les filons hydrothermaux de basses températures, les roches serpentine ou schistes dits chloriteux, roche massive foliacée le plus souvent fibreuse, plus rarement granuleuse ou granulaire. |
| Échelle de Mohs | 2,5 parfois 3 ou même 2 |
| Trait | blanc |
| Éclat | cireux, vitreux, nacrée (seulement sur face clivée), soyeux (fibres)... |
| Propriétés optiques | |
| Indice de réfraction | nω = 1,56–1,59 nε = 1,58–1,60 (par exemple, nω = 1,561 et nε = 1,581) |
| Biréfringence | Uniaxial (+) δ = 0,02 |
| Transparence | transparent à translucide, avec éclat perlé sur face du clivage, plus souvent translucide |
| Propriétés chimiques | |
| Densité | 2,39 (en général inférieur à 2,4) |
| Fusibilité | infusible |
| Solubilité | soluble dans les acides diluées à froid |
| Comportement chimique | pyroélectrique |
| Unités du SI & CNTP, sauf indication contraire. | |

Minéral tendre et léger, alcali naturel rare, dédié en 1824 par Francois Sulpice Beudant au minéralogiste et physicien américain Archibald Bruce, il est pourtant un produit courant de l'altération de la périclase dans le marbre ; un filon hydrothermal de basse température dans le calcaire métamorphique et le schiste à chlorite ; elle se forme au cours du processus de transformation de la dunite en serpentinite. La brucite apparaît souvent associée à la serpentine, la calcite, l'aragonite, à divers carbonates de magnésium comme la dolomite, la magnésite, l'hydromagnésite ou l'artinite, mais aussi le talc et le chrysotile.
Parmi les gisements principaux figurent la mine de chrome dite Wood's Chrome Mine et la carrière de Cedar Hill dans le comté de Lancaster (Pennsylvanie) (États-Unis).
Inventaire minéralogique, topotype supposé, variétés rocheuses et synonymes
Elle doit son nom au minéralogiste américain Archibald Bruce (1777-1818), fondateur et éditeur de l' American Mineralogical Journal en 1810[3]. Ce dernier l'avait observé comme une variété de magnésite ou d'hydromagnésite, dans la roche serpentine à Castle Point, Hoboken, Hudson dans l'état américain du New-Jersey.
La première description connue en minéralogie de l'espèce brucite date de l'année 1824, elle est réalisée par le minéralogiste français Francois Sulpice Beudant[4]. Elle se présente sous forme de fibres ou de lames de clivage d'indice de direction [1010], ou parfois [1120].
Une forme dite amianthoïde de brucite porte le nom de « némalite »[5]. La némalite est une variété blanche et fibreuse longue, avec des fibres monocristallines pouvant atteindre plus de deux mètres de longueur. La némalite se trouve dans les plans de fractures à glissement de péridotites serpentinisées, riche en amiante ou asbeste.
La brucite se nommait ou se nomme encore parfois hydrophyllite, shépardite, magnésine, magnésite ou texalite.
Caractéristiques physico-chimiques
Il s'agit d'un matériau réfractaire, utilisable pour le revêtement des fours à céramique. Sa poudre est irritante et caustique.
Critères de détermination
Il est possible de la reconnaître in situ par son habitus cristallin caractéristique, l'éclat perlé sur sa surface de clivage, son absence de texture savonneuse ou graisseuse au toucher et surtout ses longs cristaux floconneux ou ses fibres flexibles mais sans élasticité.
Propriétés physico-chimiques : solubilité, stabilité thermique
La brucite est un minéral tendre et fragile : elle engendre une poussière blanche. Elle est facilement soluble dans les acides dilués à froid sans effervescence.
Elle est très légèrement soluble dans l'eau. Une solution saturée au contact de poudres fines atteint un ph voisin de 10.
Elle est également soluble dans les sels d'ammonium.
La brucite n'est pas fluorescente. Elle a des propriétés pyroélectriques. La poudre est thermiquement stable, ininflammable, même à haute température où elle se transforme en périclase.
Composition chimique
La substitution du cation Mg2+ par Mn2+ est possible sans changement de structure. Elle explique les variétés manganésifères qui prennent une coloration rouge à jaune, voire jaune miel à brun rouge à l'état plus ou moins altérées.
Cristallochimie
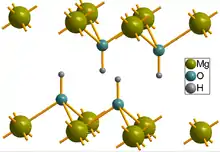
La brucite se présente en cristaux lamellaires pseudo-hexagonaux. Les cristaux fins sont transparents. Les cristaux tabulaires très aplatis possèdent très rarement une géométrie finale rhomboédrique. Elle est le plus souvent en masse feuilletée ou fibreuse. Son habitus est rarement granulaire.
Ce minéral est formé de couches régulièrement alternées de cations Mg2+ puis d'anions hydroxyles, le cation ayant une coordination octaédrique. Les octaèdres sont associés par leurs côtés latéraux. Les plaques de brucite ainsi agencées n'ont que des liaisons faibles entre elles. Cette structure explique le clivage facile sur ce plan basal.
C'est l'hydroxyde de magnésium, structure brucite, qui constitue en totalité ou en partie, la microstructure des feuillets de la plupart des minéraux argileux, en particulier leur couche octaédrique caractéristique neutre. Ces couches de brucite apparaissent entre les strates de silicates dans les deux groupes majeurs d'argiles que sont les chlorites et les montmorillonites ou smectites.
Cristallographie
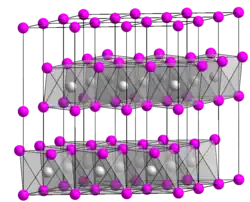
La brucite, minéral hydroxyde à structure en couches, cristallise de manière trigonale en appartenant au groupe d'espace P3m1. Sa maille est assimilée au réseau hexagonal.
D'un point de cristallochimique, elle peut se rapprocher des analogues de la portlandite Ca(OH)2 comme l'amakinite (Fe,Mg)(OH)2, l'ashoverite Zn(OH)2, la paraotwayite Ni(OH)2-x(SO4,CO3)0.5x, de la pyrochroïte Mn(OH)2, de la spertiniite Cu(OH)2, de la sweetite Zn(OH)2, de la théophrastite Ni(OH)2 et de la wülfingite Zn(OH)2.
Toutefois, les empilements d'octaèdres formés par les ions hydroxyles reliés bords à bords la placent dans la classification de Strunz parmi le groupe de la brucite, avec l'amakinite, la portlandite, la pyrochroïte et la théophrastite et la fougerite (Fe,Mg)6Fe2(OH)18•4(H2O).
Seul le dernier membre de ce groupe ne correspond pas à la formule type du cristal ionique M2+(OH−)2. C'est pourquoi elle ne figure dans le rassemblement de la brucite selon Dana.
Gîtes et gisements
Il s'agit d'un minéral métamorphique ou d'un produit de désagrégation, d'altération hydrothermale de minéraux complexes par des acides minéraux. Les minéraux hydroxydes, généralement moins denses et plus tendres, se forment à basses températures.
Gîtologie et minéraux associés
La brucite entre ainsi dans la composition des roches serpentines de basse température, de schistes chloriteux, de talcschistes, de phyllites et d'hydromagnésite.
Elle est aussi typique des talcs et des marbres dolomiteux, traversés par des filons hydrothermaux de haute et de basse température.
Le métamorphisme de contact des dolomies peut dans certaines conditions produire de l'oxyde de magnésium ou périclase, qui s'hydrate ensuite en hydroxyde de magnésium ou brucite lors de la phase finale descendante en température en présence d'eau.
Elle est présente dans les fissures des roches carbonatées parcourues par des eaux minérales chaudes, ainsi que dans les dépôts de certaines solutions minérales chaudes suffisamment acides. Elle apparaît rarement en terrain alcalin.
Comme tous les minéraux hydroxydes, elle peut être considérée comme un minéral d'altération à basses températures géologiques.
Elle figure parmi les éjectas volcaniques, par exemple les projectiles dolomitiques du Vésuve.
Association minérale : calcite, aragonite, dolomite, magnésite, hydromagnésite, talc, artinite, chrysotile...mais aussi périclase, wollastonite, néphéline, chromite
Gisements producteurs ou occurrences de spécimens remarquables
- Afrique du Sud
- mine N'Chwanning, Kalahari Manganese Field, Nord désertique de la Province du Cap.
- Autriche
- Canada
- Timmins, Ontario (brucite fibreuse)
- Brucite associée à l'asbeste, Thetford mine ou mines Aesbestos, Wakefield and Black Lake (lac noir), Québec
- calcaire cristallin de Crestmore, Californie
- mines de Gabbs, Nevada
- association avec des minéraux carbonates, carrière de Tilly-Foster, état de New-York
- brucite lamellaire, Brewster, NY
- association à l'hydromagnésite, Lancaster, comté de Berks, Pennsylvanie
- Wood's Mine, Texas
- Grande-Bretagne
- Unst, île Shetland
- Angleterre
- France
- marbres cipolins d'Arignac, Ariège
- Italie
- brucite blanche associée à l'amiante à Aoste dans le Val d'Aoste
- brucite blanche de La Spezia en filonnet
- brucite bleue du Val d'Astico et Valle Serra
- Russie
- mine de Sverdlovsk, Oural
- mine d'amiante de Bazhenoj ou Bajenov, Sibérie occidentale
- Suède
- Filipstad, dans le Nordmark, Jakobsberg
- Turquie

Utilisation industrielle
Il s'agit d'abord d'une matière réfractaire magnésienne.
La brucite Mg(OH)2 est utilisée comme retardateur de flamme parce qu'elle se décompose en relâchant de l'eau à instar de l'hydroxyde d'aluminium ou des mélanges de huntite et d'hydromagnésite[6] - [7].
La brucite constitue également une source de sels de magnésium, et de magnésium métal, non négligeable, pour l'industrie chimique mais aussi les services médicaux. Sous forme de poudre fine, d'une granulométrie inférieure à 10 μm facilement obtenue par les broyeurs modernes ou encore sous forme de suspension fine liquide dans l'eau, elle sert comme complément ou engrais magnésien, voir d'additifs techniques pour la fabrication d'acier et l'industrie céramique. On l'emploie aussi pour faciliter la production d'éthanol et de struvite, le traitement des eaux, l’équarrissage des animaux. La production industrielle est importante en Chine, en Russie, mais aussi en Amérique du Nord.
La brucite n'est pas réellement un minéral de collection recherché. Son intérêt est scientifique et surtout industriel.
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Brucite » (voir la liste des auteurs).
- La classification des minéraux choisie est celle de Strunz, à l'exception des polymorphes de la silice, qui sont classés parmi les silicates.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) « Archibald Bruce », The Mineralogical Record (consulté le ).
- François Sulpice Beudant, Traité élémentaire de minéralogie, Verdière, Libraire, Paris, 1824, p. 838 (curieusement, « brucite » n’apparaît que dans la table des matières)
- Th. Nuttall (1821), American Journal of Science: 4: 18.
- (en) L. A. Hollingberry et T. R. Hull, « The Thermal Decomposition of Huntite and Hydromagnesite - A Review », Thermochimica Acta, , p. 1–11 (lire en ligne)
- (en) L.A. Hollingberry, « The Fire Retardant Behaviour of Huntite and Hydromagnesite - A Review », Polymer Degradation and Stability, vol. 95, no 12, (lire en ligne)
Voir aussi
Bibliographie
- Ronald L. Bonewitz, Margareth Carruthers, Richard Efthim, Roches et minéraux du monde, Delachaux et Niestlé, 2005, 360 pages (traduction de l'ouvrage anglo-saxon, publié par Dorling Kindersley Limited, London, 2005), en particulier p. 168. (ISBN 2-603-01337-8)
- Henri-Jean Schubnel, avec Jean-François Pollin, Jacques Skrok, Larousse des Minéraux, sous la coordination de Gérard Germain, Éditions Larousse, Paris, 1981, 364 p. (ISBN 2-03-518201-8). entrée Brucite' p. 97.