Pontage des argiles
Le pontage des argiles consiste à utiliser une argile à feuillets (silicate lamellaire) comme réseau hôte et à y intercaler, entre les feuillets, par échange cationique, des espèces polymériques organiques et/ou minérales de taille importante, pour obtenir des matériaux plus microporeux et dotés d'un grand espacement interfoliaire. La rigidité du matériau est obtenue par calcination de ces espèces en piliers fixes.
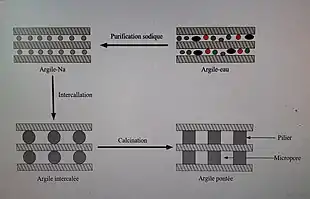
Le pontage d'argiles a amélioré certains matériaux destinés à adsorber des polluants solubilisés dans un liquide, et il intéresse plus largement la chimie verte qui recherche des processus catalytiques moins polluants[1] - [2].
Historique
Les premiers travaux sur la synthèse et l’étude des propriétés texturales des argiles pontées inorganiques ont été réalisés de 1960 à 1980[3] - [4] - [5] - [6] - [7].
Ils ont montré que les argiles pontées ont une plus grande capacité d’adsorption et une meilleure stabilité thermique que les argiles naturelles.
Les argiles pontées ont alors commencé à être très utilisées dans la dépollution des eaux contaminées par des métaux lourds (cadmium par exemple)[8] ou métalloïdes toxiques certains micropolluants tels que les composés phénoliques, les pesticides et les colorants. Au regard des résultats, des chercheurs se sont penchées sur les méthodes de synthèse et de caractérisation texturale des argiles pontées. Les études des modifications de l'argile naturelle montrent que le pontage est meilleur avec des argiles préalablement modifiées soit par activation acide ou par remplacement de leurs cations interfoliaires par du sodium ou du calcium (Argile calcique ou homosodique)[9]. Différents procédés ont été développées, faisant classer les argiles pontées en trois grandes catégories :
- complexes organo-argileux ;
- complexes inorgano-argileux ;
- complexes organo-inorgano-argileux.
Purification homosodique
Le prétraitement de l’argile brute par purification homosodique permet de détruire la matière organique qui se trouvait à sa surface, et de lessiver les cations qui étaient présent à sa surface, via de l’acide chlorhydrique dilué. Il est alors facile de remplacer ceux de l’espace interfolaire par du sodium. Il est démontré que la nature du cation situé dans l’espace interfoliaire influe sur le rendement du pontage de l’argile ; le sodium permet un excellent rendement, c’est pourquoi on remplace tous les cations de l’espace interfoliaire par celui-ci[10] - [11]. En général, les molécules organiques sont détruites par de l’eau oxygénée (diluée à 6 %), puis l’argile est recueillie par filtration sous vide, lavé jusqu’à ce que les eaux de lavage ne contiennent plus de chlorures (pas d’apparition de précipité blanc noircissant à la lumière après ajout de nitrate d'argent dans les eaux de rinçage). Après séchage et broyage, l'argile obtenue est dite « purifiée ». L'argile homosodique est obtenue en ajoutant à une suspension d'argile purifiée une solution de chlorure de sodium avec une agitation du mélange à au moins 200 tours par minute durant au moins 24 heures, pour bien disperser et intercaler les ions sodium dans l’argile. L'argile est ensuite extraite par filtration, et lavée jusqu’à ce que les eaux de lavage n’aient plus de chlorures (test au nitrate d’argent), et le sécher[9] - [12].
Complexes organo-argileux
Ce sont des argiles homosodiques où ont été intercalées des unités polymériques de composés organique, qui rendent l’argile organophile ou hydrophobe. Plusieurs espèces chimiques sont utilisées comme structure polymériques. Parmi les sels ou surfactant très utilisés, figurent le bromure d'hexadecyltrimétylammonium (HTDMABr), l’ODEM (bromure d’octadecyldihydroxyéthylméthylammonium), le chlorure de benzyldimethyldodecyl-ammonium (BDDA) et le chlorure d’octadecyltrimetyl ammonium (ODTMA)[13] - [14].
Les argiles organophiles, étudiées depuis le début des années soixante ont des séries d’espacements basaux entre 14 à 17 Å et 30 à 50 Å ; les discussions ont porté sur la position d’intercalation (horizontale ou verticale) et le nombre d’atomes de carbone de chaque molécule [4]. Dans les années 1970, la recherche a progressé quand on a montrés que l’inefficacité de l’adsorption des composés organiques des eaux telles que les hydrocarbures hydrosolubles et certains composés aromatiques était due aux propriétés hydrophiles de ces matériaux [15] - [16] - [17]. L’étude des interactions entre divers composés organiques (benzène, toluène, phénol et ses dérivés chlorés, acide tannique, acide 2,4-dichlorophénoxy propionique) et les complexes organo-argileux, a monté la grande efficacité d’adsorption de ces derniers. L’efficacité croît quand la chaine carbonée du tensioactif est plus longue. L’influence de paramètres comme la nature du tensioactif co-adsorbé, le rapport tensioactif sur argile, le pH du milieu, la température, le temps de contact, a aussi été étudiée[18] - [19] - [20]. Les études sur l’élimination de certains pesticides et colorants des effluents industriels ont démontré que celle-ci était d’autant plus grande que les interactions entre les polluants et le complexe organo-argileux est forte, c’est-à-dire que le complexe argileux est plus organophile. Le caractère organophile est attribué à la nature hydrophobe des molécules de tensioactives insérées dans l’argile homosodique [21] - [22] - [23].
Complexes inorgano-argileux
Les complexes inorgano-argileux sont des argiles homosodiques dans lesquelles il a été intercallé des polycations métallique (Al(III), de chrome (III), de fer Fe(III) et de titane Ti(IV)).
Les argiles à pilliers d’oxydes métalliques présentent des propriétés absorptives et catalytiques exceptionnelles, qui a suscité un grand intérêt dans le monde. Semblables aux zéolites, elles ont été mises en œuvre pour la première fois en intercallant des polycations d’hydroxy-métalliques dans l’espace interfolliaire des argiles à feuillets directement par échange cationique [9].
Les argiles pontées par les polycations ont été utilisées avec efficacité dans le traitement des eaux, pour l’élimination des polluants tels que les phénols[9].
Les argiles pontées les plus étudiées sont celles intercalées par les polycations d’hydroxy aluminiques de structure [Al13O4(OH)24(H2O)12]7+ noté parfois Al13. Ces argiles pontées à l’aluminium sont préparées en deux étapes : 1) la solution à pilier est préparées, basée sur le rapport OH/Al3+ et le temps (durée) de vieillissement de ladite solution ; 2) le pontage de l’argile homosodique met en jeu la quantité de cation introduite (rapport Al/argile) et la température de traitement thermique de l’argile intercalée. Le pontage par les polycations d’aluminium confère aux argiles une grande résistance thermique, une grande surface spécifique et une porosité importante. Il développe aussi leur acidité car les polycations intercallés se transforment (après calcination) en piliers sous forme de grappes d’oxydes métalliques rigides et résistants, dont l’acidité de lewis de l’aluminium est transférée à l’argile homosodique de départ [24].
Le tableau 1 présente différents modes de préparation des argiles pontées à l’aluminium.
| Auteurs | Dali, 2011[25] | Talidi, 2006[26] | Barama, 2012[27] | Mbouga, 2012[28] |
|---|---|---|---|---|
| Mélange | AlCl3, 6H2O et Na2CO3 | AlCl3, 6H2O et NaOH | AlCl3, 6H2O et NaOH | AlCl3, 6H2O et NaOH |
| Rapport molaire Al/OH | 2 | 1,3; 1,8; 2; et 2,2 | 1,8 | 1,4; 1,8; et 2,4 |
| Durée de la solution pontante (en heure) | 1 | 24 | 48 | 24 et 48 |
| Rapport Al/ argile (mmol/g) | 4 | 5 | 4 | 40 et 80 |
| Température de traitement (°C) | 500 | 80 ; 300 et 500 | 450 | 70 |
| Résultat | / | / | d001=15,6 A | 12,6<d001<20,6 |
La préparation des montmorillonites homoioniques aluminiques en utilisant des solutions pontantes d’hydroxydes d’aluminium Al(III) auxquelles sont ajoutés des quantités croissantes de soude sous agitation, permet d’observer une diminution de la capacité d’échange cationique (CEC) en fonction de la quantité d’aluminium fixée. Cette diminution est due à la présence des polymères d’aluminium plutôt qu'à l’hydroxyde amorphe solide Al(OH)3. La capacité d’échange cationique (CEC) de ces solides microporeux après le pontage est irréversible pour des rapports OH/Al élevés (supérieure à 1,3). Les espèces polynucléaires d’aluminium se fixent sur les sites d’échanges dans les espaces interfoliaires du minéral utilisé. Les résultats diffractométriques montrent l’intercalation des polycations d’aluminium avec des espacements basaux de l’ordre de 18 Å à la température ambiante et qui se transforment en oxyde Al2O3 après calcination à 500 °C. Les études effectuées sur des montmorillonites homoioniques ont montré que l’adsorption et la polymérisation du phénol sont beaucoup plus importantes en milieu aéré qu’en milieu azoté selon l’ordre séquentiel suivant : Fe- > Al- > Ca- > Na-bentonite [29] - [30] - [31] - [32].
Dans les années 1990, l'étude des complexes inorgano-argileux s'est traduite en résultats encourageant les industriels à développer ces argiles modifiées pour le raffinage ou la dépollution. De nouvelles formes de complexes inorgano-argileux ont vu le jour (ex : bentonite modifiée au gallium produite avec une solution pontante par titration d’une solution de nitrate de gallium avec des quantités appropriées de carbonate de sodium selon un rapport molaire Na/Ga = 2)[33].
D'autres travaux ont montré l’intérêt des complexes inorgano-argileux dans la catalyse chimique (ce sont de bons catalyseurs) pour le craquage des hydrocarbures, la synthèse en chimie fine ou la fabrication des tamis moléculaires [25] - [34] - [35].
Les argiles pontées aux polycations de titane ont fait l’objet de peu de travaux aussi bien dans le domaine de la catalyse que dans le domaine du traitement des effluents et de la photodégradation des molécules organiques adsorbées. Ces complexes ont aussi amélioré les possibilités d'adsorption de certains métaux lourds (Cu, Ni, Zn, Cr, As) [36] - [37] - [38] - [39] - [40].
Complexes organo-inorgano-argileux
La dernière famille d’argiles pontées englobe toutes les autres molécules utilisées ; on peut citer le lignosulfonate et le bis (triéthoxysilyl) méthane (BTESM) comme réactif au silicium organique [41] - [14]. Les premiers travaux publiés sur l’application des complexes organo-inorgano-argileux ou argiles pontées mixtes ont montré le caractère très hydrophobe de cette nouvelle génération de matériaux adsorbants. Les tests d'adsorption des composés phénolés sur des smectites pontées à l’aluminium et coadsorbées par des molécules tensioactives cationiques ont montré que la co-adsorption de toutes ces argiles pontées avec des molécules à chaînes longues augmentent l'hydrophobie de ces matériaux au même titre que les charbons actifs utilisés et que plus la chaîne hydrocarbonée est longue et plus l’hydrophobie et l’organophilie sont élevées [42] - [43]. Des complexes mixtes se sont ensuite montré être de bons adsorbants. Les études sur les chloro et nitro-phénols ont montré que la montmorillonite pontée au zirconium et co-adsorbée par un tensioactif non ionique adsorbe d’importantes quantités de ces micropolluants organiques si on la compare avec une silicalite ou une zéolite béta. La montmorillonite intercalée par des polycations d’aluminium et modifiée par co-adsorption avec de l’hexadécyltriméthyl ammonium HDTMA adsorbe également beaucoup plus de phénol que les autres matrices organo- et inorganomontmorillonites préparées[44] - [45].
Plusieurs complexes mixtes ont été synthétisés et caractérisés selon la nature du pilier métallique Al(III), Fe(III), Ti(IV) et du tensioactif (Chlorure de cétyltriméthyl ammonium (CTAC) ou Bromure de cétyltriméthyl ammonium (CTAB)). Ils ont ensuite été testées dans l'adsorption de certains composés phénoliques [46] - [47]. Le choix du titane comme intercalant c’est pour accélérer le processus de photodégradation des molécules aromatiques en présence de lumière ultraviolette ; et de permettre l’obtention d’argiles à piliers de titane très efficaces (grands espacements interfoliaires, grande acidité et un réseau microporeux très développé)[9].
Notes et références
- Néji Besbes, Houyem Jellali, Patrick Pale et Mohamed Lotfi Efrit, « Isomerisation Catalysee Par le Gel de Silice et L'argile Activee de N-Acyl-2,2-Dimethylaziridines: Approche Mecanistique », Phosphorus, Sulfur, and Silicon and the Related Elements, vol. 185, no 4, , p. 883–889 (ISSN 1042-6507 et 1563-5325, DOI 10.1080/10426500903023079, lire en ligne, consulté le )
- Néji Besbes, Houyem Jellali, Patrick Pale et Ezzeddine Srasra, « Transformations de N-acylaziridines catalysées par des supports à base de silice et d’alumine : une élucidation mécanistique », Comptes Rendus Chimie, vol. 13, no 3, , p. 358–364 (ISSN 1631-0748, DOI 10.1016/j.crci.2009.09.014, lire en ligne, consulté le )
- E. Gillet, C. Legressus et M. Gillet, « Etude de l’interface Pd/Al2O3 application aux phénomènes de mouillage et d’adhésion », Journal de Chimie Physique, vol. 84, , p. 167–174 (ISSN 0021-7689, DOI 10.1051/jcp/1987840167, lire en ligne, consulté le )
- L. Fripiat, P. Cloos et A. Jornoy, « Note préliminaire sur l'état de valence du calcium adsorbé par la montmorillonite », Bulletin du Groupe français des argiles, vol. 13, no 8, , p. 65–68 (ISSN 0429-3320, DOI 10.3406/argil.1962.986, lire en ligne, consulté le )
- H. LOWTHER, « Monohydric Alcohols », dans Organic Chemistry, Elsevier, (lire en ligne), p. 48–54
- G. W. Brindley et R. E. Sempels, « Preparation and properties of some hydroxy-aluminium beidellites », Clay Minerals, vol. 12, no 3, , p. 229–237 (ISSN 0009-8558 et 1471-8030, DOI 10.1180/claymin.1977.012.3.05, lire en ligne, consulté le )
- N. Lahav, « Cross-Linked Smectites. I. Synthesis and Properties of Hydroxy-Aluminum-Montmorillonite », Clays and Clay Minerals, vol. 26, no 2, , p. 107–115 (ISSN 0009-8604, DOI 10.1346/ccmn.1978.0260205, lire en ligne, consulté le )
- I Mrad, A Ghorbel, JF Lambert et M Che, « Adsorption du cadmium sur une montmorillonite pontée à l’aluminium », Journal de Chimie Physique, vol. 94, , p. 1883–1896 (ISSN 0021-7689, DOI 10.1051/jcp/1997941883, lire en ligne, consulté le )
- Omar Bouras, Propriétés adsorbantes d'argiles pontées organophiles : synthèse et caractérisation, Limoges, Faculté des sciences technique, , 196 p. (lire en ligne)
- A.F. Freitas, M.F. Mendes et G.L.V. Coelho, « Thermodynamic study of fatty acids adsorption on different adsorbents », The Journal of Chemical Thermodynamics, vol. 39, no 7, , p. 1027–1037 (ISSN 0021-9614, DOI 10.1016/j.jct.2006.12.016, lire en ligne, consulté le )
- Mbouga Marie Golleti, Formulation d’insecticide en poudre par adsorption des huiles essentielles de Xylopiaaethiopica et ocimumgratissimum sur des argiles camerounaises modifiées, Montpelier 2, Ecole nationale supérieure de chimie de Montpelier, , 269 p. (lire en ligne)
- Marie Goletti Nguemtchouin Mbouga, Formulation d’insecticides en poudre par adsorption des huiles essentielles de Xylopia aethiopica et de Ocimum gratissimum sur des argiles camerounaises modifiées, Montpellier, Ecole nationale supérieure de chimie, , 293 p. (lire en ligne)
- S. Gammoudi, N. Frini-Srasra et E. Srasra, « Influence of exchangeable cation of smectite on HDTMA adsorption: Equilibrium, kinetic and thermodynamic studies », Applied Clay Science, vol. 69, , p. 99–107 (ISSN 0169-1317, DOI 10.1016/j.clay.2011.11.011, lire en ligne, consulté le )
- Mohammed Hennous, Zoubir Derriche, Edwige Privas et Patrick Navard, « Lignosulfonate interleaved layered double hydroxide: A novel green organoclay for bio-related polymer », Applied Clay Science, vol. 71, , p. 42–48 (ISSN 0169-1317, DOI 10.1016/j.clay.2012.10.011, lire en ligne, consulté le )
- M. B. McBride, « Surface Reactions of 3,3′,5,5′-Tetramethyl Benzidine on Hectorite », Clays and Clay Minerals, vol. 33, no 6, , p. 510–516 (ISSN 0009-8604, DOI 10.1346/ccmn.1985.0330605, lire en ligne, consulté le )
- M El-Dib, « Role of adsorbents in the removal of soluble aromatic hydrocarbons from drinking waters », Water Research, vol. 12, no 12, , p. 1131–1137 (ISSN 0043-1354, DOI 10.1016/0043-1354(78)90061-1, lire en ligne, consulté le )
- S KARICKHOFF, D BROWN et T SCOTT, « Sorption of hydrophobic pollutants on natural sediments », Water Research, vol. 13, no 3, , p. 241–248 (ISSN 0043-1354, DOI 10.1016/0043-1354(79)90201-x, lire en ligne, consulté le )
- W.F. Jaynes et S.A. Boyd, « Clay Mineral Type and Organic Compound Sorption by Hexadecyltrimethlyammonium-Exchanged Clays », Soil Science Society of America Journal, vol. 55, no 1, , p. 43–48 (ISSN 0361-5995, DOI 10.2136/sssaj1991.03615995005500010007x, lire en ligne, consulté le )
- Monique A.M Lawrence, Ravi K Kukkadapu et Stephen A Boyd, « Adsorption of phenol and chlorinated phenols from aqueous solution by tetramethylammonium- and tetramethylphosphonium-exchanged montmorillonite », Applied Clay Science, vol. 13, no 1, , p. 13–20 (ISSN 0169-1317, DOI 10.1016/s0169-1317(98)00009-x, lire en ligne, consulté le )
- Sang-Mo Koh et Joe Boris Dixon, « Preparation and application of organo-minerals as sorbents of phenol, benzene and toluene », Applied Clay Science, vol. 18, nos 3-4, , p. 111–122 (ISSN 0169-1317, DOI 10.1016/s0169-1317(00)00040-5, lire en ligne, consulté le )
- Yasser El-Nahhal, Tomas Undabeytia, Tamara Polubesova et Yael Golda Mishael, « Organo-clay formulations of pesticides: reduced leaching and photodegradation », Applied Clay Science, vol. 18, nos 5-6, , p. 309–326 (ISSN 0169-1317, DOI 10.1016/s0169-1317(01)00028-x, lire en ligne, consulté le )
- M.J. Carrizosa, W.C. Koskinen, M.C. Hermosin et J. Cornejo, « Dicamba adsorption–desorption on organoclays », Applied Clay Science, vol. 18, nos 5-6, , p. 223–231 (ISSN 0169-1317, DOI 10.1016/s0169-1317(01)00037-0, lire en ligne, consulté le )
- S. H. Lee, D. I. Song et Y. W. Jeon, « An Investigation of the Adsorption of Organic Dyes onto Organo-Montmorillonite », Environmental Technology, vol. 22, no 3, , p. 247–254 (ISSN 0959-3330 et 1479-487X, DOI 10.1080/09593332208618278, lire en ligne, consulté le )
- R. A. Schoonheydt, T. Pinnavaia, Gerhard Lagaly et Nick Gangas, « Pillared Clays and Pillared Layered Solids », Pure and Applied Chemistry, vol. 71, no 12, , p. 2367–2371 (ISSN 1365-3075 et 0033-4545, DOI 10.1351/pac199971122367, lire en ligne, consulté le )
- (en) « 📚 Théses-Algérie: Doctorat, Magister, Master... », sur www.theses-algerie.com (consulté le )
- TALIDI Abdellah, Etude de l’élimination du Chrome et du bleu de méthylène en milieux aqueux par adsorption sur la pyrophyllite traitée et non traitée, Rabat, Thèse de doctorat de l'Université mohammed v, , 270 p.
- Siham Barama, Développement et synthèse de deux séries de catalyseurs à base de bentonite et d’oxydes mixtes. Application à la déshydrogénation oxydante du méthane, Haouri Boumediene, Thèse de doctorat de la Faculté de Chimie de l’Université des sciences et de la technologie, (lire en ligne)
- « Formulation d’insecticides en poudre par adsorption des huiles essentielles de Xylopia aethiopica et de Ocimum gratissimum sur des argiles camerounaises modifiées », sur www.theses.fr (consulté le )
- Mu Ju Shen et C. I. Rich, « Aluminum Fixation in Montmorillonite », Soil Science Society of America Journal, vol. 26, no 1, , p. 33–36 (ISSN 0361-5995, DOI 10.2136/sssaj1962.03615995002600010009x, lire en ligne, consulté le )
- G. BROWN et A. C. D. NEWMAN, « THE REACTIONS OF SOLUBLE ALUMINIUM WITH MONTMORILLONITE », Journal of Soil Science, vol. 24, no 3, , p. 339–354 (ISSN 0022-4588, DOI 10.1111/j.1365-2389.1973.tb00770.x, lire en ligne, consulté le )
- M. KRUMPOLC et J. ROCEK, « ChemInform Abstract: SYNTHESIS OF STABLE CHROMIUM(V) COMPLEXES OF TERTIARY HYDROXY ACIDS », Chemischer Informationsdienst, vol. 10, no 40, (ISSN 0009-2975, DOI 10.1002/chin.197940256, lire en ligne, consulté le )
- B. L. Sawhney, « Vapor-Phase Sorption and Polymerization of Phenols by Smectite in Air and Nitrogen », Clays and Clay Minerals, vol. 33, no 2, , p. 123–127 (ISSN 0009-8604, DOI 10.1346/ccmn.1985.0330206, lire en ligne, consulté le )
- A. Bellaloui, D. Plee et P. Meriaudeau*, « Gallium containing pillared interlayer clays », Applied Catalysis, vol. 63, no 1, , L7–L10 (ISSN 0166-9834, DOI 10.1016/s0166-9834(00)81701-7, lire en ligne, consulté le )
- He Ming-Yuan, Liu Zhonghui et Min Enze, « Acidic and hydrocarbon catalytic properties of pillared clay », Catalysis Today, vol. 2, nos 2-3, , p. 321–338 (ISSN 0920-5861, DOI 10.1016/0920-5861(88)85013-2, lire en ligne, consulté le )
- Rachid Issaadi, François Garin, Chems.Eddine Chitour et Gilbert Maire, « Catalytic behaviour of combined palladium-acid catalysts: use of Al and Zr-pillared montmorillonite as supports », Applied Catalysis A: General, vol. 207, nos 1-2, , p. 323–332 (ISSN 0926-860X, DOI 10.1016/s0926-860x(00)00664-5, lire en ligne, consulté le )
- Lilia Khalfallah Boudali, Abdelhamid Ghorbel, Hassen Amri et François Figueras, « Propriétés catalytiques de la montmorillonite intercalée au titane dans l'oxydation de l'alcool allylique (E)-hex-2-én-1-ol », Comptes Rendus de l'Académie des Sciences - Series IIC - Chemistry, vol. 4, no 1, , p. 67–72 (ISSN 1387-1609, DOI 10.1016/s1387-1609(00)01211-1, lire en ligne, consulté le )
- Chihiro Ooka, Hisao Yoshida, Masakazu Horio et Kenzi Suzuki, « Adsorptive and photocatalytic performance of TiO2 pillared montmorillonite in degradation of endocrine disruptors having different hydrophobicity », Applied Catalysis B: Environmental, vol. 41, no 3, , p. 313–321 (ISSN 0926-3373, DOI 10.1016/s0926-3373(02)00169-8, lire en ligne, consulté le )
- A. Bakhti, Z. Derriche, A. Iddou et M. Larid, « A study of the factors controlling the adsorption of Cr(III) on modified montmorillonites », European Journal of Soil Science, vol. 52, no 4, , p. 683–692 (ISSN 1351-0754, DOI 10.1046/j.1365-2389.2001.00413.x, lire en ligne, consulté le )
- T Vengris, R Binkien≐ et A Sveikauskait≐, « Nickel, copper and zinc removal from waste water by a modified clay sorbent », Applied Clay Science, vol. 18, nos 3-4, , p. 183–190 (ISSN 0169-1317, DOI 10.1016/s0169-1317(00)00036-3, lire en ligne, consulté le )
- Véronique Lenoble, Omar Bouras, Véronique Deluchat et Bernard Serpaud, « Arsenic Adsorption onto Pillared Clays and Iron Oxides », Journal of Colloid and Interface Science, vol. 255, no 1, , p. 52–58 (ISSN 0021-9797, DOI 10.1006/jcis.2002.8646, lire en ligne, consulté le )
- Siqi Xue et Thomas J. Pinnavaia, « Methylene-functionalized saponite: A new type of organoclay with CH2 groups substituting for bridging oxygen centers in the tetrahedral sheet », Applied Clay Science, vol. 48, nos 1-2, , p. 60–66 (ISSN 0169-1317, DOI 10.1016/j.clay.2009.11.006, lire en ligne, consulté le )
- Richard C. Zielke, « Modified Clays for the Adsorption of Environmental Toxicants: Binding of Chlorophenols to Pillared, Delaminated, and Hydroxy-Interlayered Smectites », Clays and Clay Minerals, vol. 36, no 5, , p. 403–408 (ISSN 0009-8604, DOI 10.1346/ccmn.1988.0360504, lire en ligne, consulté le )
- E Montarges, « Removing of organic toxicants from water by Al13–pluronic modified clay », Applied Clay Science, vol. 13, no 3, , p. 165–185 (ISSN 0169-1317, DOI 10.1016/s0169-1317(98)00027-1, lire en ligne, consulté le )
- Huai-Te Shu, Danyun Li, Alfred A. Scala et Yi Hua Ma, « Adsorption of small organic pollutants from aqueous streams by aluminosilicate-based microporous materials », Separation and Purification Technology, vol. 11, no 1, , p. 27–36 (ISSN 1383-5866, DOI 10.1016/s1383-5866(96)01005-2, lire en ligne, consulté le )
- Jia-Qian Jiang, Colin Cooper et Sabeha Ouki, « Comparison of modified montmorillonite adsorbents », Chemosphere, vol. 47, no 7, , p. 711–716 (ISSN 0045-6535, DOI 10.1016/s0045-6535(02)00011-5, lire en ligne, consulté le )
- Edouard Marc Meyer et André Jacot-Guillarmod, « Etudes sur les composés organométalliques. XIX. Synthèse et caractérisation de composés alkoxy (alkyl)titane (IV) », Helvetica Chimica Acta, vol. 66, no 3, , p. 898–901 (ISSN 0018-019X, DOI 10.1002/hlca.19830660323, lire en ligne, consulté le )
- O. Bouras, M. Houari et H. Khalaf, « Using of Surfactant Modified Fe-Pillared Bentonite for the Removal of Pentachlorophenol from Aqueous Stream », Environmental Technology, vol. 22, no 1, , p. 69–74 (ISSN 0959-3330 et 1479-487X, DOI 10.1080/09593332208618307, lire en ligne, consulté le )