Isonitrile
Un isonitrile, isocyanure, également, plus anciennement, une carbylamine, est un composé organique contenant le groupe fonctionnel isocyanure C≡N-.
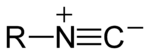
Propriétés
Les isonitriles ont été découverts en 1867 par A. Gautier et August Wilhelm von Hofmann, mais n’ont été étudiés qu’à partir de 1960. Ces composés ont été mis à l’écart pour deux raisons principales: d’une part à cause de leur odeur souvent désagréable et d’autre part à cause de l’ambiguïté liée à leur double réactivité. En effet, les isonitriles, de par leur structure « carbénique », peuvent intervenir dans les réactions chimiques, soit comme électrophiles, soit comme nucléophiles. Ils constituent, en outre, une classe de composés uniques, puisqu’ils sont des carbénoïdes stables, isoélectroniques de la molécule de monoxyde de carbone. Les premières investigations entreprises sur ce type de composés visaient à vérifier la présence d’un atome de carbone bivalent comme dans les carbènes. Toutes les propriétés physico-chimiques des isonitriles sont en accord avec deux formules limites de résonance qui soulignent leur aptitude à capter les protons pour former des liaisons C-H:
Leur caractérisation se fait principalement par spectroscopie infrarouge avec une absorption caractéristique vers 2 130 cm−1 en série aromatique et éthylénique et vers 2 150 cm−1 en série aliphatique.
Une synthèse d'isonitriles réalisée à l'université d'Amsterdam a forcé à évacuer l'intégralité du département de chimie à cause de l'odeur .
Synthèse
Il existe plusieurs méthodes de préparation des isonitriles à partir de la fonction amine libre ou des formamides correspondants.
Réaction carbylamine
La réaction carbylamine ou synthèse des isocyanures de Hoffmann, correspondant à la réaction d’une amine primaire avec le chloroforme et une base forte, était recommandée pour la détection des amines primaires et a été considérée pendant longtemps comme la meilleure méthode de préparation d'isonitriles. Cette méthode procédant par catalyse par transfert de phase consiste en une addition de dichlorocarbène sur une amine primaire, suivie d'une bêta-élimination d’une molécule de HCl et d’une alpha-élimination d’une seconde molécule de HCl.
α-Élimination à partir de formamides
Considérant les produits de l’hydrolyse des isonitriles, Gautier suggéra qu’ils devaient être considérés comme des dérivés issus de la condensation de l’acide formique sur des amines primaires. Ainsi il était possible de les préparer par élimination d’eau à partir de N-formamides monosubstitués. Il a été montré que de nombreux agents d’acylation (phosgène, diphosgène, oxytrichlorure de phosphore, triphénylphosphine/tétrachlorure de carbone, chlorothionoformate de phényle, chlorure de thionyle, etc.) éliminent l’eau de N-formamides monosubstitués en présence d’une base (triéthylamine, tertiobutylate de potassium, pyridine, etc.). La réaction de N-formamides monosubstitués avec les agents acylants et les bases se déroule en deux étapes successives: - la O-acylation catalysée par la base - l’alpha-élimination.
Exemple d’utilisation des isonitriles: La réaction de Ugi
La réaction de Ugi est une variante de la réaction de Passerini, qui fait intervenir 4 partenaires: un isonitrile, un acide carboxylique, un dérivé carbonylé (aldéhyde ou cétone) et une amine (primaire ou secondaire). Cette condensation résulte d’une a-addition sur l’isonitrile, de l’acide carboxylique et du sel d’imonium (base de Schiff issue de la condensation de l’amine sur le dérivé carbonylé), conduisant à l’a-(acylamino) amide stabilisé par réarrangement de l’acyle.
Références
- Gautier, A. Liebigs Ann. Chem. 1867, 142, 289.
- Hofmann, A. W. Liebigs Ann. Chem. 1867, 144, 114.
- Stephany, R. W.; de Bie, M. J. A.; Drenth, W. Org. Magn. Res. 1974, 6, 45-47.
- Ugi, I.; Fetzer, U.; Eholzer, U.; Knupfer, H. Offermann, K. Angew. Chem. Int. Ed. Engl . 1965, 6, 472-484.
- Gautier, A. Liebigs Ann. Chem. 1869, 29, 155.
- Skorna, G.; Ugi, I. Angew. Chem. Int. Ed. Engl. 1977, 4, 259-260.
- Hoogenboom, B. E.; Oldenziel, O. H.; van Leusen, A. M. Org. Synth. 1977, 57, 102.
- Schöllkopf, U.; Hausberg, H.; Segal, M.; Reiter, U.; Hoppe, I.; Saenger, W.; Lindner, K.; Liebigs Ann. Chem. 1981, 3, 439-458.
- Subhas Bose, D.; Ravinder Goud, P. Tetrahedron Lett. 1999, 40, 747-748.
- Ugi, I.; Meyr, R. Chem. Ber. 1960, 93, 239.
- Ugi, I. Angew. Chem. Int. Ed. Engl. 1962, 1, 8.
- Ugi, I.; Steinbruckner, C. Chem. Ber. 1961, 94, 734.
- Gokel, G.; Lüdke, G.; Ugi, I., in “Isonitrile chemistry”; Ugi, I.(Ed), Academic Press, New York, 1971, 145-199.
- Passerini, M. Gazz. Chim. Ital. 1921, 126, 181.
- Passerini, M.; Ragni, G. Ibid. 1931, 61, 964.