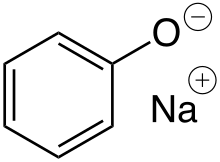
Phénolate
En chimie, phénolate désigne l'ion phénolate, base conjuguée du phénol ainsi que ses sels. Ces derniers sont formés à partir de phénol par la substitution de l'atome H du groupe hydroxyle par des métaux. Dans un sens plus large, ils désignent également les sels des dérivés du phénol.
Synthèse
Les sels alcalins des phénols sont formés par traitement des phénols avec des solutions d'hydroxyde alcalin[1] ; par exemple, le phénolate de sodium est formé par l'action de la soude caustique (solution d'hydroxyde de sodium) sur le phénol.
Propriétés
Les phénolates alcalins — tels que le phénolate de sodium — sont très fortement clivés par hydrolyse en solution aqueuse, c'est-à-dire qu'ils réagissent comme des bases[1]. Les acides minéraux, les acides carboxyliques ou le dioxyde de carbone réagissent avec les solutions de phénolate en libérant le phénol correspondant. Ce pouvoir basique des ions phénolate est d'autant moins fort que l'ion est stabilisé par les substituants sur le cycle benzéniques, l'aromaticité étant déjà un important stabilisateur. En effet, comparé aux autres alcoolates qui sont des bases très fortes ne pouvant exister en milieu aqueux (pKA compris entre 16 et 17), le couple phénol/phénolate a un pKA de 9,95, ce qui en fait une base faible. Des groupes attracteur sur le cycle stabilisent encore plus cet anion, réduisant encore ce caractère basique ; c'est par exemple le cas des groupes nitro (-I, -M) qui stabilisent l'ion tout en augmentant la polarité de la liaison -O-H du phénol, et explique l'acidité croissante des composés avec le nombre croissant de groupes nitro. De 7,16 pour le 4-nitrophénol, le moins basique des nitrophénols, le pKA peut descendre jusqu'à 0,29 pour le 2,4,6-trinitrophénol, appelé acide picrique, qui est presque un acide fort.
Les anions phénolates réagissent également comme de puissants nucléophiles et peuvent être attaqués à la fois sur leur oxygène ou sur le carbone[2]. En général, l'attaque sur l'atome d'oxygène est préférée dans des réactions sous contrôle cinétique, alors que l'attaque sur le carbone est principalement observée sous contrôle thermodynamique.
Utilisation
Les phénolates peuvent servir à produire des alkylaryléthers synthèse de Williamson. Ainsi, on peut faire réagir par exemple le phénolate de sodium avec des halogénures d'alkyle, de préférence des iodures[3] :
- C6H5–ONa + CH3–I → C6H5–O–CH3 + NaI
À l'échelle industrielle, les sulfates de dialkyle (par exemple le sulfate de diéthyle pour l'introduction de groupe éthyle) peuvent être utilisés à la place des halogénures d'alkyle :
- C6H5–ONa + (H3CO)2–SO2 → C6H5–O–CH3 + H3CO–SO3
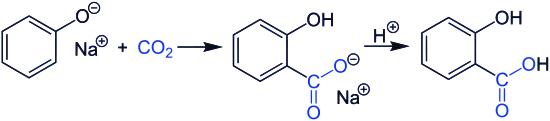
Synthèse de l'acide salicylique
L'acide salicylique peut être produit par la réaction de Kolbe-Schmitt (également appelée simplement « synthèse de l'acide salicylique ») à partir de CO2 et de phénolate de sodium :
Notes et références
- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « Phenolat » (voir la liste des auteurs).
- (de) Hans-Dieter Jakubke et Ruth Karcher, Lexikon der Chemie, vol. 3, Heidelberg, Spektrum Verlag, , 466 p. (ISBN 3-8274-0381-2), p. 14
- Robert J. Mayer, Martin Breugst, Nathalie Hampel, Armin R. Ofial et Herbert Mayr, « Ambident Reactivity of Phenolate Anions Revisited: A Quantitative Approach to Phenolate Reactivities », Journal of Organic Chemistry, (DOI 10.1021/acs.joc.9b01485)
- (de) Hans Beyer et Wolfgang Walter, Organische Chemie, Stuttgart, S. Hirzel Verlag, , 463–464 p. (ISBN 3-7776-0406-2)