Synthèse de Williamson
La synthèse de Williamson est une réaction organique formant un éther-oxyde à partir d'un halogénure organique et d'un alcool. Cette réaction a été développée par Alexander Williamson en 1850[2]. Cette réaction est importante dans l'histoire de la chimie organique car elle a aidé à prouver la structure des éther-oxydes.
Mécanisme
Typiquement, cette réaction implique un ion alcoolate réagissant avec un halogénure d'alkyle, ou dérivé halogéné (R-X) par une SN2. L'alcoolate est formé par activation nucléophile à partir d'un alcool. Pour que cette synthèse ait un bon rendement, il faut que l'halogénure d'alkyle soit primaire. Le rendement décroit avec l'encombrement du R-X, car l'alcoolate est une base forte, donc même à froid les R-X secondaires et tertiaires subissent des Β-éliminations. Le mécanisme général est le suivant[3] :

Attention, il est faux de faire pointer la flèche de mécanisme provenant de l'oxygène directement sur un groupement R' qui représente tout le reste de la molécule, c'est pour cette raison que la flèche arrive sur un C intermédiaire. (Les atomes d'hydrogène ne sont pas représentés.)
Un exemple est la réaction entre l'éthanolate de sodium avec le chloroéthane pour former l'éther diéthylique et le chlorure de sodium :
- Na+C2H5O− + C2H5Cl → C2H5OC2H5 + Na+Cl−
Utilisation
La synthèse de Williamson a un spectre d'utilisation assez large. Elle est largement utilisée à la fois en laboratoire et dans l'industrie et reste la méthode la plus simple et la plus populaire pour préparer des éther-oxydes. Les éthers aussi bien symétriques qu'asymétriques sont facilement préparés par cette synthèse. La réaction intramoléculaire chez les halogénohydrines en particulier donne des époxydes.
Dans le cas de la synthèse d'éthers asymétrique, il y a le choix entre deux types de réactifs (chaque côté pouvant être initialement l'halogénure ou l'alcool), on choisit en général selon la disponibilité du réactif, et sa réactivité. Il est également possible, de façon fréquente, d'utiliser la synthèse de Williamson à partir de deux alcools ; l'un d'eux est converti en halogénure (en utilisant généralement un tosylate), et les deux réactifs sont ensuite mis à réagir ensemble.
L'alcoolate peut être primaire, secondaire ou tertiaire. En revanche, l'agent alkyant doit être préférentiellement primaire. Les composés secondaires réagissent également, mais les tertiaires sont en général trop sujets à des réactions parasites pour être utiles. Le groupe partant est le plus souvent un halogénure ou un ester de sulfonate synthétisé pour le besoin de la réaction. Comme les conditions de la réaction sont plutôt dures, des groupes protecteurs sont souvent utilisés pour protéger les autres groupes sensibles des molécules utilisées (par exemple un autre groupe alcool, un groupe amine).
Conditions
Comme les ions alcoolates sont très réactifs, ils sont en général préparés immédiatement avant la réaction, ou générés in situ ; en laboratoire. Cette génération est effectuée en faisant réagir l'alcool avec un base carbonate ou l'hydroxyde de potassium, alors que dans l'industrie, on utilise souvent un catalyseur de transfert de phase. On peut utiliser une large gamme de solvants, mais les solvants protiques et les solvants apolaires tendent à réduire fortement le taux de réaction, résultant d'une baisse de disponibilité du nucléophile libre. Pour cette raison, on utilise en général l'acétonitrile et le N,N-diméthylformamide.
Une réaction de Williamson est en général menée à 50–100 °C et est effectuée en une à huit heures. Souvent, la transformation complète des réactifs initiaux est difficile à réaliser, et les réactions parasites sont communes. On obtient en général des rendements de 50 à 90 % en laboratoire, et des conversions presque quantitatives sont obtenues par des procédés industriels.
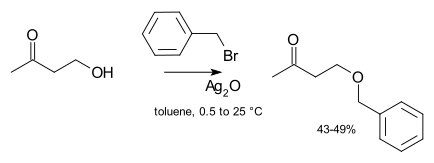
Une catalyse n'est en général pas nécessaire en laboratoire. Cependant, si un agent alkylant non-réactif est utilisé (par exemple un chlorure d'alkyle), le taux de réaction peut grandement être amélioré en ajoutant une quantité catalytique d'un sel d'iodure soluble (permettant un transfert d'halogénure, créant un dérivé iodure plus réactif, une variante de la réaction de Finkelstein). Dans des cas extrêmes, des sels d'argent peuvent être ajoutés, comme l'oxyde d'argent(I)[4] :
L'ion argent(I) se coordonne avec le groupe partant halogénure, pour permettre un départ plus facile. Des catalyseurs de transfert de phase peuvent aussi être utilisés (comme le bromure de tétrabutylammonium ou la 18-couronne-6) afin d'augmenter la solubilité de l'alcoolate en lui donnant un contre-ion plus doux.
Réactions parasites
La réaction de Williamson est souvent en compétition avec l'élimination en milieu basique de l'agent alkylant[3], et la nature de groupe partant aussi bien que des conditions de réactions (en particulier la température et le solvant) peuvent avoir une forte influence sur la réaction favorite. En particulier, certains agents alkylants peuvent avoir une structure qui les rend propices aux réactions d'élimination. Lorsque le nucléophile est un alcoolate aromatique, la réaction de Williamson est en compétition avec une alkylation du cycle.
Notes et références
- (en) A. W. Burgstahler et L. R. Worden, « Coumarone », Org. Synth., vol. 46, , p. 28 (ISSN 0078-6209, DOI 10.15227/orgsyn.046.0028).
- (en) A. W. Williamson, « Theory of Ætherification », Philos. Mag., vol. 37, no CCLI, , p. 350-356 (ISSN 1478-6435, lire en ligne).
- (en) R. W. Boyd et R. Morrison, Organic chemistry, Englewood Cliffs (NJ), Prentice Hall, , 6e éd., 1279 p. (ISBN 978-0-13-643669-0), chap. 6 (« Alcohols and Ethers »), p. 241–242.
- (en) M. Tanabe et R. H. Peters, « (R,S)-Mevalonolactone-2-13C », Org. Synth., vol. 60, , p. 92 (ISSN 0078-6209).
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Williamson ether synthesis » (voir la liste des auteurs).