Réaction parasite
Une réaction parasite ou réaction secondaire est une réaction chimique qui se produit en même temps que la réaction principale, mais avec une intensité moindre. Elle réduit le rendement de la réaction avec formation d'un sous-produit[1].
P1 est le produit principal si k1> k2. Le sous-produit P2 est généralement indésirable, et doit être séparé (généralement à coût élevé).
En synthèse organique
Les symboles B et C dans les équations ci-dessus représentent en général des composés différents, mais ils peuvent également représenter deux sites d'une molécule susceptibles de réagir de façon concurrente en donnant des produits différents.
On peut également parler de réactions en compétition[2] - [3] quand divers composés (B, C) sont en compétition pour réagir avec le même réactif (A). Si la réaction parasite se produit aussi fréquemment que la réaction principale, on parle de réactions parallèles[4], en particulier en termes de cinétique.
Des situations plus complexes peuvent également exister. Par exemple, une substance A peut réagir de manière réversible mais rapide pour former une substance B (avec une vitesse k1) ou de manière irréversible mais lente (k1 > k-1 >> k2) pour former une substance C :
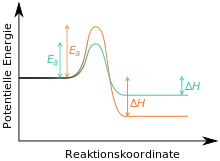
En supposant que la réaction vers C est irréversible, c'est-à-dire qu'elle est la substance la plus stable thermodynamiquement, on dit que C est le produit thermodynamique, et B le produit cinétique (voir aussi contrôle cinétique et contrôle thermodynamique)[5] - [6] - [7]. Si la réaction est effectuée à basse température et stoppée après une courte durée, le produit cinétique est majoritairement formé, on parle alors de « contrôle cinétique ». À l'inverse, si la réaction est effectuée à haute température, sur un temps suffisamment long (ce qui apporte l'énergie d'activation suffisante pour que la réaction vers C se produise), le produit thermodynamique devient majoritaire ; on parle alors de contrôle thermodynamique.
Conditions pour une réaction parasite
En synthèse organique, une augmentation de la température entraîne généralement une augmentation des sous-produits. Comme ils sont en général indésirables, on préfère alors des températures plus basses (« conditions douces »). Le rapport entre les réactions concurrentes peut généralement être influencé par un changement de température, car leurs énergies d'activation sont généralement différentes. Les réactions à haute énergie d'activation sont plus fortement accélérées par l'augmentation de la température que celles à faible énergie d'activation. L'état d'équilibre dépend aussi de la température[8].
Les réactions parasites peuvent perturber les réactions de détection (de).
Cinétique
Les réactions parasites peuvent être décrites en termes de cinétique chimique. Elles sont considérées comme des réactions complexes car la réaction générale (réaction principale et réaction parasite) est constituée de plusieurs (au moins deux) réactions élémentaires[9], tout comme les réactions en concurrence, les réactions parallèles, les réactions consécutives, les réactions en chaîne, les réactions réversibles, etc.[10].
Si les réactions et sont irréversibles, le ratio de P1 et P2 correspond à la réactivité relative de B et C par rapport à A :
Notes et références
- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « Nebenreaktion » (voir la liste des auteurs).
- « side reaction auf merriam-webster.com » (consulté le )
- « Konkurrenzreaktion auf chemgapedia.de » (consulté le )
- « Konkurrenzreaktion auf universal_lexikon.deacademic.com » (consulté le )
- « 4. Kinetik und Katalyse » [PDF] (consulté le )
- « Kinetische und thermodynamische Kontrolle von chemischen Reaktionen auf Chemgapedia.de » (consulté le )
- (de) John Gilbert et Stephen Martin, Experimental Organic Chemistry : A Miniscale and Microscale Approach (lire en ligne)
- (de) Robert G. Mortimer, Physical Chemistry, Academic Press, (lire en ligne)
- (de) Klaus Schwetlick, Organikum : organisch-chemisches Grundpraktikum, Weinheim, Wiley-VCH, , 23e éd., 883 p. (ISBN 978-3-527-32292-3), p. 156
- « Komplexe Reaktionen auf spektrum.de » (consulté le )
- von Claus Czeslik, Heiko Seemann, Roland Winter, Basiswissen Physikalische Chemie, Wiesbaden, Vieweg+Teubner Verlag / GWV Fachverlage, Wiesbaden, , 4., aktualisierte Aufl. éd., 280-291 p. (ISBN 978-3-8348-9359-8, lire en ligne)
![{\displaystyle {\ce {{A}+B->[{k_{1}}]P1}}}](https://img.franco.wiki/i/3168fbf52fc171ac42d721d1eccf57ba532c8419.svg)
![{\displaystyle {\ce {{A}+C->[{k_{2}}]P2}}}](https://img.franco.wiki/i/2d16a27a665d4cc910e04f9e3f9481f216cf0e43.svg)
![{\displaystyle {\ce {B<=>A->[{k_{2}}]C}}}](https://img.franco.wiki/i/9eb19cb35defcfd33bd5bbdbaf15c92c90c55320.svg)
![{\displaystyle {\frac {\ce {[P1]}}{\ce {[P2]}}}={\frac {k_{1}[{\ce {B}}]}{k_{2}[{\ce {C}}]}}}](https://img.franco.wiki/i/d6a40a7ee5d985fab93032d041123b6459e562fb.svg)