Nitrophénol
Le mononitrophénol ou plus simplement nitrophénol est un composé aromatique de formule HOC6H4NO2. Il est constitué d'un cycle benzénique substitué par un groupe hydroxyle (phénol) et un groupe nitro. Comme tous les benzènes disubstitués, il existe sous la forme de trois isomères structuraux, les composés ortho, méta et para, selon la position relative des deux substituants sur le cycle.
Propriétés
| Nitrophénol | |||
| Nom | 2-Nitrophénol | 3-Nitrophénol | 4-Nitrophénol |
| Autres noms | o-Nitrophénol Orthonitrophénol 1-Hydroxy-2-nitrobenzène |
m-Nitrophénol Métanitrophénol 1-Hydroxy-3-nitrobenzène |
p-Nitrophénol Paranitrophénol 1-Hydroxy-4-nitrobenzène |
| Représentation | 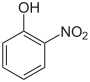 |
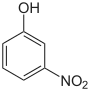 |
|
| Numéro CAS | |||
| PubChem | 6947 | 11137 | 980 |
| Formule brute | C6H5NO3 | ||
| Masse molaire | 139,11 g mol−1 | ||
| État | solide | ||
| Apparence | aiguilles ou prismes jaunâtres[1] | cristaux incolores[2] | aiguilles incolores[3] |
| Point de fusion | 44 °C[1] | 97 °C[2] | 113 à 115 °C[3] |
| Point d'ébullition | 214 °C[1] | 194 °C (93 mbar)[2] | > 260 °C (décomp.)[3] |
| pKa[4] | 7,21 | 8,38 | 7,16 |
| Solubilité dans l'eau | 2,1 g l−1 (20 °C)[1] | 13,5 g l−1 (25 °C)[2] | 14,8 g l−1 (25 °C)[3] |
| SGH |
-[1] |  [2] |
  Attention[3] |
| Phrases H et P | H412 |
H302 et H319 |
H301, H312, H332 et H373 |
| P262 et P273 |
P280 | ||
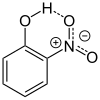
Les trois isomères sont des solides cristallins jaune (isomère para) ou incolores (isomères méta et ortho), peu solubles dans l'eau mais solubles dans l'éthanol, l'éther et le chloroforme. Le 4-nitrophénol a une légère odeur phénolique.
Les trois isomères, en particulier les isomères ortho et para, sont légèrement plus acide que le phénol (pKa de 9,95). Cela est en partie dû à la stabilisation par mésomérie de l'ion phénolate formé (effet -M) possible pour les formes ortho et para, mais pas pour la forme méta.
Les trois composés présentent une différence marquée au niveau de leur point de fusion. Le 2-nitrophénol a le point de fusion le plus bas, du fait que la liaison hydrogène entre les groupes hydroxyle et nitro a tendance à être intramoléculaire, alors que pour les autres isomères elle est intermoléculaire (entre deux molécules adjacentes). De telles liaisons intermoléculaires doivent alors être brisées pour rendre le composé liquide, ce qui augmente l'énergie requise. Cet effet est maximal pour le 4-nitrophénol, du fait de la position symétrique des groupes hydroxyle et nitro.
Les trois composés sont peu solubles dans l'eau, comme la plupart des dérivés simples du benzène. Cette solubilité est encore plus réduite pour le 2-nitrophénol, une nouvelle fois du fait de la liaison hydrogène intramoléculaire qui occupe le groupe hydroxyle, polaire, qui aurait tendance à former des liaisons hydrogène avec l'eau et favoriser ainsi sa solubilité. Ce phénomène est absent pour les isomères 3 et 4, qui ont une solubilité dans l'eau plus importante.
Synthèse
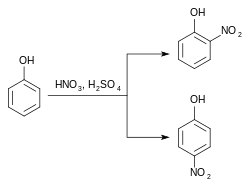
Le 2-nitrophénol et le 4-nitrophénol sont formés ensemble lors de la nitration du phénol par l'acide nitrique dilué. Cela s'explique par l'effet -I +M du groupe hydroxyle, orienteur otho-para.
Les deux composés peuvent être ensuite séparés par entraînement à la vapeur, où seul l'isomère ortho passe[5]. Il existe aussi de nouvelles méthodes de séparation exploitant le fait que seul l'orthonitrophénol est soluble dans le n-pentane[6].
Ces deux isomères peuvent ensuite être transformés en 2,4-dinitrophénol ou en acide picrique (2,4,6-trinitrophénol).
Le 3-nitrophénol est préparé en deux étapes, d'abord par halogénation du nitrobenzène (par exemple par Cl2/AlCl3), qui est elle orientée méta ; le composé ainsi obtenu subit ensuite une substitution nucléophile aromatique qui échange l'atome d'halogène par un groupe OH :
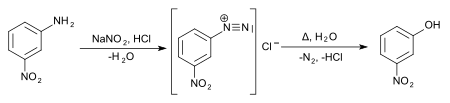
Une voie alternative pour cet isomère est la diazotation de la 3-nitroaniline ; le chauffage en présence d'eau du sel de diazonium permet d'obtenir le produit voulu.
Pour les trois isomères, il est également possible d'hydrogéner l'aminophénol correspondant, technique utilisée en production industrielle[7].
Utilisation
Les nitrophénols sont utilisés comme intermédiaires dans l'industrie chimique, pharmaceutique et l'armement. Ils sont notamment utilisés dans la production de colorants, du cuir, de caoutchouc, de pesticides, de fongicides et de munitions. Les 2- et 4-nitophénols sont notamment des précurseurs du 2,4-dinitrophénol et de l'acide picrique. Le 3-nitophénol est un précurseur de la mésalazine (acide 5-aminosalicylique), un médicament anti-inflammatoire. Les trois isomères peuvent également être facilement réduits en leurs équivalents aminophénols.
Notes et références
- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « Nitrophenole » (voir la liste des auteurs).
- Entrée « 2-Nitrophenol » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 15 février 2017 (JavaScript nécessaire).
- Entrée « 3-Nitrophenol » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 15 février 2017 (JavaScript nécessaire).
- Entrée « 4-Nitrophenol » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 15 février 2017 (JavaScript nécessaire).
- CRC Handbook of Tables for Organic Compound Identification, 3e éd., 1984 (ISBN 0-8493-0303-6).
- (de) Nitrierung von Phenol zu 2-Nitrophenol und 4-Nitrophenol, sur ioc-praktikum.de.
- A. Khazaei, M. A. Zolfigol, A. R. Moosavi-Zare et A. Zare, « An Efficient Method for the Nitration of Phenols with NaNO2 in the Presence of 3-Methyl-1-Sulfonic Acid Imidazolium Chloride », Transactions C: Chemistry and Chemical Engineering, vol. 17 (1), , p. 31–36.
- Gerald Booth, Nitro Compounds, Aromatic, dans Ullmann's Encyclopedia of Industrial Chemistry, 2007, Wiley-VCH, Weinheim, DOI 10.1002/14356007.a17_411.
Voir aussi
- Nitrophénol (famille)
- Dinitrophénol
- Trinitrophénol
- Tétranitrophénol
- Pentanitrophénol