Oxydoréduction en chimie organique
Les réactions d'oxydoréduction sont d'une importance capitale en chimie organique. Néanmoins, la structure des composés rend l'approche assez différente de ce que l'on observe en chimie inorganique ou en électrochimie notamment parce que les principes d'oxydoréduction traitent plutôt, dans ces deux derniers cas, de composés ioniques ; les liaisons chimiques dans une structure organique sont essentiellement covalentes, les réactions d'oxydoréduction organiques ne présentent donc pas de transfert d’électron dans le sens électrochimique du terme.
Détermination du nombre d'oxydation
On peut déterminer l'état d'oxydation d'un atome en calculant son nombre d'oxydation. Plus celui-ci est élevé, plus l'atome est oxydé.
La somme de tous les nombres d'oxydation d'une molécule est égale à la charge totale de la molécule, c'est-à-dire zéro dans la plupart des cas en chimie organique (molécules neutres). Le nombre d'oxydation du carbone est celui qu'il faut déterminer, le carbone est donc pris comme « référence » : le nombre d'oxydation des autres atomes est positif lorsque l'atome est moins électronégatif que le carbone, et inversement. Ainsi, sauf cas particuliers :
- un hydrogène ou un alcalin (première colonne de la classification périodique) a un nombre d'oxydation de +1 (en effet, il ne peut donner qu'un électron lors de la liaison chimique) ;
- un halogène, dans l'avant dernière colonne du tableau périodique, a un nombre d'oxydation de −1 lorsqu'il est combiné avec un élément moins électronégatif que lui (comme dans NaCl, no(Cl)=−1, mais no(Cl)=+1 dans l'hypochlorite ClOH car O est plus électronégatif que Cl) ;
- l'oxygène a un degré d'oxydation de –2, lorsqu'il est combiné avec des éléments moins électronégatifs mais combiné avec le seul élément le plus électronégatif que lui, le fluor, dans OF2, son n.o. sera de +2 ;
- l'azote −3.
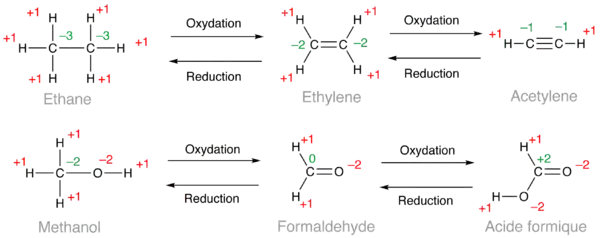
Dans les exemples ci-dessous, les nombres d'oxydation utilisés pour le calcul sont en rouge et le résultat en vert. Dans le cas de l'éthane, les six atomes d'hydrogène donnent un total de +6, ce qui conduit à calculer un nombre d'oxydation de −3 pour chaque carbone puisque 6 × (+1) + 2 × (−3) = 0. Dans le cas de l'éthylène, on obtient un nombre d'oxydation de −2 pour les deux carbones et −1 pour l'acétylène. D'après ces calculs, un alcène est une forme oxydée d'un alcane et un alcyne, une forme oxydée d'un alcène. De la même façon, on peut classer dans l'ordre croissant d'oxydation les alcools (méthanol ci-dessous), les aldéhydes (formaldéhyde) et les acides carboxyliques (acide formique).
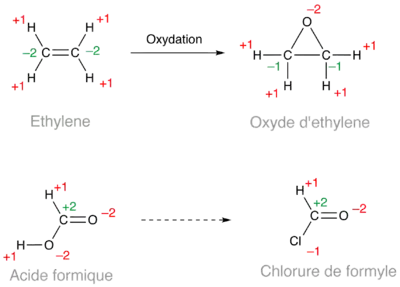
Est-ce qu'un époxyde est une forme oxydée d'un alcène ? En comparant l'éthylène et l'oxyde d'éthylène (ci-dessous), la réponse est oui. En revanche, l'acide formique et le chlorure de formyle ont le même degré d'oxydation.
Limites
Cette méthode qui est décrite ci-dessus n'est pas applicable lorsque les atomes de carbone sont de nature très différente à moins de considérer la molécule comme un assemblage de plusieurs fragments indépendants ou d'utiliser une méthode plus globale.
Exemples
En se fondant sur cette méthode, on a pour nombre d'oxydation du carbone C :
- nombre d’oxydation −4 pour le méthane ;
- nombre d’oxydation −3 pour l'éthane ;
- nombre d’oxydation −2 pour les alcènes, le méthanol, les halogénures d’alkyle, les amines ;
- nombre d’oxydation −1 pour les alcools primaires ;
- nombre d’oxydation 0 pour les alcynes(non terminaux), le formaldéhyde, les alcools secondaires, les diols conjugués ;
- nombre d’oxydation +1 pour les aldéhydes (sauf le formaldéhyde), les alcools tertiaires ;
- nombre d’oxydation +2 pour les cétones, les amides, le chloroforme ;
- nombre d’oxydation +3 pour les acides carboxyliques et les esters.
- nombre d’oxydation +4 pour le dioxyde de carbone, les carbonates et le tétrachlorométhane.
Réactions d'oxydoréduction rencontrées fréquemment en chimie organique
Le méthane est oxydé en dioxyde de carbone parce que le nombre d’oxydation passe de −4 à +4 (combustion). Comme réduction classique, on trouve la réduction des alcènes en alcanes et comme oxydation classique, on a l’oxydation des alcools en aldéhydes avec le dioxyde de manganèse.
Dans les oxydations, des électrons sont retirés et la densité électronique est diminuée. Dans les réductions, cette densité augmente quand des électrons sont ajoutés à la molécule. Cette terminologie est toujours centrée sur le composé organique. Une cétone est toujours réduite par l’hydrure d'aluminium et de lithium mais oxyder cet hydrure par la cétone ne se dit pas. Dans beaucoup d’oxydations, il y a retrait de protons de la molécule organique et, au contraire, la réduction ajoute des protons à cette molécule (cf. paragraphe suivant).
Beaucoup de réactions indiquées comme réductions sont aussi citées dans d’autres catégories. Par exemple, la transformation de la cétone en alcool par l’hydrure d’aluminium et de lithium peut être considérée comme une réduction mais l’hydrure est aussi un bon nucléophile dans les substitutions nucléophiles. Beaucoup de réductions en chimie organique ont des mécanismes couplés avec des radicaux libres comme intermédiaires. De vraies réactions rédox ont lieu dans les synthèses organiques électrochimiques. Ces réactions chimiques peuvent avoir lieu dans une cellule électrolytique comme lors de l’électrolyse de Kolbe.
Un classement ?
Il n'est pas possible de faire un classement simple d'un éventuel pouvoir oxydant ou pouvoir réducteur d'un réactif parce son pouvoir oxydatif/réducteur dépend :
- de la fonction à oxyder/réduire ;
- du solvant ;
- de l'ajout d'un acide de Lewis (SnCl2, AlCl3, etc.).
En fait, c'est principalement l'état de transition qui va déterminer comment la réaction va se dérouler.
Hydrogénation/déshydrogénation
Si l'on compare l'éthane et l'éthylène (ci-dessus), on constate qu'une oxydation est formellement une perte d'une molécule d'hydrogène H2 (déshydrogénation), et la réduction est la réaction inverse (hydrogénation).
- H3C-CH3 → H2C=CH2 + H2
L'hydrogénation est une réaction très utilisée en chimie organique. Elle nécessite la présence d'un catalyseur métallique qui va activer l'hydrogène gazeux en le dissociant. Cette réaction est appelée hydrogénation catalytique. Les catalyseurs sont principalement composés de palladium, de platine, de nickel ou de rhodium et ils peuvent être solubles (catalyseur homogène) ou non (catalyseur hétérogène) dans le milieu réactionnel.
L'hydrogénolyse est un cas particulier de l'hydrogénation catalytique. Dans cette réaction, c'est une liaison simple qui est hydrogénée, ce qui provoque la coupure (lyse) de la liaison. Par exemple (en notant Ph un groupe phényle) :
- R-O-CH2-Ph + H2 → R-OH + CH3-Ph
Mécanismes d'oxydoréduction en chimie organique
Réductions organiques
Divers mécanismes existent pour les réductions organiques :
- transfert direct lors d’une réduction du premier électron comme la réduction de Birch par exemple ;
- transfert d’hydrure avec comme exemple l’hydrure d’aluminium et de lithium ou d'autres hydrures d'aluminium ou de bore par exemple ; les hydrures de métaux alcalins ou alcalinoterreux ne sont en général pas réducteurs (ils sont très basiques mais pas nucléophiles) ;
- réduction par l’hydrogène avec un catalyseur comme le catalyseur de Lindlar ou le catalyseur d’Adkins ;
- réaction de dismutation comme la réaction de Cannizzaro.
Certaines réductions dans lesquelles seul un changement d’état d’oxydation est observé comme la réaction de Wolff-Kishner, n’entrent dans aucun mécanisme de réaction de réduction.
Oxydations organiques
Divers mécanismes existent pour les oxydations organiques :
- simple transfert d’électron ;
- oxydation vers des intermédiaires esters avec l’acide chromique ou le dioxyde de manganèse ;
- transfert d’atome d’hydrogène dans l’halogénation radicalaire ;
- oxydation avec l’oxygène (combustion) ;
- oxydation avec l’ozone dans les ozonizations et les peroxydations ;
- oxydations avec un mécanisme d’élimination comme celle de Swern, de Kornblum et avec des réactifs comme l’acide IBX et le periodinane de Dess-Martin (dans les deux cas, un composé d'iode hypervalent) ;
- oxydation par le sel de Frémy modifié ou TEMPO.
Oxydation et réduction par classe de composés
Références
- Lire l'archive en ligne, Organic Syntheses, vol. 68, p. 182, 1990.
- Lire en ligne, Organic Syntheses, vol. 49, p. 53, 1969.