Acide de Lewis
Un acide de Lewis (du nom du chimiste américain Gilbert Newton Lewis qui en a donné la définition) est une entité chimique dont un des atomes la constituant possède une lacune électronique, ou case quantique vide, ce qui la rend susceptible d'accepter un doublet d'électrons, et donc de créer une liaison covalente avec une base de Lewis (donneuse de doublet électronique provenant d'un doublet non liant). Cette lacune peut être notée en représentation de Lewis par un rectangle vide. Par exemple, des composés comme et possèdent une lacune électronique et sont donc des acides de Lewis ; les organomagnésiens R-Mg-X (très utilisés en chimie organique) sont des acides de Lewis.
Les réactions acide-base selon Lewis sont donc en fait simplement des réactions de complexation.
La définition d'un acide de Lewis semble plus générale que celle de Brønsted, mais elle n'est qu'une autre façon de modéliser des réactions. En chimie organique notamment, les acides au sens de Brønsted ne sont pas nécessairement des acides au sens de Lewis. Les acides de Lewis et de Brønsted ont en commun d'acidifier les solutions (en général) lorsqu'on les y introduit, pourvu que cette notion soit adaptée au solvant utilisé (solvants protiques…). Pour les solutions aqueuses, c'est le cas.
Différences et liens avec d'autres notions
Différence avec les oxydants
Il est essentiel de noter, afin de les différencier des réactions d'oxydoréduction, que ce sont des doublets électroniques qui sont mis en jeu, que la réaction acide + base de Lewis aboutit à la création de liaisons covalentes et que les nombres d'oxydation des éléments ne sont pas modifiés.
Contre-exemple : une espèce capable de recevoir un ou plusieurs électrons, éventuellement en créant des liaisons covalentes, mais dont le nombre d'oxydation s'en trouve diminué (réduction) n'est pas un acide de Lewis mais un oxydant.
Différence et lien avec les électrophiles
Un acide de Lewis est un accepteur de paire électronique, possédant donc une orbitale vide ; cela concerne toutes les espèces possédant une orbitale atomique ou une orbitale moléculaire libre, c'est donc en général un électrophile[1].
Une base de Lewis est un donneur de paire électronique, possédant un doublet libre (doublet non liant), c'est donc en général un nucléophile.
La notion d'électrophilie est proche de celle d'acide de Lewis. La différence est une question de point de vue : l'acide de Lewis est un point de vue thermodynamique alors que l'électrophile est un point de vue cinétique. Ainsi, les acides de Lewis se comparent avec des constantes d'équilibre alors que les électrophiles se comparent avec des constantes de vitesse de réaction.
Il en va de même pour les notions de base de Lewis (classement par la constante d'équilibre thermodynamique) et de nucléophile (classement par constantes cinétique)), voir illustration plus bas dans cet article.
Différences et lien avec les acides de Brønsted
On dit généralement d'un composé qu'il est un acide en utilisant la définition des acides de Brønsted selon laquelle « Un composé chimique noté AH est un acide s'il est capable de libérer un ion H+ » selon le mécanisme AH ⇒ A− + H+. Cela se traduit en milieu aqueux par la création d'ions hydronium (ou oxonium) H3O+ (ou H+(aq)) puisque l'ion H+ libéré s'associe à une molécule d'eau. La concentration de ces ions H3O+ définit le potentiel hydrogène pH = –log[H3O+], qui représente une mesure de l'acidité d'une solution aqueuse.
La définition d'un acide de Lewis (1923)[2] - [3] est différente de celle de Brønsted et ne l'inclut pas. Par cette définition, un acide est un composé chimique qui peut, au cours d’une réaction, accepter une paire d’électrons (un doublet) sans pour autant que les nombres d'oxydation des éléments ne changent. C'est une réaction de complexation.
L'introduction d'un acide de Lewis (par exemple AlCl3) dans l'eau pure conduit presque toujours à une diminution de son pH. Effectivement, l'eau est une base de Lewis, elle se fixe sur l'acide de Lewis par un doublet non liant provenant de l'oxygène qui acquiert alors une charge fictive positive qui disparaît ensuite en causant la déprotonation et la libération de H+ dans le milieu aqueux faisant baisser le pH. Ceci est sans doute à l'origine de la qualification de « acide » pour ces composés qui acidifient donc généralement les solutions aqueuses par une libération indirecte de H+ n'en possédant pas au départ.
Le produit résultant de la réaction d'un acide et d'une base de Lewis est généralement unique, c'est un adduit (produit résultant d'une réaction addition) et parfois aussi un complexe (liaison dative ou coordinative).
Les acides de Lewis possèdent une lacune électronique dans leur structure ce qui n'est pas forcément le cas des acides de Brønsted.
La plupart des cations métalliques (Al3+, Fe3+…) sont des acides de Lewis.
Exemples de structures
Quelques exemples de structures d'acide de Lewis sont illustrés ci-dessous. Les lacunes électroniques sont représentées au moyen d'un petit rectangle dans les structures de Lewis.
Structures typiques d'acides de Lewis Espèce Formule Structure de Lewis Borane BH3 
Fluorure d'aluminium AlF3 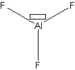
Proton en solution H+ 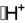
Bromure de méthylmagnésium CH3MgBr 
Exemples de réactions entre acides et bases de Lewis
Les réactions ci-dessous illustrent quelques interactions entre acides et bases de Lewis :
Un exemple typique de réaction impliquant un acide de Lewis est la réaction d’alkylation de Friedel-Crafts. L’étape principale est l’acceptation par AlCl3 (acide de Lewis) d'un anion chlorure Cl– (base de Lewis) formant le complexe AlCl4− et créant ainsi un ion carbonium R+ électrophile :
- RCl + AlCl3 → R+ + AlCl4−
Acidité de Lewis et électrophilie
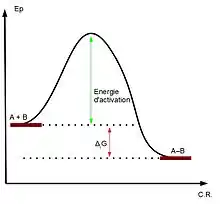
La notion d'acide de Lewis est une notion thermodynamique, c'est-à-dire qu'elle est liée à un équilibre chimique, au contraire de la notion d'électrophilie qui est de nature cinétique et caractérise donc la vitesse de réaction avec un autre composé.
Considérons ainsi un acide de Lewis A, une base de Lewis B et la réaction .
Sur un diagramme d'énergie potentielle tel qu'illustré ci-contre, une plus forte électrophilie de A diminuera l'énergie d'activation et facilitera la réaction (barrière d'énergie moindre), tandis qu'une plus grande acidité de Lewis augmentera l'énergie libre de la réaction (ΔG).
La constante d'équilibre K de la réaction considérée dépend des concentrations en produits [AB] et réactifs [A] × [B] de la réaction selon la relation :
- K = [AB] / [A] × [B]
La constante d'équilibre K est reliée à ∆G par la relation :
- ∆G = –RT lnK
où, R est la constante universelle des gaz parfaits (8,314 J K−1 mol−1), T la temperature absolue exprimée en Kelvin, et ln le logarithme népérien (ou naturel) de K.
Inversement :
- K = e(–∆G/RT).
Voir aussi
Références
- Paul Arnaud (préf. Guy Ourisson), Cours de chimie organique, Paris, Éditions Dunod, , 524 p. (ISBN 978-2-040-19716-2, BNF 35098830).
- Gilbert Newton Lewis, Valence and the Structure of Atoms and Molecules, New York, New York, U.S.A., Chemical Catalog Company, (lire en ligne), p. 142 From p. 142: "We are inclined to think of substances as possessing acid or basic properties, without having a particular solvent in mind. It seems to me that with complete generality we may say that a basic substance is one which has a lone pair of electrons which may be used to complete the stable group of another atom, and that an acid substance is one which can employ a lone pair from another molecule in completing the stable group of one of its own atoms. In other words, the basic substance furnishes a pair of electrons for a chemical bond, the acid substance accepts such a pair."
- Miessler, L. M., Tar, D. A., (1991) p. 166 – Table of discoveries attributes the date of publication/release for the Lewis theory as 1923.


