Halogénation radicalaire
En chimie, l'halogénation radicalaire est un type d'halogénation. Cette réaction chimique peut être de type addition sur les alcènes ou de type substitution pour les alcanes et les aromatiques. La formation du radical est due dans les deux cas à l'effet de la chaleur ou de rayons ultraviolets.
Réaction de substitution
Exemple de la substitution radicalaire du méthane et du chlore :
- l'étape d’initiation produit un radical halogène par homolyse :
![]()
- suivie d’une réaction en chaîne (propagation)
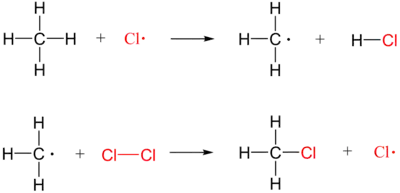
- puis d'une étape de terminaison (recombinaison des radicaux)
- La réaction globale est :
CH4 + Cl2 → CH3Cl + HCl.
L'ordre de réactivité des halogènes est F2 >> Cl2 > Br2 >> (I2).
Contrôle de l'halogénation
- L’halogénation ne s’arrête pas à la monosubstitution. Dépendant des conditions de chloration du méthane, on peut obtenir du dichlorométhane, du chloroforme, et du tétrachlorure de carbone.
- Pour beaucoup d'hydrocarbures, il existe plus qu’un produit possible dépendant où il y a substitution de l'hydrogène. Le butane (CH3-CH2-CH2-CH3), par exemple peut être chloré sur la position « 1 » pour donner le 1-chlorobutane (CH3-CH2-CH2-CH2Cl) ou sur la position « 2 » pour obtenir 2-chlorobutane (CH3-CH2-CHCl-CH3). La proportion des produits de réaction dépendent des vitesses relatives de réaction : dans le cas du butane, la réaction sur la position « 2 » est plus rapide et le 2-chlorobutane est produit en plus grande quantité. La chloration, en général, est moins sélective que la bromation. La fluoration est non seulement encore moins sélective que la chloration, mais est très exothermique et il y a risque d’explosion. L'iodation n'est pas, en général, possible parce que très endothermique : les radicaux libres iodure sont moins réactifs que ceux des autres halogènes.
Cet article est issu de wikipedia. Text licence: CC BY-SA 4.0, Des conditions supplémentaires peuvent s’appliquer aux fichiers multimédias.