Nitrobenzène
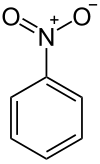
Le nitrobenzène, de formule chimique C6H5NO2, est un composé organique aromatique connu également sous le nom nitrophène ou essence de mirbane. Il se présente sous la forme d'un liquide incolore ou de cristaux jaunes suivant la température. C'est un composé toxique, possédant une odeur d'amande.
| Nitrobenzène | |
| |
| Identification | |
|---|---|
| Nom UICPA | Nitrobenzène |
| Synonymes |
Nitrobenzol |
| No CAS | |
| No ECHA | 100.002.469 |
| No CE | 202-716-0 |
| Apparence | liquide jaune pâle, huileux, d'odeur caractéristique, Amande[1]. |
| Propriétés chimiques | |
| Formule | C6H5NO2 [Isomères] |
| Masse molaire[2] | 123,109 4 ± 0,006 g/mol C 58,54 %, H 4,09 %, N 11,38 %, O 25,99 %, |
| Moment dipolaire | 4,22 ± 0,08 D[3] |
| Diamètre moléculaire | 0,584 nm[4] |
| Propriétés physiques | |
| T° fusion | 6 °C[1] |
| T° ébullition | 211 °C[1] |
| Solubilité | 1,9 g/l dans l'eau (20 °C) 2,1 g/l dans l'eau (25 °C) |
| Paramètre de solubilité δ | 20,5 MPa1/2 (25 °C)[5]; 22,1 J1/2·cm-3/2 (30 °C)[4] |
| Masse volumique | 1,173 2 g·cm-3 (25 °C)[6] |
| T° d'auto-inflammation | 480 °C[1] |
| Point d’éclair | 88 °C (coupelle fermée)[1] |
| Limites d’explosivité dans l’air | 1,8–40 % vol[1] |
| Pression de vapeur saturante | à 20 °C : 20 Pa[1] |
| Viscosité dynamique | 2 × 10-3 Pa×s |
| Vitesse du son | 1 463 m·s-1 à 25 °C [7] |
| Thermochimie | |
| ΔfH0liquide | 12.5 kJ/mol[8] |
| Cp | 181 J/mol·K[9]
|
| Propriétés optiques | |
| Indice de réfraction | 1,550[4] |
| Précautions | |
| SGH[11] | |
   Danger |
|
| SIMDUT[12] | |
  B3, D1A, D2A, |
|
| NFPA 704 | |
| Transport | |
| Classification du CIRC | |
| Groupe 2B : Peut-être cancérogène pour l'homme[13] | |
| Inhalation | toxique |
| Peau | Après contact avec la peau, se laver immédiatement et abondamment avec de l'eau |
| Ingestion | Toxique |
| Écotoxicologie | |
| LogP | 1,86[1] |
| Seuil de l’odorat | bas : 0,07 ppm haut : 1,9 ppm[14] |
| Unités du SI et CNTP, sauf indication contraire. | |
Le nitrobenzène est utilisé principalement comme solvant et comme agent d'oxydation modéré. Il est utilisé en particulier pour la fabrication de l'aniline, mais également pour la fabrication de vernis ou de cirage.
Propriétés physico-chimiques
Le nitrobenzène est un liquide incolore toxique et inflammable. Il possède un indice de réfraction élevé. Il est peu soluble dans l'eau, mais possède une bonne solubilité dans les alcools, dans l'éther et dans le benzène.
Utilisation
Le nitrobenzène est un intermédiaire de synthèse important utilisé à grande échelle pour la fabrication d'un grand nombre de composés chimiques. Il est utilisé principalement dans la production de l'aniline et de ses dérivés comme le diisocyanate de diphénylméthylène. Il est également utilisé pour la fabrication de caoutchouc synthétique, de pesticides, de colorants et de médicaments, ainsi que de vernis pour les sols et de cirage. Il est utilisé dans la fabrication de paracétamol. Il est utilisé comme solvant dans des peintures et dans d'autres types de produits pour masquer les odeurs désagréables. Redistillé sous forme d'essence de mirbane, il a été utilisé comme parfum pour des savons. Toutefois, son utilisation dans les produits cosmétiques a été interdite du fait de sa toxicité.
Le nitrobenzène est utilisé pour moduler les rayons lumineux par effet Kerr optique du fait de l'effet électro-optique important qu'il présente sous l'application d'une tension électrique.
Il est également utilisé en apiculture comme répulsif des abeilles pour diriger un essaim ou pour la récolte du miel, ce qui cause parfois une mortalité relative des abeilles.
Production et synthèse
L'une des méthodes de fabrication du nitrobenzène est la nitration du benzène grâce à l'acide sulfonitrique. La première étape consiste en une protonation de l'acide nitrique :
Celui-ci est instable et se dissocie :
Le cation nitronium obtenu réagit avec le benzène par substitution électrophile aromatique :
ce qui permet d'obtenir le nitrobenzène. L'ion H+ restant réagit avec l'ions HSO4− obtenu au cours de la première étape.
La production de nitrobenzène aux États-Unis était de 617 000 tonnes en 1991.
Sécurité et toxicité
Le nitrobenzène peut causer des empoisonnements graves par ingestion, inhalation ou contact avec la peau. Il réagit avec l'hémoglobine du sang et l'empêche de se lier à l'oxygène. Il peut également entraîner des troubles du système nerveux central, causant une sensation de faiblesse, des maux de tête et des vomissements. Un taux élevé de nitrobenzène peut entraîner la mort en moins d'une heure. Par ailleurs, son effet toxique est exacerbé par la prise d'alcool.
Phrases de risque et conseils de prudence d'après la fiche internationale

- R: 26/27/28 (Très toxique par inhalation, par contact avec la peau et par ingestion)
- R: 33 (Danger d’effets cumulatifs)
- S: 1/2 (Conserver sous clé et hors de portée des enfants)
- S: 28 (Après contact avec la peau, se laver immédiatement et abondamment avec de l'eau)
- S: 36/37 (Porter un vêtement de protection et des gants appropriés.)
- S: 45 (En cas d’accident ou de malaise consulter immédiatement un médecin et lui montrer l’emballage ou l’étiquette)
Phrases de risque et conseils de prudence d'après l'INRS
- R: 23/24/25 (Toxique par inhalation, par contact avec la peau et par ingestion)
- R: 48/23/24 (Toxique : risque d'effets graves pour la santé en cas d'exposition prolongée par inhalation et par contact avec la peau)


- R: 51/53 (R 51/53 Toxique pour les organismes aquatiques, peut entraîner des effets néfastes à long terme pour l'environnement aquatique)
- R: 62 (Risque possible d’altération de la fertilité)
- R: 68 (Possibilité d'effets irréversibles)
- S: 28 (Après contact avec la peau, se laver immédiatement et abondamment avec de l'eau)
- S: 36/37 (Porter un vêtement de protection et des gants appropriés)
- S: 45 (En cas d’accident ou de malaise consulter immédiatement un médecin et lui montrer l’emballage ou l’étiquette)
- S: 61 (Éviter le rejet dans l’environnement. Consulter les instructions spéciales/la fiche de données de sécurité)
Références
- NITROBENZENE, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) David R. Lide, Handbook of chemistry and physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 9-50
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, England, John Wiley & Sons Ltd, , 239 p. (ISBN 978-0-471-98369-9, LCCN 98018212)
- (en) James E. Mark, Physical Properties of Polymer Handbook, Springer, , 2e éd., 1076 p. (ISBN 978-0-387-69002-5 et 0-387-69002-6, lire en ligne), p. 294
- (en) J. G. Speight, Norbert Adolph Lange, Lange's handbook of chemistry, New York, McGraw-Hill, , 16e éd., 1623 p. (ISBN 978-0-07-143220-7, LCCN 84643191), p. 2.289
- (en) W. M Haynes, Handbook of chemistry and physics, Boca Raton, CRC, 2010-2011, 91e éd., 2610 p. (ISBN 978-1-4398-2077-3), p. 14-40
- Pedley, J.B.; Naylor, R.D.; Kirby, S.P., Thermochemical Data of Organic Compounds, Chapman and Hall, New York, 1986, 1-792.
- Lainez, A.; Rodrigo, M.; Roux, A.H.; Grolier, J.-P.E.; Wilhelm, E., Relations between structure and thermodynamic properties. Heat capacities of polar substances (nitrobenzene and benzonitrile) in alkane solutions, Calorim. Anal. Therm., 1985, 16, 153-158.
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams : Organic Compounds C8 to C28, vol. 2, Huston, Texas, Gulf Pub. Co., , 396 p. (ISBN 978-0-88415-858-5, LCCN 96036328)
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- « Nitrobenzène » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 2B : Peut-être cancérogènes pour l'homme », sur http://monographs.iarc.fr, CIRC, (consulté le )
- « Nitrobenzene »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?), sur hazmap.nlm.nih.gov (consulté le )








