Acide nitrique
L’acide nitrique est un composé chimique de formule HNO3. Liquide incolore lorsqu'il est pur, cet acide minéral fort (de pKa = −1,37) est en pratique utilisé en solution aqueuse concentrée. Il était autrefois appelé acide azotique par les chimistes du XIXe siècle, mais aussi jadis esprit de nitre par les alchimistes, ou encore « eau-forte» ou aquae fortis par les graveurs sur cuivre.
| Acide nitrique | |
    |
|
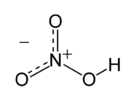
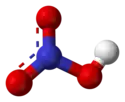
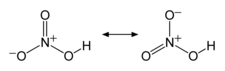
| Structure de l'acide nitrique. | |
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.028.832 |
| No CE | 231-714-2 |
| No RTECS | QU5775000 |
| PubChem | 944 |
| ChEBI | 48107 |
| SMILES | |
| InChI | |
| Apparence | Liquide incolore à jaune, d’odeur acre (70 %)[1]. Liquide transparent ou brun. |
| Propriétés chimiques | |
| Formule | HNO3 [Isomères] |
| Masse molaire[2] | 63,012 8 ± 0,001 2 g/mol H 1,6 %, N 22,23 %, O 76,17 %, |
| pKa | −1,37 |
| Moment dipolaire | 2,17 ± 0,02 D[3] |
| Propriétés physiques | |
| T° fusion | −41,6 °C (70 %)[1] |
| T° ébullition | 121 °C (70 %)[1] |
| Miscibilité | dans l'eau |
| Masse volumique | 1,4 g cm−3 (70 %)[1] |
| Pression de vapeur saturante | à 20 °C : 6,4 kPa (70 %)[1] |
| Viscosité dynamique | 0,88 mPa s à 20 °C |
| Thermochimie | |
| S0liquide, 1 bar | 266,39 J K−1 mol−1 |
| ΔfH0liquide | −174 kJ mol−1 |
| ΔvapH° | 39,1 kJ mol−1 (1 atm, 25 °C)[4] |
| Propriétés électroniques | |
| 1re énergie d'ionisation | 11,95 ± 0,01 eV (gaz)[5] |
| Précautions | |
| SGH[6] | |
   Danger |
|
| SIMDUT[7] | |
  C, E, |
|
| NFPA 704 | |
| Transport[6] | |
| Écotoxicologie | |
| Seuil de l’odorat | bas : 0,27 ppm[9] |
| Unités du SI et CNTP, sauf indication contraire. | |
À concentration supérieure à 86 %, il est baptisé « acide nitrique fumant », qualifié de « blanc » ou « rouge » selon qu'il est pauvre ou riche en dioxyde d'azote NO2. Coupé avec un cinquième ou un quart de peroxyde d'azote N2O4 et moins d'un pour cent de fluorure d'hydrogène HF, il donne l'acide nitrique fumant rouge inhibé, plus connu sous le sigle anglophone IRFNA, comme ergol stockable utilisé notamment comme oxydant (comburant) pour la propulsion des missiles soviétiques SS-1 Scud dans les années 1950. À concentration supérieure à 95 %, il développe rapidement à température ambiante une coloration jaunâtre due à sa décomposition libérant du dioxyde d'azote NO2.
L'acide nitrique a d'abord été obtenu par les anciens chimistes à partir des différents nitrates naturels, en particulier à la fin du XIXe siècle à partir des nitrates du Chili dénommés également sels de caliche. Il faut attendre le progrès de la chimie des gaz pour concevoir une synthèse chimique à partir de l'air en four électrique, par exemple par le procédé Birkeland et Eyde. Mais le procédé Ostwald a également permis d'utiliser l'ammoniac NH3 synthétisé par le procédé Haber-Bosch. Ces voies chimiques modernes mises au point à la Belle Époque se sont révélées cruciales pour l'industrie chimique des dérivés nitrés explosifs, comme la nitroglycérine, les nitrophénols, l'acide picrique, le trinitrotoluène (TNT), matières demandées par l'industrie d'armement moderne, mais aussi la fabrication des matières colorantes, comme le jaune de Martins, ou celle des parfums, tels le musc artificiel.
L'acide nitrique entre dans la composition des pluies acides, où il se forme par hydratation du dioxyde d'azote NO2, un important polluant atmosphérique issu des différents oxydes d'azote NOx rejetés par les différentes combustions :
Histoire
L’acide nitrique a été synthétisé pour la première fois à la fin du VIIIe siècle par l’alchimiste Jabir Ibn Hayyan qui l’obtint en chauffant du salpêtre KNO3 en présence de sulfate de cuivre CuSO4⋅5H2O et d’alun KAl(SO4)2⋅12H2O[10]. Au XIIIe siècle, Albert le Grand l’utilise pour séparer l’or et l’argent.
Au milieu du XVIIe siècle, Johann Rudolf Glauber obtient l’acide nitrique par distillation du salpêtre en présence d’acide sulfurique, procédé utilisé en laboratoire jusqu’au XXIe siècle. Au cours du XVIIIe siècle, Antoine Lavoisier montre que l’acide nitrique contient à la fois de l’oxygène et de l’azote, la composition précise étant déterminée plus tard par Henry Cavendish.
La fabrication industrielle d’acide nitrique ne prend son essor qu’au cours du XIXe siècle, le salpêtre et l’acide sulfurique étant alors bon marché et disponibles en grandes quantités. En 1838, Frédéric Kuhlmann découvre qu’il est possible de l’obtenir par oxydation de l’ammoniac en présence de platine. Cependant, l’ammoniac nécessaire demeure d’un coût beaucoup trop élevé jusqu’à l’invention du procédé Haber par Fritz Haber en 1909 et de son industrialisation sous la supervision de Carl Bosch de 1909 à 1913 (procédé Haber-Bosch). Wilhelm Ostwald met alors au point le procédé Ostwald qui permet de fabriquer de l’acide nitrique par oxydation de l’ammoniac, procédé qui demeure le plus utilisé au XXIe siècle.
Propriétés physico-chimiques
L’acide nitrique pur est un liquide incolore et inodore ; diverses impuretés le colorent souvent en jaune brun. À température ambiante, il libère des fumées rouges ou jaunes, du fait de sa décomposition partielle en dioxyde d’azote sous l’effet de la lumière.
L’acide nitrique est un agent oxydant puissant. Ses réactions avec des composés comme les cyanures, carbures, et poudres métalliques peuvent être explosives.
Les réactions de l’acide nitrique avec de nombreux composés organiques ou certains mélanges, comme l'essence de térébenthine, sont violentes, le mélange étant hypergolique, c’est-à-dire auto-inflammable.
C’est un acide fort de pKa = −1,37 : en solution aqueuse, il se dissocie complètement en un anion nitrate NO3− et un proton hydraté (cation hydronium H3O+). Les sels de l’acide nitrique qui contiennent l’anion nitrate sont appelés des « nitrates ». La quasi-totalité des nitrates sont très solubles dans l’eau.
L’acide nitrique et ses sels ne doivent pas être confondus avec l’acide nitreux HNO2 et ses sels, les nitrites, qui contiennent l'anion nitrite NO2−.
| Gew % HNO3 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Masse volumique (g/cm3) | 1,00 | 1,05 | 1,12 | 1,18 | 1,25 | 1,31 | 1,37 | 1,42 | 1,46 | 1,48 | 1,513 |
| Viscosité (mPa s) | 1,00 | 1,04 | 1,14 | 1,32 | 1,55 | 1,82 | 2,02 | 2,02 | 1,84 | 1,47 | 0,88 |
| Tfus (°C) | 0 | –7 | –17 | –36 | –30 | –20 | –22 | –41 | –39 | –60 | –42 |
| Téb (°C) | 100,0 | 101,2 | 103,4 | 107,0 | 112,0 | 116,4 | 120,4 | 121,6 | 116,6 | 102,0 | 86,0 |
| p(HNO3) (mbar) | 0,0 | 0,0 | 0,0 | 0,0 | 0,0 | 0,3 | 1,2 | 3,9 | 14,0 | 36,0 | 60,0 |
| p(H2O) (mbar) | 23,3 | 22,6 | 20,2 | 17,6 | 14,4 | 10,5 | 6,5 | 3,5 | 1,2 | 0,3 | 0,0 |
| Molarité (mol/l) | 0 | 1,7 | 3,6 | 5,6 | 7,9 | 10,4 | 13,0 | 15,8 | 18,5 | 21 | 24,01 |
Réactions chimiques comportant l'acide nitrique
Action sur les métaux
L’acide nitrique réagit différemment des autres acides forts (HCl, H2SO4) sur les métaux en raison des propriétés oxydantes du radical NO3. Ainsi, HNO3 réagissant sur un métal ne donne jamais de dégagement d'hydrogène H2, contrairement à la plupart des autres acides. La formule suivante donne l’équation de la réaction globale pour toute réaction chimique entre l’acide nitrique HNO3 et un métal M de valence n < 4 :
Les métaux tels que le nickel, le cobalt, le cuivre, le mercure, l'argent, le plomb, le sélénium, le bismuth, le zinc et le cadmium se dissolvent dans l'acide nitrique. D'autres métaux forment un film de passivation, parmi lesquels figurent l'aluminium, le chrome, le titane, le zirconium, le hafnium, le gallium, l'indium, le niobium, le tantale, le thorium et le bore. Les alcalino-terreux se dissolvent dans l'acide dilué, mais passivent dans l'acide concentré. Les alliages à base de fer se dissolvent mieux dans l'acide dilué[11].
Production et synthèse
L’acide nitrique dilué est obtenu en mélangeant du dioxyde d’azote NO2 avec de l’eau ; les solutions commerciales comprennent généralement entre 52 % et 68 % d’acide nitrique. Les solutions plus concentrées sont obtenues par distillation. L’acide nitrique formant un azéotrope avec l’eau dans une proportion de 68 % d’acide nitrique et 32 % d’eau, l’obtention d’acide nitrique très pur impose de le distiller en présence d’acide sulfurique. Quand la solution comprend plus de 86 % d’acide nitrique, il est dit « fumant » et existe en deux variétés : blanche et rouge. L’acide nitrique fumant blanc est aussi appelé 100 % car quasiment (moins de 2 %) sans eau.
La production commerciale de l’acide nitrique est faite par le procédé Ostwald et se réalise en trois étapes à partir de l’ammoniac :
En premier lieu, l’ammoniac NH3 est oxydé par l'oxygène O2 en présence d’un catalyseur comme le platine rhodié à 10 % pour former du monoxyde d’azote NO, étape fortement exothermique qui produit également de la vapeur d'eau H2O :
Puis le monoxyde d’azote est oxydé par l'oxygène O2 et produit du dioxyde d’azote NO2 :
Enfin, le dioxyde d’azote est dissous dans l’eau selon la réaction :
pour produire l’acide nitrique dilué.
Le monoxyde d’azote produit est recyclé, et l’acide nitrique concentré par distillation jusqu’à un maximum de 68 % (azéotrope du mélange acide nitrique - eau). Les concentrations plus élevées sont atteintes par traitement au nitrate de magnésium Mg(NO3)2. Globalement, ce procédé permet d’atteindre un rendement de 96 %.
L’acide nitrique peut également être obtenu en faisant réagir du nitrate de potassium KNO3 et de l’acide sulfurique concentré H2SO4, puis en distillant le mélange à 83 °C jusqu’à ce qu’il ne reste plus dans le milieu qu’un solide blanc cristallisé composé de KHSO4. L’acide nitrique obtenu est de acide nitrique fumant rouge. L’acide nitrique fumant blanc peut être obtenu en éliminant les oxydes d’azote dissous en réduisant la pression à 1/3 d’atmosphère environ durant 10-30 minutes. L’acide nitrique fumant rouge contient une quantité non négligeable d’oxydes d’azote, d’où sa couleur rouge, tandis que l’acide nitrique fumant blanc ne peut contenir qu’un maximum de 0,5 % de NO2.
La production mondiale annuelle d’acide nitrique est de l’ordre de soixante millions de tonnes.
Utilisations
Utilisé communément comme un réactif de laboratoire, notamment pour des réactions de nitration de composés organiques, il est utilisé pour fabriquer par synthèse chimique industrielle des engrais comme le nitrate d’ammonium NH4NO3 et le nitrate de calcium Ca(NO3)2. 75 % de la production d'acide nitrique est utilisée dans la fabrication d’engrais azotés.
L'acide nitrique réagit avec la roche calcaire ou mieux le minéral calcite CaCO3 pour former le nitrate de chaux en décomposant l'anion carbonate.
- CaCO3+ 2 HNO3 aqueux → Ca(NO3)2 + H2O + CO2 gaz
L'ammoniaque de synthèse forme avec l'acide nitrique le nitrate d'ammonium monohydraté.
- NH4OH ammoniaque + HNO3 aqueux → NH4NO3. H2O
Les autres applications concernent la fabrication des explosifs, des précurseurs du nylon et des composés organiques spéciaux, comme certains ligands tels les imidazoles.
L'acide nitrique dilué chaud oxyde la fonction alcool primaire des aldoses ou des acides aldoniques en acides carboxyliques. On obtient ainsi des acides dicarboxyliques nommées acides aldariques.
Comme il réagit avec la plupart des métaux (sauf l'or, l'iridium et le platine), il est très utilisé en métallurgie et en microélectronique. Mélangé avec l'acide chlorhydrique, il forme l'eau régale, l'un des rares réactifs capables de dissoudre l'or, le platine, l'iridium.
Il a été l'un des premiers ergols oxydants de propergols liquides pour moteurs-fusées, associé au RP-1, à l'UDMH (diméthylhydrazine asymétrique H2N-N(CH3)2) et au MMH (monométhylhydrazine H2N-NHCH3) comme carburants. Dans cette utilisation, le caractère très corrosif de l'acide nitrique a été longtemps un problème, résolu par l'addition de 0,5 % d'acide fluorhydrique qui assure la passivation du métal des réservoirs et des conduits, dans ce qu'on appelle l'acide nitrique fumant rouge inhibé. Il est remplacé depuis le début des années 1990 par le peroxyde d'azote N2O4. Il est aussi utilisé à faible dose avec des décapants industriels. On obtient de la nitroglycérine en le mélangeant avec de la glycérine :
- C3H5(OH)3 + 3 HNO3 → C3H5(NO3)3 + 3 H2O.
Il a été utilisé au XIXe siècle pour la conservation de la viande.
Sécurité
L’acide nitrique est un acide fort, qui peut provoquer de graves brûlures. L’inhalation des vapeurs peut entraîner un œdème pulmonaire. Au contact d’acide nitrique concentré, la peau humaine se teint en jaune du fait de réactions avec la kératine. C’est un composé modérément toxique avec une dose létale de 430 mg kg−1. C’est également un oxydant puissant qui réagit vivement avec les réducteurs et les matières combustibles pouvant occasionner des explosions. Il est recommandé de ne pas porter de gants en latex ou en nitrile lors de la manipulation d'acide nitrique fumant, ceux-ci pouvant s'enflammer au contact de l'acide.
Culture populaire
Dans la bande dessinée On a marché sur la Lune, le moteur auxiliaire de la fusée conçue par le professeur Tournesol fonctionne sur un mélange aniline/acide nitrique.
Dans la série de Anne McCaffrey La Ballade de Pern, les habitants de la planète Pern utilisent des pulvérisateurs contenant de l'Agenothree (HNO3) pour détruire l'ennemi planétaire, les « Fils ».
Dans le manga Dr. Stone de Riichirō Inagaki et dessiné par Boichi, Senku utilise de l'acide nitrique mélangé à de l'éthanol pour faire du nital afin de dépétrifier les personnes transformées en pierre.
Dans le roman Le Portrait de Dorian Gray de Oscar Wilde, une « horrible odeur d'acide nitrique » se fait sentir après qu'un protagoniste a fait disparaître un corps en l'employant.
Notes et références
- (en)/(de) Cet article est partiellement ou en totalité issu des articles intitulés en anglais « Nitric acid » (voir la liste des auteurs) et en allemand « Salpetersäure » (voir la liste des auteurs).
- ACIDE NITRIQUE, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) David R. Lide, Handbook of Chemistry and Physics, CRC, , 89e éd., 2736 p. (ISBN 142006679X et 978-1420066791), p. 9-50
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press, , 90e éd., 2804 p., Relié (ISBN 978-1-4200-9084-0)
- (en) David R. Lide, Handbook of Chemistry and Physics, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 10-205
- Entrée « Nitric acid » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 30 juin 2018 (JavaScript nécessaire)
- « Acide nitrique » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- « Office of Radiation, Chemical & Biological Safety (ORCBS) » (consulté le )
- « Nitric acid », sur hazmap.nlm.nih.gov (consulté le )
- (en) James Campbell Brown et Henry Hilton Brown, A history of chemistry from the earliest times, Londres, J. & A. Churchill, , 2e éd. (lire en ligne).
- (en) Thomas R. Dulski, A manual for the chemical analysis of metals, vol. 25, ASTM International, , 251 p. (ISBN 0-8031-2066-4, lire en ligne), p. 75



