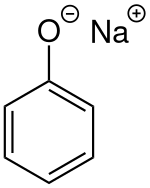
Phénolate de sodium
Le phénolate de sodium, ou plus rarement phénoxyde de sodium, est un composé aromatique de formule NaOC6H5. C'est le sel de sodium du phénol, et un des principaux membres de la famille des phénolates.
| Phénolate de sodium | |
| |
| Identification | |
|---|---|
| Nom UICPA | phénolate de sodium |
| Synonymes |
phénoxyde de sodium |
| No CAS | (trihydrate) |
| No ECHA | 100.004.862 |
| PubChem | 4445035 |
| SMILES | |
| InChI | |
| Apparence | poudre ou solide cristallin blanc, odeur de phénol[1] |
| Propriétés chimiques | |
| Formule | C6H5NaO |
| Masse molaire[2] | 116,093 1 ± 0,005 5 g/mol C 62,07 %, H 4,34 %, Na 19,8 %, O 13,78 %, |
| Propriétés physiques | |
| T° fusion | 384 °C[1] |
| Solubilité | > 300 g·L-1 (eau, 20 °C)[1] |
| T° d'auto-inflammation | > 250 °C[1] |
| Précautions | |
| SGH[1] | |
 |
|
| Transport | |
| Écotoxicologie | |
| LogP | -1,170[3] |
| Composés apparentés | |
| Autres cations | phénolate de potassium |
| Unités du SI et CNTP, sauf indication contraire. | |
Propriétés
D'après[1].
Le phénolate de sodium se présente sous la forme d'un solide cristallin ou d'une poudre cristalline blanche, avec une odeur de phénol. C'est un solide hygroscopique, déliquescent, absorbant le dioxyde de carbone de l'air et soluble dans l'eau. Il est combustible mais faiblement inflammable. Il présente des risques aigus ou chroniques pour la santé, et est dangereux pour la vie aquatique.
Ses poussières sont explosives lorsque :
- la substance est sous une forme très finement répartie (poudre, poussière) ;
- la substance est brassée en quantité suffisante dans l'air ;
- une source d'inflammation est présente (flamme, étincelle, décharge électrostatique, etc.).
Structure
Comme beaucoup d'alcoolates de sodium, le phénolate de sodium cristallin adopte une structure complexe impliquant de multiples liaisons Na-O. Sans solvant, il est sous forme de polymère, chaque centre Na étant lié à trois ligands oxygène ainsi qu'un cycle de phényle. Les adduits de phénolate de sodium sont moléculaires, comme le cluster de type cubane (en) [NaOPh]4(HMPA)4[4].
Synthèse
Le plus souvent, le phénolate de sodium est préparé en solution par traitement du phénol par l'hydroxyde de sodium[5]. La forme anhydre peut être préparée par réaction directe entre le phénol et le sodium :
- Na + HOC6H5 → NaOC6H5 + 1/2 H2
Le phénolate de sodium peut également être produit par « fusion alcaline » de l'acide benzènesulfonique, où les groupes sulfonate sont déplacés par l'hydroxyde :
- C6H5SO3Na + 2 NaOH → C6H5ONa + Na2SO3
Cette voie fut la principale méthode industrielle de synthèse du phénol.
Applications
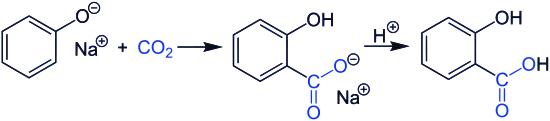
Le phénolate de sodium peut servir à produire l'acide salicylique par réaction de Kolbe-Schmitt avec le dioxyde de carbone. Le salicylate de sodium ainsi obtenu est ensuite mis à réagir avec de l'acide sulfurique pour donner l'acide salicylique[6] :
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Sodium phenoxide » (voir la liste des auteurs).
- Entrée « Sodium phenoxide » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 14 avril 2020 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche (en) « Phénolate de sodium », sur ChemIDplus, consulté le 14 avril 2020.
- Michael Kunert, Eckhard Dinjus, Maria Nauck et Joachim Sieler, Structure and Reactivity of Sodium Phenoxide - Following the Course of the Kolbe-Schmitt Reaction, Chemische Berichte, 1997, vol. 130, n° 10, p. 1461–1465, DOI 10.1002/cber.19971301017
- C. S. Marvel, A. L. Tanenbaum, « γ-Phenoxypropyl Bromide », Org. Synth., vol. 9, , p. 72 (DOI 10.15227/orgsyn.009.0072)
- ChemgaPedia, Glossar: Kolbe-Schmitt-Synthese.