Hexaméthylphosphoramide
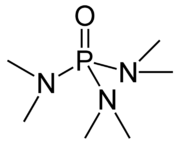
L'hexaméthylphosphoramide, abrégé HMPA (Différent de HMPT= tris(dimethylamino)phosphine)[9], est un liquide organique incolore de formule brute C6H18N3PO.
| Hexaméthylphosphoramide | |
  |
|
| Identification | |
|---|---|
| Synonymes |
Hexametapol |
| No CAS | |
| No ECHA | 100.010.595 |
| No CE | 211-653-8 |
| SMILES | |
| InChI | |
| Apparence | liquide incolore, mobile, d'odeur caractéristique[1]. |
| Propriétés chimiques | |
| Formule | C6H18N3OP [Isomères] |
| Masse molaire[2] | 179,200 4 ± 0,007 g/mol C 40,21 %, H 10,12 %, N 23,45 %, O 8,93 %, P 17,28 %, |
| Diamètre moléculaire | 0,702 nm [3] |
| Propriétés physiques | |
| T° fusion | 7,2 °C [4] |
| T° ébullition | 232,5 °C [4] |
| Solubilité | 1 000 g·l-1 (eau) [4] |
| Paramètre de solubilité δ | 21,5 MPa1/2 (25 °C)[5] |
| Masse volumique | 1,03 g·cm-3[1] |
| Point d’éclair | 105 °C[1] |
| Pression de vapeur saturante | 0,046 mmHg 25 °C [4] |
| Précautions | |
| SGH[6] | |
 Danger |
|
| SIMDUT[7] | |
 D2A, |
|
| Classification du CIRC | |
| Groupe 2B : Peut-être cancérogène pour l'homme[8] | |
| Écotoxicologie | |
| DL50 | 2 400 mg·kg-1 (souris, oral) 800 mg·kg-1 (souris, i.v.) 1 600 mg·kg-1 (souris, i.p.) [4] |
| Unités du SI et CNTP, sauf indication contraire. | |
Généralités
Il est utilisé comme solvant pour les polymères, solvant sélectif pour les gaz, inhibiteur de la dégradation thermique du polystyrène, solvant pour les organométalliques et autres réactions organiques en laboratoire. Des tests ont prouvé son efficacité en tant que substance anti-feu, ainsi que stérilisant chimique chez l'insecte, mais il n'y a pas actuellement d'utilisation connue de ce produit pour ces deux applications. Il est très utile pour améliorer la sélectivité de certaines réactions. Par exemple, lors des réactions de déprotonation, le HMPA (ou HMPT) permet de dissocier les oligomères de lithium basiques, tels que le butyllithium. En raison de sa capacité à solvater les cations sans solvater les anions, le HMPA est utilisé comme solvant pour réaliser des réactions de substitution nucléophile de type SN2 particulièrement délicates. L'oxygène basique solvate bien le cation Li+[10]. Le HMPA est l'oxyde de la phosphine tertiaire la plus basique P(NMe2)3. Comme la plupart des oxydes de phosphine (ex. l'oxyde de triphénylphosphine), la molécule présente un atome de phosphore tétraédrique et la liaison P-O est très polarisée ; ainsi, la charge négative présente sur l'oxygène est significative.
Réactifs alternatifs
Le diméthylsulfoxyde (DMSO) peut souvent être employé comme solvant en remplacement du HMPA. Ces deux composés présentent un fort site accepteur de liaison hydrogène et leurs oxygènes sont capables de former une liaison avec un cation métallique.
Toxicité
Le HMPA est peu toxique mais a tout de même été tenu responsable de cancers nasaux chez le rat[10]. Cependant, il peut être dégradé en composés moins toxiques, par action de l'acide chlorhydrique.
Notes et références
- TRIAMIDE HEXAMETHYLPHOSPHORIQUE, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, England, John Wiley & Sons Ltd, , 239 p. (ISBN 0-471-98369-1)
- (en) « Hexaméthylphosphoramide », sur ChemIDplus, consulté le 6 février 2009
- (en) James E. Mark, Physical Properties of Polymer Handbook, Springer, , 2e éd., 1076 p. (ISBN 978-0-387-69002-5 et 0-387-69002-6, lire en ligne), p. 294
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- « Hexaméthylphosphorotriamide » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 2B : Peut-être cancérogènes pour l'homme », sur http://monographs.iarc.fr, CIRC, (consulté le )
- « Tris(dimethylamino)phosphine | CAS 1608-26-0 », sur www.scbt.com (consulté le )
- Dykstra, R. R. "Hexamethylphosphoric Triamide" Encyclopedia of Reagents for Organic Synthesis, 2001 John Wiley & Sons, Ltd. DOI: 10.1002/047084289X.rh020
- Merck Index, 12th Edition, 4761.