Iodométhane
L’iodométhane, aussi appelé iodure de méthyle, est un composé chimique de formule CH3I, parfois noté MeI. Il s'agit d'un halogénoalcane, dérivé du méthane, où l'un des atomes d'hydrogène a été substitué par un atome d'iode. Il se présente sous la forme d'un liquide incolore, dense, volatil, à l'odeur éthérée, et qui prend un teint violacé exposé à la lumière en raison de la présence de diiode I2. L'iodométhane est couramment utilisée en synthèse organique en tant que donneur de groupe méthyle, dans des réactions appelées méthylations. Il est naturellement émis en faible quantité par le riz[10].
| Iodométhane | |||
 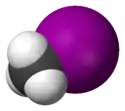 Structure de l'iodométhane |
|||
| Identification | |||
|---|---|---|---|
| Nom UICPA | iodure de méthyle | ||
| Synonymes |
Iodure de méthyle monoiodométhane |
||
| No CAS | |||
| No ECHA | 100.000.745 | ||
| No CE | 200-819-5 | ||
| SMILES | |||
| InChI | |||
| Apparence | liquide incolore, d'odeur caractéristique. devient brun lors d'exposition à la lumière et l'humidité[1]. | ||
| Propriétés chimiques | |||
| Formule | CH3I [Isomères] |
||
| Masse molaire[2] | 141,939 ± 0,001 g/mol C 8,46 %, H 2,13 %, I 89,41 %, |
||
| Moment dipolaire | 1,59 D | ||
| Propriétés physiques | |||
| T° fusion | −66,5 °C[1] | ||
| T° ébullition | 42,5 °C[1] | ||
| Solubilité | dans l'eau à 20 °C : 14 g·l-1[1] | ||
| Paramètre de solubilité δ | 9,9 cal1/2·cm-3/2 (25 °C)[3] | ||
| Masse volumique | 2,3 g·cm-3[1] | ||
| T° d'auto-inflammation | 352 °C | ||
| Limites d’explosivité dans l’air | 8,5 - 66 % | ||
| Pression de vapeur saturante | à 20 °C : 50 kPa[1], 24.09 psi à 55 °C |
||
| Point critique | 65,9 bar, 254,85 °C [4] | ||
| Thermochimie | |||
| Cp | |||
| Propriétés électroniques | |||
| 1re énergie d'ionisation | 9,538 eV (gaz)[6] | ||
| Propriétés optiques | |||
| Indice de réfraction | 1,5304 (20 °C, D) 1,5293 (21 °C, D) |
||
| Précautions | |||
| SGH[7] | |||
  Danger |
|||
| SIMDUT[8] | |||
Produit non classé |
|||
| Transport | |||
|
|||
| Classification du CIRC | |||
| Groupe 3 : Inclassable quant à sa cancérogénicité pour l'Homme[9] | |||
| Écotoxicologie | |||
| LogP | 1,51-1,69[1] | ||
| Unités du SI et CNTP, sauf indication contraire. | |||
L'iodométhane s'hydrolyse à 270 °C, formant de l'iodure d'hydrogène, de monoxyde de carbone et du dioxyde de carbone.
Utilisations
Réactions de méthylation
L'iodométhane sert essentiellement pour la méthylation d'autres composés, par des réactions de type SN2. Il peut stériquement facilement être attaqué par des nucléophiles, et l'iodure est un bon nucléofuge.
Il peut par exemple être utilisé pour la méthylation d'acides carboxyliques (transformation en méthanoate de carboxyle) ou de phénols (formation de méthoxybenzènes):
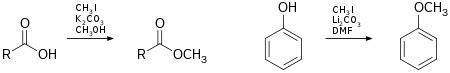
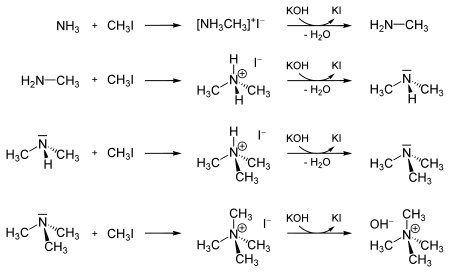
Il peut aussi servir à la méthylation de l'ammoniac et des amines dérivées en iodoammonium. Cette réaction peut se poursuivre jusqu'à la formation d'un hydroxyde de tétraméthylammonium.
L'iodométhane est aussi un précurseur de l'iodure de méthylmagnésium ou « MeMgI », un réactif de Grignard souvent utilisé en synthèse organique. MeMgI se forme assez facilement, il est donc assez souvent utilisé en tant qu'exemple dans l'enseignement de préparation de ces réactifs. L'utilisation de MeMgI a cependant été supplantée par l'utilisation de méthyllithium.
Dans le procédé Monsanto, MeI est formé in situ par la réaction du méthanol et de l'iodure d'hydrogène. Il réagit ensuite avec le monoxyde de carbone en présence de rhodium pour former de l'iodure d'éthanoyle, précurseur de l'acide acétique (obtenu par hydrolyse). Une grande partie de l'acide acétique produit dans le monde l'est par cette méthode.
Autres
Outre son utilisation comme agent de méthylation, certains proposent d'utiliser l'iodométhane comme fongicide, herbicide, insecticide, nématicide ou même dans les extincteurs. Il peut être utilisé comme désinfectant des sols, replaçant le bromométhane (dont l'utilisation a été bannie par la protocole de Montréal), et en microscopie pour ses propriétés liées à son indice de réfraction.
Production et synthèse
L'iodométhane peut être synthétisé par une réaction exothermique, par réaction de diiode avec le méthanol en présence de phosphore. Le diidode est alors transformé in situ en triiodure de phosphore. Il s'ensuit une substitution nucléophile avec le méthanol[11] :
Une autre méthode est de faire réagir le sulfate de diméthyle avec l'iodure de potassium en présence de carbonate de calcium[11] :
L'iodométhane peut ensuite être obtenu par distillation après lavage au thiosulfate de sodium afin d'éliminer l'excès d'iode.
L'iodométhane peut aussi être produit lors d'accidents nucléaires, par réaction de composés organiques avec de « l'iode de fusion ».
Choix de l'iodométhane comme agent de méthylation
L'iodométhane est un excellent agent de méthylation, mais il y comporte certains inconvénients. Outre sa toxicité ; comparé à d'autres halogénométhanes (chlorométhane en particulier) son poids équivalent est plus élevé : une mole de MeI pèse près de trois fois plus qu'une mole de MeCl. Toutefois, le chlorométhane est un gaz (comme le bromométhane), ce qui rend leur utilisation plus délicate que l'iodométhane qui est un liquide. Le chlorométhane est un agent de méthylation bien moins fort que MeI, mais il suffit dans la plupart des réactions.
Les iodures sont généralement bien plus coûteux que leurs équivalents chlorures ou bromures, mais ce n'est pas le cas de l'iodométhane dont le prix est abordable. À l'échelle commerciale, le sulfate de diméthyle, bien que toxique, est préféré, car il est à la fois bon marché et liquide.
Lors des réactions de substitutions nucléophiles le départ du groupe partant, I− peut entraîner des réactions parasites, car c'est un puissant nucléophile. Enfin, de par sa forte réactivité MeI est plus dangereux pour le personnel le manipulant que ses équivalents bromés et chlorés.
Toxicité et effets biologiques
L'iodométhane a une DL50 par voie orale de 76 mg·kg-1 pour les rats, et dans le foie, il est rapidement converti en S-méthylglutathion[12]. Aux États-Unis, l'iodométhane est considéré comme potentiellement cancérogène selon les classification de l'ACGIH (en), du NTP et de l'APE. Le CIRC le classe dans le groupe 3 (« inclassables quant à leur cancérogénicité pour l'Homme »).
L'inhalation de vapeurs d'iodométhane peut provoquer des dommages aux poumons, au foie, aux reins et au système nerveux. Il provoque nausées, étourdissements, toux et vomissements. Un contact prolongé avec la peau provoque des brûlures. Une inhalation massive peut provoquer un œdème pulmonaire.
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Methyl iodide » (voir la liste des auteurs).
- IODURE DE METHYLE, Fiches internationales de sécurité chimique .
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Nicholas P. Chopey, Handbook of Chemical Engineering Calculations, McGraw-Hill, , 3e éd., 800 p. (ISBN 978-0-07-136262-7), p. 1.43.
- (en) « Properties of Various Gases », sur flexwareinc.com (consulté le ).
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams : Inorganic Compounds and Elements, vol. 1, 2 et 3, Huston, Texas, Gulf Pub. Co., , 384 p. (ISBN 0-88415-857-8, 0-88415-858-6 et 0-88415-859-4).
- (en) David R. Lide, Handbook of chemistry and physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 10-205.
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE no 1272/2008 (16 décembre 2008).
- « Iodométhane » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009.
- IARC_Working_Group_on_the_Evaluation_of_Carcinogenic_Risks_to_Humans2009">IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 3 : Inclassables quant à leur cancérogénicité pour l'Homme », sur http://monographs.iarc.fr, CIRC, (consulté le ).
- (en) K. R. Redeker, N.-Y. Wang, J. C. Low, A. McMillan, S. C. Tyler et R. J. Cicerone, « Emissions of Methyl Halides and Methane from Rice Paddies », Science, vol. 290, , p. 966–969 (PMID 11062125, DOI 10.1126/science.290.5493.966).
- (en)C. S. King, W. W. Hartman: Methyl Iodide. In: Organic Synthesis, 1943, 2, S. 399 (Article).
- (en) Johnson, M. K., « Metabolism of iodomethane in the rat », Biochem J., vol. 98, , p. 38–43.
Bibliographie
- Adams, R. E., Browning Jr, W. E., Cottrell, W. B., & Parker, G. W. (1965) The Release and Adsorption of Methyl Iodide in the HFIR Maximum Credible Accident (No. ORNL-TM-1291). Laboratoire national d'Oak Ridge Oak Ridge National Lab., Tenn.





