Méthyllithium
Le méthyllithium est un composé chimique de formule CH3Li. Il s'agit d'une substance très réactive utilisée en solution dans les solvants aprotiques tels que l'éther diéthylique, le tétrahydrofurane (THF) et le diméthoxyéthane (DME). Il est employé en synthèse organique et en chimie des organométalliques. Il présente une structure oligomérique aussi bien en solution qu'à l'état solide. Il doit être utilisé en conditions anhydres car il réagit très vigoureusement avec l'eau ; il est également dégradé par l'oxygène et le dioxyde de carbone.
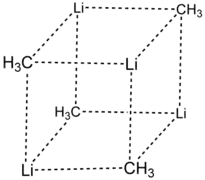 Géométrie cubique du méthyllithium solide.
Géométrie cubique du méthyllithium solide.
| Méthyllithium | |||
Structure du méthyllithium |
|||
| Identification | |||
|---|---|---|---|
| No CAS | |||
| No ECHA | 100.011.843 | ||
| No CE | 213-026-4 | ||
| PubChem | 2724049 | ||
| ChEBI | 51486 | ||
| SMILES | |||
| InChI | |||
| Propriétés chimiques | |||
| Formule | CH3Li [Isomères] |
||
| Masse molaire[1] | 21,976 ± 0,003 g/mol C 54,65 %, H 13,76 %, Li 31,58 %, |
||
| Propriétés physiques | |||
| Masse volumique | 0,846 g·cm-3[2] à 25 °C | ||
| Point d’éclair | −15 °C[2] | ||
| Précautions | |||
| SGH[2] | |||
  Danger |
|||
| Transport[2] | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
Le méthyllithium est à la fois fortement basique et très nucléophile dans la mesure où l'atome de carbone est porteur d'une charge électrique négative partielle, de sorte qu'il est particulièrement réactif avec les accepteurs d'électrons et les donneurs de protons. Il réagit lentement avec le THF à température ambiante, et les solutions dans l'éther sont indéfiniment stable. On l'emploie pour réaliser des réactions d'alkylation et de métallation[3].
La synthèse directe du méthyllithium consiste à traiter du bromométhane CH3Br avec une suspension de lithium dans l'éther diéthylique :
Le bromure de lithium forme un complexe avec le méthyllithium, et c'est ce complexe qui est généralement disponible dans le commerce. Le méthyllithium dit « sans halogénure » est préparé à partir du chlorométhane[4] CH3Cl. Le chlorure de lithium LiCl forme un précipité à partir de l'éther diéthylique car, contrairement au bromure de lithium, il ne se complexe pas avec le méthyllithium. On peut ainsi obtenir un filtrat de méthyllithium très pur.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé Methyllithium solution 3.1 M in diethoxymethane, consultée le 2 novembre 2018.
- (en) Terry L. Rathman, Shuki Araki et Tsunehisa Hirashita, « Methyllithium », Encyclopedia of Reagents for Organic Synthesis, (DOI 10.1002/047084289X.rm205.pub2, lire en ligne)
- (en) Michael J. Lusch, William V. Phillips, Ronald F. Sieloff, Glenn S. Nomura et Herbert O. House, « Preparation of Low-Halide Methyllium », Organic Syntheses, vol. 62, , p. 101 (DOI 10.15227/orgsyn.062.0101, lire en ligne)

