Métallation
En chimie, la métallation est une réaction chimique durant laquelle une ou plusieurs liaisons carbone-métal sont formées à partir d'un composé organique[1]. Par définition, le produit de la réaction est un composé organométallique. Dans le cas du lithium, cette réaction est spécifiquement nommée lithiation.
Types de métallation
Échange métal-halogène
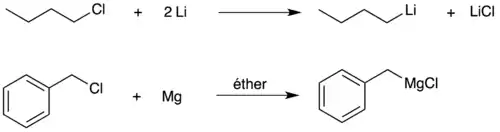
Certains métaux comme le lithium ou le magnésium sous leur forme métallique réagissent directement avec les halogénures d'alkyle pour former respectivement un organolithien ou un réactif de Grignard. On parle alors d'un échange métal-halogène. C'est la principale réaction utilisée dans l'industrie pour générer le n-butyllithium et ses isomères (sec-butyllithium et tert-butyllithium).
Déprotonation (échange métal-hydrogène)
Il est possible de métaller des composés organiques possédant un ou plusieurs hydrogènes labiles par réaction avec une base organométallique ou une base possédant un cation métallique. Selon les cas, on parlera plutôt d'échange métal-hydrogène si l'on s'intéresse à la nature du métal et de l'espèce organométallique formée, ou plutôt de déprotonation si le but de la réaction est uniquement de former un carbanion peu importe le métal utilisé.
On utilise en général des bases très fortes comme des hydrures métalliques (NaH), des alcoolates ou amidures peu nucléophiles (tBuOK, LDA) ou des organolithiens d'usage très courant (BuLi, sBuLi ou tBuLi).
Transmétallation (échange métal-métal)
La transmétallation consiste en l'échange de deux atomes métalliques, l'un faisant partie d'un composé organométallique, l'autre provenant du réactif. En général, la force motrice est soit une plus grande stabilité d'un des produits de la réaction, soit l'insolubilité d'un des produits finaux déplaçant l'équilibre vers la droite.
Références
- Encyclopedia Britannica