sec-Butyllithium
Le sec-butyllithium, abrégé sec-BuLi ou s-BuLi, est un composé chimique de formule CH3–CHLi–CH2–CH3, isomère du n-butyllithium et du tert-butyllithium, plus basique que le premier mais moins que le second. Il s'agit d'un organolithien liquide, incolore et visqueux, dont les molécules s'organisent en tétramères, aussi bien dans le liquide pur[3] qu'en solution dans des solvants apolaires[4] tels que le benzène, le cyclohexane ou le cyclopentane. Un hexamère a été détecté à −41 °C dans le cyclohexane par spectroscopie RMN au lithium 6[5]. Dans les solvants polaires tels que le tétrahydrofurane (THF), on observe un équilibre entre monomères et dimères[6].
| sec-Butyllithium | |
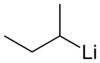  Structure du sec-butyllithium (à gauche : monomère ; à droite : tétramère) |
|
| Identification | |
|---|---|
| Synonymes |
1-Méthylpropyllithium |
| No CAS | |
| No ECHA | 100.009.026 |
| No CE | 209-927-7 |
| PubChem | 102446 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C4H9Li [Isomères] |
| Masse molaire[1] | 64,055 ± 0,006 g/mol C 75 %, H 14,16 %, Li 10,84 %, |
| pKa | 53 |
| Précautions | |
| SGH[2] | |
     Danger |
|
| Transport[2] | |
| Unités du SI et CNTP, sauf indication contraire. | |
Le sec-butyllithium s'obtient en faisant réagir du 2-chlorobutane avec du lithium élémentaire, ce qui libère du chlorure de lithium :

Il est utilisé pour déprotoner des acides organiques faibles lorsque le n-butyllithium s'avère insuffisant. Il est cependant suffisamment basique pour requérir davantage de précautions d'utilisation que le n-BuLi. Ainsi, l'éther diéthylique à température ambiante est attaqué par le sec-BuLi en quelques minutes, alors que les solutions de n-BuLi dans l'éther sont stables.
De nombreuses réactions impliquant le sec-BuLi sont semblables à celles impliquant d'autres organolithiens. Il réagit ainsi avec les carbonyles et les esters pour former des alcools. Il forme des di-sec-butylcuprates de lithium avec l'iodure de cuivre(I) ICu.
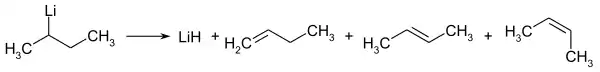
Le secbutyllithium se décompose, progressivement à température ambiante et plus rapidement à température élevée, en hydrure de lithium LiH et en un mélange de 1-butène, de trans-2-butène et de cis-2-butène :
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) D. Plavsic, D. Srzic et Leo Klasinc, « Mass spectrometric investigations of alkyllithium compounds in the gas phase », Journal of Physical Chemistry, vol. 90, no 10, , p. 2075–2080 (lire en ligne) DOI 10.1021/j100401a020
- (en) Ulrich Wietelmann et Richard J. Bauer, « Lithium and Lithium Compounds », Ullmann's Encyclopedia of Industrial Chemistry, (lire en ligne) DOI 10.1002/14356007.a15_393
- (en) Gideon Fraenkel, Mark Henrichs, Michael Hewitt et Biing Ming Su, « Structure and dynamic behavior of a chiral alkyllithium compound: carbon-13 and lithium-6 NMR of sec-butyllithium », Journal of the American Chemical Society, vol. 106, no 1, , p. 255-256 (lire en ligne) DOI 10.1021/ja00313a052
- (en) Walter Bauer, William R. Winchester et Paul von R. Schleyer, « Monomeric organolithium compounds in tetrahydrofuran: tert-butyllithium, sec-butyllithium, supermesityllithium, mesityllithium, and phenyllithium. Carbon-lithium coupling constants and the nature of carbon-lithium bonding », Organometallics, vol. 6, no 11, , p. 2371–2379 (lire en ligne) DOI 10.1021/om00154a017

