Organocuprate lithié
Les organocuprates lithiés, appelés aussi réactifs de Gilman du nom de leur découvreur, Henry Gilman (en)[1], sont des réactifs constitués d'un diorganocuprate et de lithium, de formule générale R2CuLi où R est un radical organique[2].
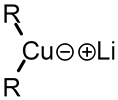
Synthèse
Le diméthylcuprate de lithium (CH3)2CuLi peut être synthétisé par réaction entre l'iodure de cuivre(I) et le méthyllithium dans le tétrahydrofurane à −78 °C.
Structure
Les organocuprates lithiés ont des structures compliquées, tant sous leur forme cristalline qu'en solution. Le diméthylecuprate de lithium est un dimère dans le diéthyléther formant un cycle à huit avec deux atomes de lithium coordonnés entre les deux groupes méthyles. De façon similaire, le diphénylcuprate de lithium forme un dimère éthéré, [{Li(OEt2)}(CuPh2)]2, à l'état solide[3] :
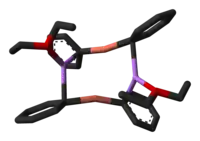
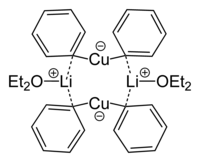 .
.Si les ions Li+ sont rendus inertes par complexations avec l'éther couronne 12-couronne-4, les anions diorganylcuprate isolés restants adoptent alors une géométrie de coordination linéaire autour du cuivre[4].

Réactivité
Comme pour la plupart des composés organométalliques, la principale propriété des organocuprates lithiés est d'être fortement polaires, rendant les deux atomes de carbone liés au cuivre fortement nucléophiles. Ils réagissent ainsi bien avec les halogénures organiques (chlorures, bromures et iodures) en substituant l'atome d'halogène X par un radical R de l'organocuprate, permettant de créer de grandes molécules à partir de plus petites[5] :
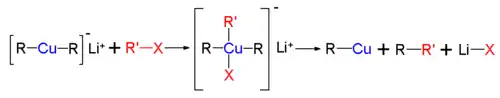 .
.
L'équation ci-dessus présente l'équation générale entre un halogénure organique et un diorganocuprate lithié, formant un nouveau composé organique, un organocuprate et un halogénure de lithium, avec pour intermédiaire réactionnel un ion cuivre(III).
Exemples
Dans la réaction présentée ci-dessous, l'organocuprate lithié est utilisé comme agent méthylant sur un alcyne par addition nucléophile conjuguée, la charge négative étant piégée dans une substitution nucléophile d'acyle avec le groupe ester formant une énone cyclique[6] :
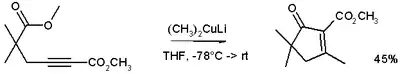 .
.
Notes et références
- (en) Henry Gilman, Reuben G. Jones et L. A. Woods, « The Preparation of Methylcopper and some Observations on the Decomposition of Organocopper Compounds », Journal of Organic Chemistry, vol. 17, no 12, , p. 1630–1634 (DOI 10.1021/jo50012a009)
- Il est possible de choisir deux radicaux différents, mais on choisit en général les mêmes.
- (en) N. P. Lorenzen, E. Weiss, « Synthesis and Structure of a Dimeric Lithium Diphenylcuprate:[{Li(OEt)2}(CuPh2)]2 », Angew. Chem. Int. Ed., vol. 29, no 3, , p. 300–302 (DOI 10.1002/anie.199003001)
- (en) H. Hope, M. M. Olmstead, P. P. Power, J. Sandell, X. Xu, « Isolation and x-ray crystal structures of the mononuclear cuprates [CuMe2]−, [CuPh2]−, and [Cu(Br)CH(SiMe3)2]− », J. Am. Chem. Soc., vol. 107, no 14, , p. 4337–4338 (DOI 10.1021/ja00300a047)
- (en) J. F. Normant, « Organocopper(I) Compounds and Organocuprates in Synthesis », Synthesis, vol. 1972, no 02, , p. 63–80 (DOI 10.1055/s-1972-21833)
- (en) Modern Organocopper Chemistry, N. Krause Ed. Wiley-VCH, 2002.
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Gilman reagent » (voir la liste des auteurs).