Éther couronne
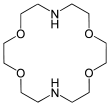
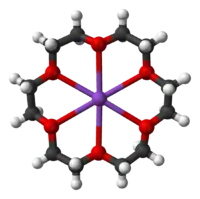
Les éthers couronnes sont des composés chimiques hétérocycliques qui, dans leurs formes les plus simples, sont des oligomères cycliques d'oxyde d'éthylène. L'unité de répétition essentielle de tout éther couronne est le groupe éthylènoxy-, soit –CH2CH2O–, qui se répète deux fois dans le dioxane et six fois dans l'éther 18-couronne-6 (ou encore 18-C-6). Le cycle à neuf éléments 1,4,7-trioxonane (éther 9-couronne-3) est parfois appelé couronne et peut interagir avec les cations. Les macrocycles de type (–CH2CH2O–)n dans lesquels n ≥ 4 sont généralement référés comme éthers couronnes plutôt que sous leurs noms systématiques. Ceci est dû au fait que, lorsque les hétérocycles sont liées à des cations, les structures moléculaires formées ressemblent à une couronne posée sur une tête.
Nomenclature
L'utilisation du terme éther couronne ne correspond pas à la nomenclature IUPAC. Ainsi l'éther 18-couronne-6 (ou 18C6) se nomme 1,4,7,10,13,16-hexaoxacyclooctadécane selon la nomenclature systématique dans laquelle la position de chaque atome d'oxygène est précisée.
Selon la notation de Pedersen, les éthers couronnes sont caractérisés par le nombre total x de chaînons du cycle -atomes de carbone et d'oxygène- et le nombre y d'atomes d'oxygène. Un éther couronne peut alors se symboliser x-couronne-y ou xCy. Implicitement, cette notation indique que la molécule est une répétition d'un motif éthylènoxy-, de sorte à obtenir un total de x atomes dont y d'oxygène.
La limitation de cette nomenclature simplifiée est qu'il n'est pas possible de définir avec précision la place des différents substituants de l'éther couronne ni même d'indiquer une modification dans la répétition du motif éthylènoxy. Ainsi le dibenzo-18-couronne-6 peut avoir plusieurs isomères tout comme le diaza-18-couronne-6.
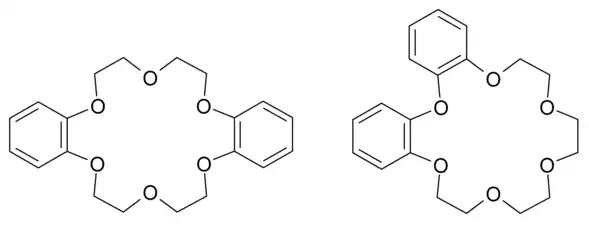 Deux structures correspondant au dibenzoéther 18-couronne-6.
Deux structures correspondant au dibenzoéther 18-couronne-6.
Utilisation
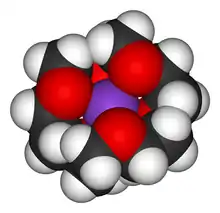
Les éthers couronnes sont connus pour leur capacité à fortement solvater les cations. En d'autres termes, l'équilibre thermodynamique est fortement en faveur du complexe. Les atomes d'oxygène sont idéalement placés pour se coordonner avec un cation à l'intérieur du cycle, dont l'extérieur est hydrophobe. Le résultat est que le cation complexé est soluble dans des solvants apolaires. La taille de l'intérieur de l'éther couronne détermine la taille du cation qu'il peut solvater. Ainsi, le 18-couronne-6 a une forte affinité pour le cation potassium K+, le 15-couronne-5 pour le cation sodium Na+ et le 12-couronne-4 pour le cation lithium Li+. La forte affinité du 18-couronne-6 pour les ions potassium le rend toxique pour l'homme.
En chimie, le 18-couronne-6 permet de dissoudre le permanganate de potassium dans un solvant comme le benzène où il est normalement insoluble. Cette dissolution permet d'utiliser le pouvoir oxydant du permanganate de potassium dans un solvant apolaire comme le benzène [1]. Le "benzène violet" ou" purple benzene" en anglais, est ainsi obtenu.
Le 18-couronne-6, en complexant le cation potassium, peut également être utilisé pour rendre plus nucléophile un anion. Ainsi l'utilisation d'un éther couronne avec le fluorure de potassium rend l'ion fluorure nucléophile. L'introduction du radioisotope du fluor (à savoir le 18F) sur des traceurs organiques destinés à la médecine peut être réalisé grâce aux éthers couronne. Le 2,2,2-kryptofix plus efficace pour la synthèse de radiomarqueurs, lui est préféré aujourd'hui.
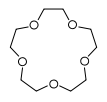
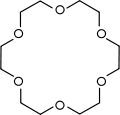
| 12-couronne-4 | 15-couronne-5 | 18-couronne-6 | 21-couronne-7 | |
|---|---|---|---|---|
| Structure | 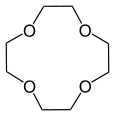
| 
| 
| 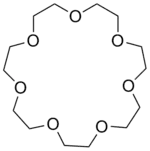
|
| Numéro CAS | ||||
| Formule brute | C8H16O4 [Isomères] 176,210564 g∙mol-1 | C10H20O5 [Isomères] 220,263205 g∙mol-1 | C12H24O6 [Isomères] 264,315846 g∙mol-1 | C14H28O7 308,368487 g∙mol-1 |
| Diamètre interne | 0,12 - 0,15 nm [2] | 0,15 - 0,22 nm [2] | 0,26 - 0,32 nm [2] | 0,34 - 0,43 nm [2] |
L'éther 18-couronne-6 n'est pas le seul ligand macrocyclique qui possède une affinité pour l'ion potassium. Des ionophores comme la nonactine et la valinomycine démontrent aussi une sélectivité vers cet ion plutôt que vers d'autres.
Origine
Les plus anciens rapports sur les éthers couronnes furent centrés sur les méthodes de synthèse pour leur production ; leurs propriétés et les implications théoriques furent étudiées bien plus tard.
En 1967, Charles Pedersen, chimiste chez DuPont, découvrit une méthode simple de synthèse d'un éther couronne lorsqu'il essayait de préparer un agent de complexation pour cations divalents[3]. Sa stratégie consistait à lier deux catéchols par un groupement hydroxyle sur chaque molécule. Ce procédé lui aurait donné un composé qui devait partiellement envelopper le cation, et, par ionisation des hydroxyles phénoliques, aurait neutralisé la liaison dication. Il fut surpris d'isoler un produit secondaire qui liait ou complexait le cation potassium mais ne possédait pas de groupe hydroxyle ionisable. En consultant des travaux précédents sur la dissolution du potassium dans du 16-couronne-4 [4] - [5], il réalisa que les polyéthers cycliques représentaient une nouvelle classe d'agents complexants capables de lier les cations alcalins. Il procéda alors à un rapport d'études systématiques de la synthèse et des propriétés liantes des éthers couronnes dans une série de publications. Les domaines des réactifs de synthèse anionique, des catalyseurs de transfert de phase, du transfert ionique biologique, et d'autres disciplines ont bénéficié en profondeur de la découverte des éthers couronnes.
Pedersen reçut le Prix Nobel de Chimie en 1987 pour la découverte des voies de synthèse et des propriétés liantes des éthers couronnes (conjointement avec Donald Cram et Jean-Marie Lehn pour leurs contributions à la chimie supramoléculaire)
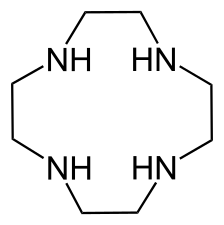
Les aza-éthers couronnes
Des analogues azotés des éthers couronnes existent, comme le cyclène. Il est aussi possible de synthétiser des couronnes mixtes aza- et éther dénommées éthers azacouronnes, ou azaéthers couronnes. À la différence des éthers couronnes, les couronnes azotées permettent de complexer les anions par liaison hydrogène avec le proton acide de l'azote.
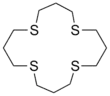
Les thioéthers couronnes
Les éthers couronnes dont l'atome d'oxygène a été remplacé par un atome de soufre sont appelées thioéthers couronnes.
Références
- illustration de la dissolution du KMnO4 dans le benzène https://www.youtube.com/watch?v=JsowvWBvz74
- (en) Katsuhiko Ariga et Toyoki Kunitake, Supramolecular Chemistry – Fundamentals and Applications Advanced Textbook, Springer-Verlag Berlin Heidelberg, , 1re éd., 208 p. (ISBN 3-540-01298-2, lire en ligne), p. 13
- C. J. Pedersen, J. Am. Chem. Soc., 1967, 89, 7017.
- D. G. Stewart. D. Y. Waddan and E. T. Borrows, British Patent 785,229, Oct. 23, 1957.
- J. L. Down, J. Lewis, B. Moore and G. W. Wilkinson, Proc. Chem. Soc., 1959, 209; J. Chem. Soc., 1959, 3767.
Voir aussi
Liens externes
- Discours Nobel de Charles Pedersen.
- G. W. GOKEL*, H. D. DURST, Principles and Synthetic Applications in Crown Ether Chemistry, Synthesis, 1976, 168-184
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « crown ether » (voir la liste des auteurs).