Éther 18-couronne-6
L'éther 18-couronne-6, ou 18-C-6, est un composé organique de formule chimique (C2H4O)6. Il se présente sous la forme d'un solide hygroscopique cristallisé blanc à bas point de fusion. Il s'agit d'un éther couronne qui agit comme chélateur de certains cations métalliques, avec une affinité particulière pour les cations de potassium — la constante de dissociation dans le méthanol est 106. Le chimiste américain Charles Pedersen a reçu le Prix Nobel de chimie en 1987 pour ses travaux sur ce type de composés.
| Éther 18-couronne-6 | |
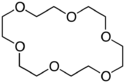 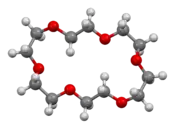 Structure de l'éther 18-couronne-6 |
|
| Identification | |
|---|---|
| Nom UICPA | 1,4,7,10,13,16-hexaoxacyclooctadécane |
| Synonymes |
hexamère cyclique d'oxyde d'éthylène |
| No CAS | |
| No ECHA | 100.037.687 |
| No CE | 241-473-5 |
| No RTECS | MP4500000 |
| PubChem | 28557 |
| ChEBI | 32397 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C12H24O6 [Isomères] |
| Masse molaire[1] | 264,315 4 ± 0,013 1 g/mol C 54,53 %, H 9,15 %, O 36,32 %, |
| Propriétés physiques | |
| T° fusion | 42 à 45 °C[2] |
| Point d’éclair | > 113 °C[2] |
| Précautions | |
| SGH[2] | |
 Attention |
|
| Unités du SI et CNTP, sauf indication contraire. | |
On prépare ce composé par une synthèse de Williamson modifiée en présence d'un cation[3] ou par oligomérisation de l'oxyde d'éthylène :
On le purifie par distillation, lors de laquelle sa tendance à la surfusion apparaît évidente. Il peut également être purifié par recristallisation dans l'acétonitrile chaud. Il peut être produit totalement anhydre en solution dans le tétrahydrofurane suivie de l'addition de sodium-potassium (NaK) pour donner le composé [K(18-C-6)]Na.
L'analyse cristallographique de 18-couronne-6 montre une molécule relativement plate mais dont la géométrie des atomes d'oxygène n'est pas aussi régulièrement hexagonale qu'habituellement représenté[4]. Cette géométrie change significativement lors de la chélation :
Les éthers couronnes peuvent être utilisés au laboratoire comme catalyseurs de transfert de phase[5], bien qu'il existe de tels catalyseurs moins chers et moins spécifiques. En présence de 18-C-6, le permanganate de potassium se dissout dans le benzène en donnant du « benzène violet », appelé parfois « benzène pourpre » par traduction littérale de l'anglais purple benzene, qui peut être utilisé pour oxyder divers composés organiques.
Plusieurs réactions de substitution sont également favorisées par la présence d'éther 18-couronne-6, qui empêche l'appariement des ions et permet aux anions d'agir comme des nucléophiles nus. L'acétate de potassium est ainsi un nucléophile plus puissant en présence de 18-C-6 dans les solvants organiques :
- [K(18-C-6)+]OAc− + C6H5CH2Cl → C6H5CH2OAc + [K(18-C-6)+]Cl−.
Le premier sel d'électrure impliquant l'éther 18-couronne-6 à avoir été synthétisé et observé par cristallographie aux rayons X est le [Cs(18-C-6)2]+•e− en 1983. Ce composé sensible à l'air et à l'humidité a une structure moléculaire sandwich, dans laquelle l'électron est piégé dans des cavités pratiquement sphériques. La distance entre deux électrons est cependant trop grande — 868 pm — pour que ce matériau soit un conducteur électrique[6] - [7].
L'éther dibenzo-18-couronne-6 est un dérivé aux propriétés chélatrices plus puissantes que le 18-couronne-6 vis-à-vis des cations de métaux alcalins.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé 18-Crown-6 ≥99.0%, consultée le 30 septembre 2013.
- (en) George W. Gokel, Donald J. Cram, Charles L. Liotta, Henry P. Harris et Fred L. Cook, « 18-Crown-6 », Organic Syntheses, vol. 6, no 57, , p. 30 (lire en ligne)
- (en) J. D. Dunitz et P. Seiler, « 1,4,7,10,13,16-Hexaoxacyclooctadecane », Acta Crystallographica Section B – Structural Crystallography and Crystal Chemistry, vol. 30, no 11, , B30 (lire en ligne) DOI 10.1107/S0567740874007928
- (en) Charles L. Liotta et Joachim Berkner, « 18-Crown-6 », e-EROS Encyclopedia of Reagents for Organic Synthesis, (lire en ligne) DOI 10.1002/047084289X.rc261
- Dheeb Issa, James L. Dye, Synthesis of cesium 18-crown-6: the first single-crystal electride?", J. Am. Chem. Soc., 1982, vol. 104 (13), pp. 3781–3782. DOI 10.1021/ja00377a066.
- Ahmed Ellaboudy, James L. Dye, Patrick B. Smith, Cesium 18-crown-6 compounds. A crystalline ceside and a crystalline electride, J. Am. Chem. Soc., 1983, vol. 105(21), pp. 6490-6491. DOI 10.1021/ja00359a022.
.png.webp)