Diméthoxyéthane
Le diméthoxyethane, également connu sous les noms de glyme, monoglyme, diméthyl glycol, éthylène glycol diméthyl éther, diméthyl cellosolve et DME, est un liquide clair, incolore, de la famille des éther-oxydes, utilisé comme solvant.
| Diméthoxyéthane | |
| |
| Identification | |
|---|---|
| Nom UICPA | 1,2-diméthoxyéthane |
| Synonymes |
DME, glyme, monoglyme, |
| No CAS | |
| No ECHA | 100.003.451 |
| No CE | 203-794-9 |
| No RTECS | KI1451000 |
| PubChem | 8071 |
| InChI | |
| Apparence | liquide incolore, odeur éthérée[1] |
| Propriétés chimiques | |
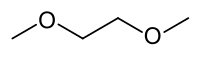
| Formule | C4H10O2 [Isomères] |
| Masse molaire[2] | 90,121 ± 0,004 5 g/mol C 53,31 %, H 11,18 %, O 35,51 %, |
| Propriétés physiques | |
| T° fusion | −58 °C[1] |
| T° ébullition | 84 °C[1] |
| Solubilité | soluble dans l'eau[1] |
| Paramètre de solubilité δ | 16,8 J1/2·cm-3/2 (25 °C)[3] |
| Masse volumique | 0,87 g·cm-3[1] |
| T° d'auto-inflammation | 200 °C[1] |
| Point d’éclair | −2 °C (coupelle fermée)[1] |
| Limites d’explosivité dans l’air | 1,6 vol.%, 60 g/m³ - 10,4 vol. %, 390 g/m³[1] |
| Pression de vapeur saturante | 77,8 mbar (20 °C) 126 mbar (30 °C) 195 mbar (40 °C) 294 mbar (50 °C)[1] |
| Précautions | |
| SGH[4] | |
   Danger |
|
| NFPA 704[4] | |
| Transport[1] | |
| Inhalation | Nocif par inhalation. Peut irriter le système respiratoire[4]. |
| Peau | Peut être nocif en cas d'absorption par la peau. Peut provoquer une irritation de la peau[4]. |
| Yeux | Peut provoquer une irritation des yeux[4]. |
| Ingestion | Peut être nocif par ingestion[4]. |
| Écotoxicologie | |
| DL50 | 400 mg/kg (souris, intrapéritonéal)[5] 3200 mg/kg (souris, oral)[5] |
| LogP | -0,21[1] |
| Unités du SI et CNTP, sauf indication contraire. | |
Propriétés
Le diméthoxyéthane est miscible à l'eau. Il forme des complexes chélates avec les cations et agit comme ligand bidentate.
Synthèse
Le DME peut être synthétisé selon de nombreuses méthodes[6] :
- par synthèse de Williamson, en faisant réagir le 2-méthoxyéthanolate de sodium (lui-même préparé en faisant réagir le 2-méthoxyéthanol avec le sodium) avec le chlorométhane :
- 2 CH3OCH2CH2OH + 2 Na → 2 CH3OCH2CH2ONa + H2↑,
- CH3OCH2CH2ONa + CH3Cl → CH3OCH2CH2OCH3 + NaCl,
- par alkylation du 2-méthoxyéthanol avec le sulfate de diméthyle,
- par clivage de l'oxyde d'éthylène en présence de diméthyl éther. Cette réaction est catalysée par les acides de Lewis (par exemple le trifluorure de bore ou son complexe avec le diméthyl éther). Cette méthode n'est pas particulièrement sélective et produit le diglyme, le triglyme, le tétraglyme et d'autres glymes comme sous-produits. Le mélange réactionnel est séparé par distillation :
- CH3OCH3 + CH2CH2O → CH3OCH2CH2OCH3.
Utilisation
Le diméthoxyéthane est souvent utilisé comme alternative au diéthyl éther ou au THF, bouillant à plus haute température. De par ses propriétés de ligand, il est souvent utilisé en chimie organométallique comme avec les réactifs de Grignard, pour la réduction des hydrures et pour des réactions catalysées par le palladium, comme la réaction de Suzuki ou le couplage de Stille.
Le diméthoxyéthane est aussi un bon solvant pour les oligo- et polysaccharides.
Avec des composés à haute permittivité (par exemple le carbonate de propylène), le diméthoxyéthane est utilisé comme composé à faible viscosité du solvant pour électrolytes dans les batteries au lithium.
Notes et références
- Entrée « 1,2-Dimethoxyethane » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 13 octobre 2012 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, England, John Wiley & Sons Ltd, , 239 p. (ISBN 0-471-98369-1)
- Fiche Sigma-Aldrich du composé 1,2-Dimethoxyethane, consultée le 13 octobre 2012.
- National Technical Information Service. Vol. OTS0571323
- Dimethoxyethane
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Dimethoxyethane » (voir la liste des auteurs).

