Poids équivalent
En chimie, le poids équivalent (ou l'équivalent-gramme) est un terme qui a été employé dans plusieurs contextes. Au sens le plus large, c'est la masse d'une substance donnée qui :
- combinera ou déplacera directement ou indirectement 1,008 g d'hydrogène ou 8 g d'oxygène ou 35,5 g de chlore ;
- ou fournira ou réagira avec une mole de cations hydrogène H+ (hydrons) dans une réaction acide-base ;
- ou fournira ou réagira avec une mole d'électrons dans une réaction d'oxydoréduction[1].
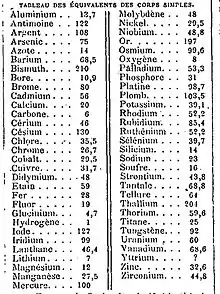
Le poids équivalent possède les dimensions et les unités d'une masse, contrairement au poids atomique qui est sans dimension. Autrefois, les poids équivalents étaient déterminés par l'expérience ; ils sont maintenant déduits des masses molaires, tant qu'ils sont encore employés. En plus, le poids équivalent d'un composé peut être calculé en divisant le poids molaire par le nombre de charges électriques positives ou négatives qui sont produites par la dissolution du composé.
Emploi en chimie générale
L'emploi du poids équivalent en chimie générale a été largement remplacé par l'emploi de la masse molaire. Le poids équivalent d'une substance peut être calculé à partir de sa masse molaire pourvu que sa chimie soit bien connue. Par exemple :
- la masse molaire de l'acide sulfurique est de 98,078(5) g·mol-1, et 1 mol d'acide sulfurique fournit 2 mol d'ions hydrogène (hydrons), alors le poids équivalent (éq) de l'acide est 98,078(5) g·mol-1 / 2 éq·mol-1 = 49,039(3) g·éq-1 ;
- la masse molaire du permanganate de potassium est de 158,034(1) g·mol-1, et 1 mol réagit avec 5 mol d'électrons, alors son poids équivalent est 158,034(1) g·mol-1 / 5 éq·mol-1 = 31,606 8(3) g·éq-1.
Historiquement, les poids équivalents des éléments sont souvent déterminés par l'étude de leurs réactions avec l'oxygène. Par exemple, 50 g de zinc réagissent avec l'oxygène pour produire 62,24 g d'oxyde de zinc, ce qui implique que le zinc réagit avec 12,24 g d'oxygène (selon la loi de conservation de la masse). Alors le poids équivalent de zinc est la masse qui réagit avec 8 g d'oxygène, c'est-à-dire 50 g × 8 g / 12,24 g = 32,7 g.
Histoire

Les premiers tableaux des poids équivalents sont publiés pour les acides et les bases par Carl Friedrich Wenzel en 1777. Un plus grand ensemble de tableaux est préparé, peut-être indépendamment, par Jeremias Benjamin Richter dès 1792. Cependant, ni Wenzel ni Richter ont un repère unique pour leurs tableaux, de sorte qu'ils doivent publier de tableaux distincts pour chaque paire acide-base[2].
Le premier tableau de poids atomiques de John Dalton en 1808 suggère un point de repère, du moins pour les éléments chimiques, en prenant le poids équivalent de l'hydrogène comme une unité de masse. Cependant la théorie atomique de Dalton est loin de l'acceptation universelle au début du XIXe siècle. L'un des plus grands problèmes est la réaction de l'hydrogène avec l'oxygène pour former l'eau. Un gramme d'hydrogène réagit avec 8 g d'oxygène pour former 9 g d'eau, alors Dalton définit le poids équivalent de l'oxygène comme 8 g. Dalton suppose (à tort) qu'une molécule d'eau est formée d'un seul atome d'hydrogène et un d'oxygène, alors selon lui le poids atomique de l'oxygène serait 8 g aussi. Cependant, si on exprime la réaction en fonction des volumes de gaz selon la loi de volumes, deux volumes d'hydrogène réagissent avec un volume d'oxygène pour former deux volumes de vapeur d'eau, ce qui suggère (avec raison) que le poids atomique de l'oxygène est plutôt seize[2]. Les travaux de Charles Frédéric Gerhardt (1816–56), Henri Victor Regnault (1810–1878) et Stanislao Cannizzaro (1826–1910) aident à comprendre ce paradoxes et plusieurs autres pareils[2], mais le problème est encore débattu au Congrès de Karlsruhe de 1860[3].
Néanmoins, de nombreux chimistes du XIXe siècle trouvent que l'emploi des poids équivalents est utile même s'ils n'acceptent pas la théorie atomique. Les poids équivalents sont une généralisation utile de la loi des proportions définies de Joseph Proust (1794) qui a permis à la chimie de se développer en science quantitative. Le chimiste français Jean-Baptiste Dumas (1800–1884) devient un des adversaires influents de la théorie atomique, après l'avoir soutenue au début de sa carrière, mais il continue à appuyer l'emploi des poids équivalents.
« Tant que les tables atomiques ont été formées en partie d’après les lois de Wenzel et de Richter, en partie par de simples tâtonnements, elles ont laissé bien des doutes dans les meillieurs esprits. C’est pour sortir de cette situation que l’on a essayé de tirer les poids atomiques de la densité des corps simples à l’état de vapeur, de leur chaleur spécifique, de leur forme cristalline. Mais il ne faut pas oublier que la valeur des caractères tirés de ces propriétés ne saurait avoir rien d’absolu… En résumé, que nous reste-t-il de l’ambitieuse excursion que nous nous sommes permise dans la région des atomes ? Rien, rien de nécessaire du moins. Ce qui nous reste, c’est la conviction que la chimie s’est égarée là, comme toujours, quand, abandonnant l’expérience, elle a voulu marcher sans guide au travers des ténèbres. L’expérience à la main, vous trouvez les équivalents de Wenzel, les équivalents de Mitscherlich, mais vous cherchez vainement les atomes tels que votre imagination a pu les rêver en accordant à ce mot, consacré malheureusement dans la langue des chimistes, une confiance qu’il ne mérite pas. Ma conviction, c’est que les équivalents des chimistes, ceux de Wenzel, ceux de Mitscherlich, ne sont autre chose que des groupes moléculaires. Si j’en était le maître, j’effacerais le mot atome de la science, persuadé qu’il va plus loin que l’expérience ; et jamais, en chimie, nous ne devons aller plus loin que l’expérience. » Jean-Baptiste Dumas, cours au Collège de France, 1843/44[2]
Les poids équivalents avaient leurs propres problèmes. Tout d'abord, l'échelle basée sur l'hydrogène n'est pas très pratique, parce que la plupart des éléments ne réagissent pas directement avec l'hydrogène pour former des composés simples. Cependant, 1 g d'hydrogène réagit avec 8 g d'oxygène pour former l'eau, ou bien avec 35,5 g de chlore pour former le chlorure d'hydrogène. Alors 8 g d'oxygène et 35,5 g de chlore peuvent être supposés équivalents à 1 g d'hydrogène pour la mesure des poids équivalents. Ce système peut être généralisé par l'emploi de d'autres acides et bases[2].
Un problème beaucoup plus grave est posé par les éléments qui forment plus qu'un oxyde ou série des sels avec différents états d'oxydation (comme ils s'appellent aujourd'hui). Le cuivre par exemple réagit avec l'oxygène pour former soit l'oxyde cuivreux rouge brique (l'oxyde de cuivre(I), avec 63,5 g de cuivre pour 8 g d'oxygène), soit l'oxyde cuivrique noir (l'oxyde de cuivre(II), avec 32,7 g de cuivre pour 8 g d'oxygène), et alors il y a deux valeurs du poids équivalent. Les adhérents des poids atomiques peuvent se baser sur la loi de Dulong et Petit (1819) qui relie le poids atomique d'un élément solide à sa capacité thermique, pour arriver à un ensemble des poids atomiques qui est unique et sans équivoque. Avant 1860 la grande majorité des chimistes sont adhérents des poids équivalents qu'ils supposaient plus fondamentaux que les poids atomiques, et ils ne se préoccupent pas de l'existence des valeurs multiples des poids équivalents pour la plupart des éléments. En effet ces chimistes sont convenus de lister des « équivalents supposés » : H = 1, O = 8, C = 6, S = 16, Cl = 35,5, Na = 23, Ca = 20, etc. Cependant ces « équivalents » du XIXe siècle ne sont équivalents ni au sens originel ni au sens moderne du terme. Étant donné qu'ils représentent des nombres sans dimension qui sont uniques et invariants pour chaque élément, ils sont en effet un ensemble alternatif des poids atomiques, auquel les éléments de valence pair (O, C, Ca, etc.) ont des poids atomiques égaux à la moitié des valeurs modernes. Ce fait n'est pas reconnu jusqu'à beaucoup plus tard[4].
Le coup mortel pour l'emploi des poids équivalents des éléments est la publication du tableau périodique en 1869 par Dmitri Mendeleïev, qui relie les propriétés chimiques des éléments à leur ordre des poids atomiques. Cependant, l'emploi des poids équivalents de nombreux composés continuent pendant un autre siècle, surtout dans la chimie analytique. Les poids équivalents des réactifs communs sont souvent mis en tableaux aux manuels de chimie analytique, ce qui simplifie les calculs avant que les calculatrices électroniques deviennent généralement disponibles.
Emploi en analyse volumétrique
En chimie analytique, le choix d'un composé de poids équivalent supérieur comme standard est plus convenable parce que les erreurs de pesée sont réduites. Un exemple serait la standardisation volumétrique d'une solution de l'hydroxyde de sodium préparée à une concentration approximative de 0,1 mol·dm-3. Il faut calculer la masse d'un acide solide qui réagira avec à peu près 20 cm3 de cette solution (pour un titrage à l'aide d'une burette de 25 cm3. Des acides solides appropriés incluent le dihydrate de l'acide oxalique, H2C2O4•2H2O, l'hydrogénophtalate de potassium, C6H4(COOH)(COOK), et l'iodate de potassium et d'hydrogène, KH(IO3)2. Les poids équivalents des trois acides sont 63,04 g, 204,23 g et 389,92 g respectivement, et les masses requises pour la standardisation sont 126,1 mg, 408,5 mg et 779,8 mg respectivement. Étant donné que l'incertitude de mesure de la masse mesurée avec une balance analytique ordinaire est ±0,1 mg, l'incertitude relative de la masse du dihydrate de l'acide oxalique serait d'une partie sur mille, comparable à l'incertitude de mesure du volume de titrage[5]. Cependant l'incertitude de mesure de la masse de KH(IO3)2 serait cinq fois plus petite, parce que son poids équivalent est cinq fois plus grand. Une telle incertitude à la masse mesurée est négligeable par rapport à l'incertitude de mesure du volume de titrage.
À titre d'exemple, on suppose que 22,45 ± 0,03 cm3 d'une solution d'hydroxyde de sodium (NaOH) réagit avec 781,4 ± 0,1 mg d'iodate de potassium et d'hydrogène dont le poids équivalent est 389,92 g. La masse mesurée correspond alors à 2,004 milliéquivalents (méq). La concentration de la solution de NaOH est alors 2,004 méq / 0,022 45 L = 89,3 méq·L-1. En chimie analytique, la concentration équivalente ou normalité (symbole N) d'une solution est sa concentration en équivalents par litre, alors la concentration de la solution citée est 0,089 3 N[1] - [6]. L'incertitude de mesure (ur) de la concentration mesurée peut être estimée en supposant une distribution gaussienne des incertitudes de mesure :
Cette solution d'hydroxyde de sodium peut ensuite être employée pour mesurer le poids équivalent d'un acide inconnu. Par exemple, s'il faut 13,20 ± 0,03 cm3 de la solution de NaOH pour neutraliser 61,3 ± 0,1 mg d'un acide inconnu, le poids équivalent de cet acide est :
Étant donné que chaque mole d'acide doit libérer un nombre entier de moles d'ions hydrogène (hydrons), la masse molaire d'un acide inconnu doit être un multiple entier de 52,0 ± 0,1 g.
Références
- (en) The use of the equivalence concept, International Union of Pure and Applied Chemistry (1998), Compendium of Analytical Nomenclature, Oxford, Blackwell Science, section 6.3 (ISBN 0-86542-6155)
- « Atome », Grand dictionnaire universel du XIXe siècle, éditeur Pierre Larousse, Paris 1866, vol. 1, p. 868-73
- Rapport de Charles-Adolphe Wurtz sur le congrès de Karlsruhe
- (en) Alan J. Rocke, Chemical Atomism in the Nineteenth Century: From Dalton to Cannizzaro, Ohio State University Press, 1984
- (en) ISO 385:2005, Laboratory glassware – burettes
- L'emploi du terme solution normale est maintenant déconseillé par l'UICPA.


