Hexachloracétone
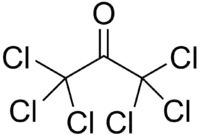
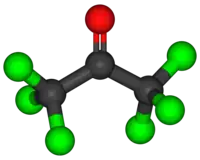
L'hexachloracétone (hexachloroacétone) ou perchloracétone est un composé organochloré, le dérivé perchloré de l'acétone, de formule C3Cl6O.
| Hexachloracétone | ||
| ||
 | ||
| Identification | ||
|---|---|---|
| Nom systématique | 1,1,1,3,3,3-hexachloropropanone | |
| Synonymes |
hexachloropropanone |
|
| No CAS | ||
| No ECHA | 100.003.754 | |
| No RTECS | UC2100000 | |
| PubChem | 8303 | |
| SMILES | ||
| InChI | ||
| Apparence | liquide incolore[1] - [2] | |
| Propriétés chimiques | ||
| Formule | C3Cl6O |
|
| Masse molaire[3] | 264,75 ± 0,015 g/mol C 13,61 %, Cl 80,35 %, O 6,04 %, |
|
| Propriétés physiques | ||
| T° fusion | −3 °C[2] | |
| T° ébullition | 203 à 205 °C[2] | |
| Solubilité | 17,5 g·L-1 (eau, 20 °C)[2] soluble dans l'acétone[4] |
|
| Masse volumique | 1,74 g·cm-3 (20 °C)[2] | |
| Densité de vapeur | 9,14[2] | |
| Point d’éclair | 113 °C (coupelle fermée)[2] | |
| Pression de vapeur saturante | 0,29 hPa (20 °C) 0,9 hPa (38 °C)[2] |
|
| Précautions | ||
| SGH[2] | ||
  Danger |
||
| Transport[2] | ||
| Écotoxicologie | ||
| DL50 | 700 mg·kg-1 (chien, oral)[5] 2 980 mg·kg-1 (lapin, dermique)[6] 700 mg·kg-1 (rat, oral)[7] |
|
| CL50 | 920 mg/m3/2H (souris, inhalation)[7] 360 ppm/6H (rat, inhalation)[8] |
|
| LogP | 2,48[2] | |
| Unités du SI et CNTP, sauf indication contraire. | ||
Propriétés
L'hexachloracétone est un liquide incolore plus lourd que l'eau, faiblement voire très faiblement volatil. Elle est légèrement soluble dans l'eau, combustible mais difficilement inflammable . Elle se décompose lorsqu'elle est chauffée, produisant du chlore, du chlorure d'hydrogène, du phosgène et des dioxines[2].
Synthèse
L'hexachloracétone peut être obtenue par chloration de l'alcool isopropylique à 70-100 °C, qui produit également de la 1,1,1,3,3-pentachloracétone, ou par chloration de la chloracétone en présence d'acide acétique[9] - [10].
Utilisations
L'hexachloroacétone est principalement utilisée comme herbicide[11]. Elle est notamment présente dans certaines formulations du bromacil[1].
L'hexachloroacétone est utilisée pour la chloration des énamines, pour la production de trichloroacétamides et de trichloroacétates en conditions neutres[1]. Elle peut être utilisée dans la réaction de Perkow, dans le rôle du dérivé halogéné de cétone ; mis à réagir avec le phosphite de triéthyle, elle produit un intermédiaire oxyallyle pour une cycloaddition [4+3][12].
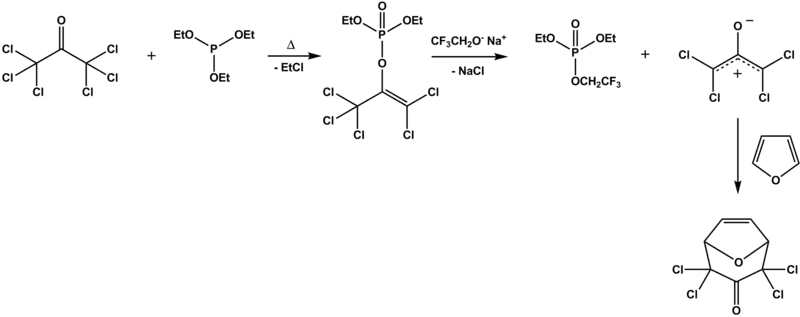
L'hexafluoroacétone est produite industriellement par traitement de l'hexachloracétone par l'acide fluorhydrique[13] :
- (CCl3)2CO + 6 HF → (CF3)2CO + 6 HCl
Notes et références
- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « Hexachloraceton » (voir la liste des auteurs).
- Fiche Sigma-Aldrich du composé Hexachloro-2-propanone, consultée le 16 avril 2020.
- Entrée « Hexachloroacetone » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 16 avril 2020 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- David R. Lide, CRC Handbook of Chemistry and Physics A Ready-reference Book of Chemical and Physical Data, CRC Press, (ISBN 978-0-8493-0595-5, lire en ligne), p. 302
- Pesticide Chemicals Official Compendium, Association of the American Pesticide Control Officials, Inc., p.580, 1966.
- Wirksubstanzen der Pflanzenschutz und Schadlingsbekampfungsmittel, Perkow, W., Berlin, Verlag Paul Parey, 1971-1976.
- Toxicometric Parameters of Industrial Toxic Chemicals Under Single Exposure, Izmerov, N.F., et al., Moscow, Centre of International Projects, GKNT, p.72, 1982.
- Borzelleca JF, Lester D., « Acute toxicity of some perhalogenated acetones », Toxicology and Applied Pharmacology, vol. 7, , p. 592 (PMID 5839393, DOI 10.1016/0041-008x(65)90045-1)
- « Numéro CAS 116-16-5 » dans la base de données Hazardous Substances Data Bank
- Houben-Weyl Methods of Organic Chemistry Vol. V/3, 4th Edition Fluorine and Chlorine Compounds, Georg Thieme Verlag, (ISBN 3-13-179994-3, lire en ligne), p. 616
- Richard Wegler, Chemie der Pflanzenschutz- und Schädlingsbekämpfungsmittel Band 2: Fungizide · Herbizide · Natürliche · Pflanzenwuchsstoffe · Rückstandsprobleme, Springer-Verlag, (ISBN 978-3-7091-4184-7, lire en ligne), p. 204.
- Baldur Föhlisch, Stefan Reiner, « Hexachloroacetone as a precursor for a tetrachloro-substituted oxyallyl intermediate: [4+3] cycloaddition to cyclic 1,3-dienes », Molecules, vol. 9(1), , p. 1-10 (PMID 18007406).
- « Ullmann's Encyclopedia of Industrial Chemistry », dans Ullmann's Encyclopedia of Industrial Chemistry, Weinheim, (ISBN 3527306730, DOI 10.1002/14356007.a11_349), « Fluorine Compounds, Organic ».
