Réaction de Perkow
La réaction de Perkow est une réaction organique dans laquelle un phosphite de trialkyle réagit avec une halocétone (cétone α-halogénée) pour former un phosphate de dialkyle-vinyle et un halogénure d'alkyle[1] - [2]. Elle tient son nom du chimiste allemand Werner Perkow (1915–1994).
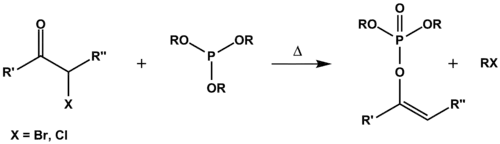
La réaction de Michaelis-Arbuzov utilise les mêmes réactifs, mais le produit est alors un β-cétophosphonate, un important réactif pour la réaction de Horner-Wadsworth-Emmons afin de produire des alcènes. Dans ce contexte, la réaction de Perkow est considérée comme une réaction parasite.
Mécanisme réactionnel
Plusieurs mécanismes réactionnels de la réaction de Perkow ont été proposés. Un premier mécanisme consiste en une addition nucléophile du phosphite sur le carbone du groupe carbonyle formant un intermédiaire zwitterion. Ce dernier se réarrange par cyclisation interne, formant un intermédiaire d'oxaphosphirane, qui se réarrange à nouveau en éliminant un groupe alkyle et l'ion halogénure pour donner le dérivé vinylique[3].
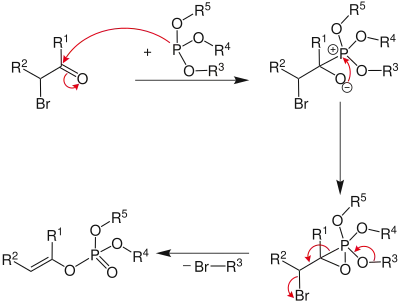
Un autre mécanisme proposé débute de façon similaire jusqu'à la formation de l'intermédiaire zwitterion. Dans ce mécanisme, ce dernier se réarrange en espèce cationique tout en éliminant l'halogénure. Le cation se désalkyle alors via un second déplacement nucléophile dans lequel l'anion halogénure attaque l'un des groupes alcoxyle du phosphite formant un phosphate d'énol[4].

Champ d'application
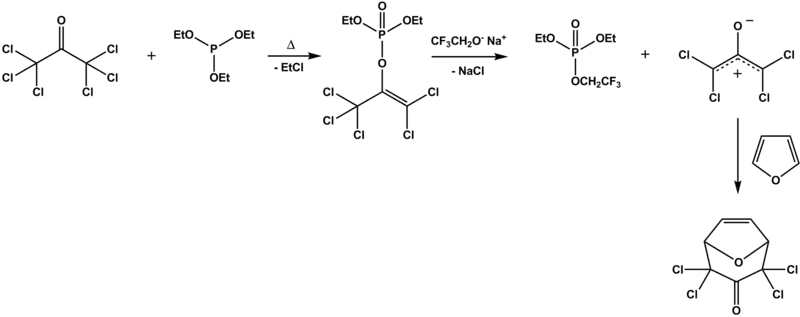
La réaction de Perkow a été utilisée dans la synthèse d'un nouveau répulsif à insectes[5] produit à partir d'hexachloracétone et de phosphite de triéthylecapable de s'engager dans une cycloaddition [4+3] secondaire avec le furane à travers l'action de la base 2,2,2-trifluoroéthoxyde de sodium. Les auteurs rapportent un rendement médiocre.
La réaction de Perkow est par contre couramment utilisée dans la synthèse d'insecticides. On peut notamment citer le chlorfenvinphos, le dichlorvos, le mevinphos, le monocrotophos, et le phosphamidon.
La réaction de Perkow a également servi à synthétiser de nouvelles quinoléines[6].
Des phosphates d'énol-aryle formés avec un bon rendement (~90%) par la réaction de Perkow peuvent être utilisés comme agents de phosphorylation, par exemple pour convertir l'AMP en ATP[7].
Notes et références
- (en)/(de) Cet article est partiellement ou en totalité issu des articles intitulés en anglais « Perkow_reaction » (voir la liste des auteurs) et en allemand « Perkow-Reaktion& » (voir la liste des auteurs).
- Perkow, W. Chemische Berichte 1954, 87, 755–758
- Alexander Senning, Elsevier’s Dictionary of Chemoetymology : The Whys and Whences of Chemical Nomenclature and Terminology, Amsterdam· Oxford, Elsevier, , 1re éd. (ISBN 0-444-52239-5, lire en ligne), p. 301
- Zerong Wang, Comprehensive Organic Name Reactions and Reagents, vol. 2, John Wiley & Sons, , 2168–2172 p. (ISBN 978-0-470-63885-9, DOI 10.1002/9780470638859), chap. 489
- Irving J. Borowitz , Steven Firstenberg , Grace B. Borowitz , David Schuessler, « Organophosphorus chemistry. XVII. Kinetics and mechanism of the Perkow reaction », J. Am. Chem. Soc., vol. 94, , p. 1623–28 (DOI 10.1021/ja00760a032)
- Baldur Föhlisch, Stefan Reiner, « Hexachloroacetone as a Precursor for a Tetrachloro-substituted Oxyallyl Intermediate: [4+3] Cycloaddition to Cyclic 1,3-Dienes », Molecules, vol. 9 (1), , p. 1–10 (PMID 18007406)
- Oldrich Paleta, Karel Pomeisl, Stanislav Kafka, Antonin Klasek, Vladislav Kubelka, « New Modification of the Perkow Reaction: Halocarboxylate Anions as Leaving Groups in 3-Acyloxyquinoline-2,4(1H,3H)-dione Compounds », Beilstein Journal of Organic Chemistry, vol. 1 (17), (PMID 16551375, DOI 10.1186/1860-5397-1-17)
- T. Moriguchi, K. Okada, K. Seio, and M. Sekine, « Synthesis and Stability of 1-Phenylethenyl Phosphate Derivatives and their Phosphoryl Transfer Activity », Letters in Organic Chemistry, vol. 1(2), , p. 140–144 (DOI 10.2174/1570178043488482)