Dioxine
Les dioxines sont une famille de molécules organochlorées, hétérocycliques et aromatiques ayant deux atomes d'oxygène dans un cycle aromatique. Ces molécules sont pour certaines à la fois très persistantes et très toxiques. Selon leur degré de chloration, et selon des paramètres atmosphériques tels que la température, elles sont émises en phase gazeuse ou particulaire : les tétradioxines, les pentadioxines et les furanes (dont les congénères figurent parmi les plus toxiques) sont retrouvés « en proportions non négligeables » dans la phase gazeuse note l'Ineris[1]. Malgré des émissions chroniques, l'eau en contient peu, les plantes un peu, et c'est le sol ou la chaine alimentaire qui les concentrent : Les taux de dioxines les plus élevées ont été découverts dans le sol, des animaux sauvages et certains de nos aliments (produits laitiers, viande, jaune d'œuf, crustacés et certains poissons).
(1%252C4)dioxine_200.svg.png.webp)

Parmi ces dioxines (et furannes), les dibenzo-p-dioxines (PCDD) et les polychlorodibenzofuranes (PCDF), sont deux des douze polluants organiques persistants (POP) concernés par la Convention de Stockholm sur les polluants organiques persistants qui demande[2] un inventaire des sources, et « une minimisation continue ainsi, lorsque cela est possible, une élimination finale ». Selon le PNUE, cinq compartiments et/ou milieu sont concernés par des rejets et/ou transferts anthropiques de dioxines et furanes : l'air, l'eau, le sol, les résidus et les produits ; ces cinq compartiments sont à prendre en compte dans les inventaires nationaux d'émissions de PCDD/PCDF[3].
Éléments de définition
Le mot dioxine désigne notamment les dibenzodioxines et dans le langage courant plus particulièrement les polychlorodibenzo-p-dioxines (ou PCDD), la dioxine la plus toxique, mieux connue du public à la suite de la catastrophe de Seveso.
Le mot dioxine, dans son sens le plus large regroupe donc plusieurs classes de molécules :
- les polychlorodibenzo-p-dioxines (PCDD), qui incluent « la » dioxine de Seveso. Ces PCDD sont tous des dérivés de la dibenzo-p-dioxine.
210 types de composés sont apparentés à ce type de dioxine (dits « congénères »), 75 congénères (molécules proches, dont le nombre et l'emplacement des atomes de chlore diffèrent), dont dix-sept très toxiques et sept particulièrement toxiques, le plus dangereux étant la 2,3,7,8-Tétrachlorodibenzodioxine (TCDD)[4] ; - les polychlorodibenzofuranes (PCDF) ou furanes. Tous les PCDF dérivent du dibenzofurane.
Il en existe 135 isomères, dont dix ont des propriétés analogues à celles de la dioxine ; - les biphényles polychlorés/polybromés (PCB/PBB), dérivés du biphényle.
Douze sont dits « analogues » de la dioxine.
Dans certaines conditions, les PCB peuvent former des dibenzofuranes et/ou des dioxines par oxydation partielle.
Nota : l'expression « 1,4-dioxine » désigne l'unité chimique de base des dioxines plus complexes (ce composé simple n'est ni persistant, ni aussi toxique que les PCDD).
Il en existe essentiellement deux isomères de position :
- les 1,2-dioxines où les deux atomes d'oxygène sont consécutifs (position ortho), stables car proches des peroxydes ;
- les 1,4-dioxines où les deux atomes d'oxygène sont séparés par deux atomes de carbone (position para) ;
- les 1,3-dioxines (position méta) ne peuvent pas être aromatiques et, de ce fait, sont beaucoup moins stables.
Les dioxines désignent aussi tout composé contenant un cycle de ce type.
Forme des grands types de dioxines
 Polychlorodibenzo-p-dioxines (PCDD).
Polychlorodibenzo-p-dioxines (PCDD).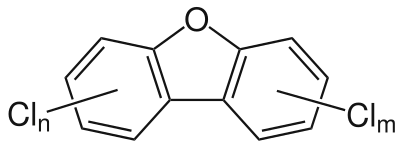 Polychlorodibenzofurane (PCDF).
Polychlorodibenzofurane (PCDF).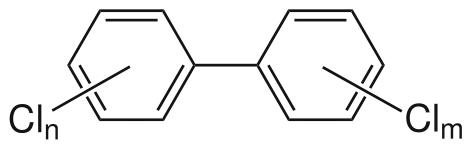 Polychlorobiphényles (PCB).
Polychlorobiphényles (PCB).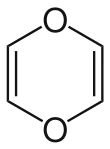
Utilisations
Les dioxines n'ont pas d'usage connu dans l'industrie ; de faibles quantités sont produites volontairement, pour les besoins de laboratoires et de la recherche.
En santé environnementale, elles sont utilisées comme indicateurs sanitaires, indicateurs de dégradation de l'environnement, dans le cadre de risques.
Voies de contamination de l'environnement

Selon le PNUE, les voies directes contaminant l'environnement sont[3] (avec des passages possibles d'un compartiment à l'autre) :
- le rejet dans l'air ;
- les rejets dans l’eau (à partir de pluies contaminées ou du ruissellement) ;
- les rejets dans la terre ou le sous-sol (à partir de retombées, décharges et enfouissement de cendres ou déchets pollués) ;
- rejet dans les produits manufacturés (pesticides…) ;
- rejet dans les résidus ;
- « points chauds » potentiels (voir chapitre consacré aux sources de dioxines) ;
- une voie biogénique de production à température ambiante est décrite pour certaines dioxines, par exemple en contexte semi-anaérobie lors de la digestion de boues d'épuration[5], ou à partir de précurseurs chimiques comme le pentachlorophénol[6] ; ou comme certains résidus de pesticides organochlorés (dans les sols, « la formation d’OCDD à partir de précurseurs dérivés de pesticides pourrait constituer un mécanisme possible, passé, présent et futur, de contamination des échantillons environnementaux »[7]).
À titre d'exemple, le graphique ci-contre présente une série chronologique d'analyse de dioxines/furanes faites dans le sédiment d'un lac anglais (Esthwaite Water (en)) très préservé et éloigné de zones urbaines, industrielles et de grandes voies de circulation. On constate une pollution et accumulation globalement croissante du sédiment par les dioxines. En dépit du caractère isolé du lac, plupart des homologues chimiques de la dioxine étaient présents à des taux détectables dans toutes les couches étudiées du sédiment (c’est-à-dire pour chaque décennie depuis 1840)
Trois périodes distinctes d’apports (et stockage de PCDD/Furanes) sont mises en évidence par des « signatures (profils) spécifiques d’homologues et d’isomères.
Avant 1900, les apports, encore relativement mineurs semblent issus de la révolution industrielle, avec l’industrie minière, les carrières, le charbon de bois et la fonderie de fer.
Durant le XXe siècle, une 1re vague de pollution chronique et croissante atteint un summum vers 1930 ; cette vague est caractérisée par un schéma inhabituel d'homologues dominé par les PCDF de haut poids moléculaire, d’origine(s) inconnue(s).
Puis une seconde vague atteint un sommum dans les années 1970, elle correspond à une tendance retrouvée ailleurs en Europe et l'Amérique du Nord.
Avant 1900, la signature par la proportion des isomères de TCDD / Furanes était dominé par les produits de dimérisation du 2,4-dichlorophénol (CDF). Les taux de CDF P (1-3) semblaient être liées aux apports qui avaient atteint leur maximum dans les années 1930, alors que les CDD P (1-3) se trouvaient dans les couches plus profondes. Les taux de diCDD ont encore augmenté au cours des dernières décennies pour atteindre des niveaux similaires à ceux observés avant 1900.
Les auteurs notent qu’en dépit d’une bonne connaissance du contexte historique, il ne leur a pas été possible de rétrospectivement tracer les origines géographiques et/ou matérielles de ces polluants, ce qui montre selon eux « qu’il reste des lacunes importantes dans notre compréhension des sources de PCDD/Furanes et compromet notre capacité à prédire les tendances futures des émissions de PCDD / F »[8].
Sources, origine et conditions de genèse des dioxines
Les dioxines sont formées « de manière non intentionnelle, et comme sous-produits de certains procédés »[3] ; toute combustion ou pyrolyse[9] en présence de chlore peut générer des dioxines dans l’environnement.
Au début du XXIe siècle, les deux premières sources de dioxine et de composés apparentés aux dioxines (DLC) sont la combustion non contrôlée de déchets solides[10] et les incendies de forêt, alors que dans les années 1880-1990, il s'agissait probablement de l'incinération des déchets ménagers. Les sources recensées vers l'an 2000 par le PNUE[3] sont :
- les incinérateurs de déchets ménagers, de déchets dangereux, de boues d'épuration, de carcasses animales, de déchets de bois ou de biomasse et/ou de déchets médicaux[11]. Ces émetteurs ont beaucoup diminué leurs émissions de base ;
- les industries productrices de chlore, les industries métallurgiques et sidérurgiques travaillant les métaux ferreux ou non-ferreux (et en particulier de cuivre, aluminium, plomb, zinc, laiton) ;
- la fabrication de pâte à papier et de papier blanchi par un procédé au chlore ;
- les industries pétrochimiques et de la carbochimie (dont via la production d'organochlorés ; pesticides notamment soit parce qu'ils contenaient des dioxines comme contaminants, soit parce qu'une fois exposés aux UV solaires certains pesticides organochlorés sont transformés en dioxines[12] - [13] ;
- l'industrie textile et de traitement du cuir ;
- la production de chauffage et/ou d'électricité basée sur la combustion (d'énergies fossiles ou de biomasse, de biogaz ou gaz de décharge) ;
- certains modes de chauffage/cuisine et potentiellement tout procédé de combustion non-contrôlée ;
- le transport (dont via les moteurs à quatre temps, à deux temps, diesel ou au fioul lourd, ainsi que via les feux de véhicules ou de pneus) ;
- la fabrication de certains produits minéraux (magnésium notamment mais aussi ciment, chaux, briques, tuiles, céramiques, verre, mélanges d'asphaltes, etc.) ;
- les feux de bois (bois humide ou salinisés) ; la pratique de l'écobuage (notamment si des phyto-sanitaires organochlorés rémanents étaient présents ou en contexte littoral propice aux embruns salés). Les ateliers de fumage peuvent être concernés ; La dégradation thermique des PCB (polychlorobiphényle) peut aussi générer des dioxines ;
- la production et l'utilisation de certains produits chimiques et de biens de consommation, dont produits chlorés, et notamment insecticides ou d'herbicides contenant du pentachlorophénol et/ou d’autres chlorophénols (ex : l'agent orange utilisé au Viet-nam) ;
- la récupération de fils ou de métaux (dont de composants électroniques) par voie thermique ;
- certains ateliers de nettoyage à sec ;
- le traitement (non thermique) d'huiles usagées ;
- les systèmes de sanitation et/ou de traitement des eaux usées utilisant du chlore ou traitant des déchets contenant du chlore ou du sel ;
- la crémation de cadavres animaux ou humains.
Le PNUE recommande de notamment bien identifier les « points chauds » (Hot Spots) que sont les sites de production de chlore et/ou d'organochlorés, les sites de formulation et/ou d'application des phénols chlorés, les sites de production et de traitements conservateurs des bois, les lieux de stockage ou utilisation de transformateurs électriques remplis de PCB, les décharges de déchets/résidus susceptible d'avoir reçu des déchets chlorés ou contenant des dioxines ; certains sites d'accidents « pertinents » ; les sites de stockage ou dragage de sédiments ; certains sites d'extraction de kaolin ou d’argile figuline (ball clay) qui risquent de contenir des dioxines[3] - [14].
Enfin, des phénomènes naturels comme les éruptions volcaniques ou plus ou moins naturels/anthropiques comme les incendies de forêts en génèrent aussi (surtout en cas d'apports d'eau de mer par les bombardiers d'eau).
Genèse physico-chimique
Deux principaux mécanismes de formation de novo de dioxines (pouvant coexister) sont :
- Une synthèse de novo où les PCDD/PCDF sont directement formés à partir de structures à base de carbone (C) et de chlore, qui sont très différentes du produit final (PCDD/PCDF)[3].
- Des réactions conduisant à la formation de précurseurs, via des structures aryles dérivées soit d’une oxydation incomplète d'hydrocarbures aromatiques, soit de la cyclisation de fragments d’hydrocarbures[3].
Dans un procédé thermique, quatre conditions peuvent (séparément ou synergiquement) favoriser la formation de PCDD/PCDF :
- Haute température (pendant le refroidissement des gaz de combustion dans une gamme 450 à 200 °C) et/ou une combustion incomplète[3] ;
- Présence de carbone organique[3] ;
- Présence de chlore (qu'il soit d'origine organique ou minérale, d'origine primaire ou issu de dégradation)[3] ;
- Produits contenant déjà des PCDD/PCDF[3].
En outre l'humidité du combustible (dans le cas du bois notamment, ou en cas d'incendies arrosés par les pompiers) aggrave le risque[15] ; et la durée de combustion est aussi parfois aussi un facteur important[15].
Enfin des catalyseurs peuvent intervenir : la charge en métaux (même pour de faibles doses) du combustible ; teneur en cuivre notamment, car ce métal catalyse la formation d'organochlorés, dont dioxines) est donc un paramètre important[16] - [15]. La dioxine peut donc ne pas se former immédiatement au cœur du foyer, mais un peu en aval quand les gaz refroidissent ou en présence de certains catalyseurs.
Dans les usines chimiques ou laboratoires, en présence de chlore et de matière organique, la formation de PCDD/PCDF est favorisée « si une ou plusieurs des conditions ci-après s’appliquent »[3] :
- Des températures dépassant 150 °C ;
- Des conditions alcalines (surtout lors d'une purification) ;
- Une irradiation UV, ou autre catalyseur initiateur de radicaux.
Concernant les incendies ou le bois-énergie, plusieurs études ont détecté des teneurs élevées (20 pg/m3) de dioxines et furanes en aval de feux de forêt[17] et notamment proximité de la mer (qui contient du sel, source d'ions chlore) (ou après les largages d’eau de mer par des avions bombardiers d'eau). Le chlore issu du sel contribue à produire des dioxines (et furanes).
En 2003, l'INERIS a analysé les fumées de quelques feux correspondant à une surface débroussaillée de 4 m2, dans une chambre de combustion de 80 m3 surmontée d’une hotte d’extraction des fumées : les émissions de dioxines et furanes étaient en moyenne de 10,5 ng I.TEQ/kg de biomasse brûlée (de 1,0 à 25,9). Il est notable que dans ce cas ce n'est pas la combustion des végétaux collectés près de la mer, mais celle de ceux qui étaient les plus humides qui a produit le plus de polluants (CO, NOx et COVT) et d'organochlorés. Lors de cette étude, il n'y avait cependant pas de combustion d'arbres vivants, ni de sol, et les températures n'atteignaient pas celles des grands incendies[18].
Mécanismes de toxicité
Les effets toxiques des dioxines sont mesurés comparativement (en équivalents fractionnaires) à la TCDD (2,3,7,8-Tétrachlorodibenzo-p-dioxine), le membre le plus toxique et le mieux étudié du groupe des dioxines (voir TCDD pour une description plus détaillée du mécanisme). Les dioxines n’ont pas d’activité mutagène ou génotoxique directe prouvée[19] mais elles sont des promoteurs de cancers.
La toxicité des dioxines est expliquée par leurs interactions avec une protéine intracellulaire spécifique : le récepteur d’aryl d’hydrocarbone (AhR, ou AH pour « aryl hydrocarbon receptor »). Cette protéine est un facteur de transcription impliqué dans l'expression de nombreux gènes ; jouant un rôle dans la réponse aux toxines environnementales, et dans le système immunitaire des muqueuses (intestinales notamment)[20]. Sa fonction d’« amplificateur de la transcription », fait qu’il affecte à son tour un certain nombre d'autres protéines régulatrices[21] - [22] - [23].
La dioxine TCDD tend à se lier à ce récepteur AhR. Cette liaison déclenche la production d’une classe d’enzymes (enzymes du cytochrome P450 1A) qui ont pour fonction de décomposer les produits toxiques qui apparaissent ou entrent dans les cellules (par exemple les hydrocarbures polycycliques cancérigènes tels que le benzo (a) pyrène), mais en générant dans ce processus des sous-produits qui peuvent être beaucoup plus toxiques que la molécule-mère)[24].
L’affinité des dioxines (et d’autres organochlorés industrielles souvent associées) pour ce récepteur n’explique pas certains des effets toxiques des dioxines (dont notamment l’immunotoxicité, les effets endocriniens et la promotion tumorale). La réponse toxique semble dépendre de la dose, mais uniquement dans certaines plages de concentration et/ou à certains stades du développement. Une relation dose-réponse multiphasique a également été rapportée, ce qui complique l’évaluation du rôle exact des dioxines dans les cancers[25].
Les dioxines sont des perturbateurs endocriniens (perturbateur de la thyroïde notamment) probablement, avant même d’activer le récepteur AhR. La TCDD, et les autres PCDD, les PCDF et les PCB coplanaires de type dioxine, ne sont cependant pas des agonistes directs (ni des antagonistes directs) des hormones, et ils ne se montrent pas actifs dans les essais qui criblent directement ces activités telles qu'ER-CALUX et AR-. CALUX[19]. Un mélange de PCB tel que l’'Aroclor peut contenir des composés qui sont des agonistes connus des œstrogènes, mais qui ne sont en revanche pas classés comme analogues à la dioxine en termes de toxicité. Des effets mutagènes ont été établis pour certains produits chimiques à faible teneur en chlore, tels que le 3-chlorodibenzofurane, qui n'est ni persistant ni agoniste du récepteur de l'AH[26].
Toxicité chez l'animal
De nombreuses études cliniques sur les animaux ont mis en évidence une grande variété de symptômes induits par la toxicité de la dioxine, à la fois concernant les systèmes biologiques affectés et la gamme de posologie nécessaire pour les résoudre[27].
Effets aigus
Une dose unique mais élevée de dioxine induit un syndrome de dépérissement aboutissant à la mort de l’animal (en une à six semaines)[23]. (Remarque : la plupart des études de toxicité ont été faites avec la 2,3,7,8-Tétrachlorodibenzo-p-dioxine).
La DL50 de la TCDD varie cependant énormément d’une espèce à l’autre et parfois même selon les souches d’une même espèce, l’écart le plus notable étant entre les espèces apparemment proches de hamsters et de cobayes. La DL50 par voie orale chez les cobayes ne dépasse pas 0,5 à 2 μg/kg de poids corporel, tandis que chez le hamster elle peut aller jusqu'à 1 à 5 mg/kg de poids corporel[27]. Même entre différentes variétés de rats ou de souris, la toxicité aiguë peut varier d'un facteur 10 à 1 000[27].
Et entre différentes souches de souris ou de rats, il peut exister des différences de toxicité aiguë de l'ordre de dix à mille fois[27]. Les effets pathologiques les plus manifestes sont observées dans le foie, le thymus et d'autres organes.
Effets chroniques et subchroniques
Les dioxines peuvent aussi nuire à faibles doses, en particulier à des stades de développement particuliers, notamment les stades fœtal, néonatal et pubère[28]. Pour une contamination in utero, des effets sur le développement bien établis sont :
Toxicité pour l'Homme
Sur la base d'études sur le modèle animal, plusieurs types de dioxines ont été considérées comme hautement toxiques pour l'Homme, et capables de causer des problèmes de reproduction et de développement, d'endommager le système immunitaire, d'interférer avec les hormones et également de causer le cancer[29]. Une étude a estimé que la demi-vie des dioxines dans le corps humain serait de sept à onze ans[29].
À court terme, l'absorption de doses élevées de TCDD, induisent un malaise initial puis une chloracné, et une aménorrhée chez la femme[30] - [31] - [32].
Dans le cadre d'expositions professionnelles, de nombreux symptômes ont été observés, mais ces expositions étant toujours conjointes à une exposition à d'autres produits chimiques (dont par exemple chlorophénols, herbicides chlorés, chlorophénoxyacides, solvants chlorés). Il reste difficile d'attribuer avec certitude un symptôme aux dioxines ou à tel ou tel type de dioxine[33] - [29].
Les effets consensuellement suspectés ou reconnus chez l'adulte sont : des dommages au foie, des modifications du métabolisme de l'hème, des taux de lipides sériques, des fonctions thyroïdiennes, ainsi que des effets diabétiques et immunologiques[33].
Comme chez l'animal, les effets sur l'embryon et le fœtus humain semblent beaucoup plus graves que ceux qui se manifesteront chez les adultes. L'exposition intra-utérine aux dioxines et/ou à des composés apparentés a des effets délétères pour le fœtus, ou plus subtils sur l'enfant plus tard dans la vie, avec notamment des modifications de la fonction hépatique, des taux d'hormones thyroïdiennes, des globules blancs et une diminution des performances des tests d'apprentissage et d'intelligence. [23], des perturbations du développement dentaire[34], une perturbation du développement sexuel[35] et de la santé reproductive :
- chez l'Homme : on a montré après la catastrophe de Seveso que la numération et la motilité des spermatozoïdes ont été clairement été affectées, et que cette délétion de la spermatogenèse se manifeste de manière différente selon que les hommes ont été exposés avant, pendant ou après leur puberté[36] ;
- chez la Femme : les dioxines peuvent favoriser l'endométriose. Le centre de recherche sur l’endométriose (ERC) a témoigné devant la législature de l’État de Californie concernant le projet de loi 2820 (Cardoza, D-Merced) selon lequel « les produits d’hygiène féminine (c.-à-d. les tampons) donnent effectivement des résultats positifs en ce qui concerne la dioxine. — catalyseur documenté pour l'endométriose — et les effets de la dioxine sont cumulatifs ; ils peuvent être mesurés jusqu'à vingt ou trente ans après l'exposition[37]. Le CRE mentionne également une étude indépendante qui a révélé, dans une évaluation de quatre marques de tampons et quatre marques de couches pour bébés, que les dioxines « étaient présentes à des concentrations détectables dans tous les échantillons ». La présence de cette toxine dans les tampons peut être liée à l'endométriose car les dioxines ont une longue durée de vie dans l'organisme. Elles sont chimiquement stables et peuvent être absorbées par le tissu adipeux, où elles sont ensuite stockées dans le corps[29].
Faibles doses : même à des niveaux cent fois inférieurs à ceux associés à ses effets cancérigènes, la présence de dioxine peut endommager le système immunitaire, causer de graves problèmes de reproduction et de développement, ainsi qu'une interférence avec les hormones régulatrices[38].
Risques sanitaires
Les dioxines les plus chlorées sont peu dégradables (demi-vie estimée à dix-douze ans). Ces molécules sont lipophiles, d’où leur stabilité une fois introduite dans un organisme vivant animal. Elles résistent aux mécanismes de détoxification et sont emmagasinées dans les tissus adipeux des animaux. Étant chimiquement très stables, elles sont par facilement bioaccumulées, à des doses croissantes au fur et à mesure qu’on monte dans la chaîne alimentaire (Réseau trophique).
Les humains y sont exposés via l'alimentation (viande, poisson, produits laitiers) ou via l'inhalation de fumées (tabac, feux, dont incendies). Les fruits, légumes et céréales en contiennent également, mais en moindre quantité.
Chez l’humain, une exposition aiguë à de fortes concentrations de dioxines peut entraîner un trouble dermatologique, la chloracné, et une perturbation du bilan hépatique[39].
Sur le long terme, d'autres effets sont suspectés, mais débattus : troubles immunitaires et endocriniens, développement du système nerveux, cancers, troubles de la reproduction[40]... Les effets dépendent de multiples facteurs, comme le type et la fréquence d’exposition, le profil des dioxines présentes, et certains facteurs individuels. Une exposition à minima est recommandée. Selon Santé Canada, l’exposition tolérable mensuelle aux dioxines correspond à 70 pg/kg de poids corporel.
Chez l’animal, l’exposition aux dioxines a pu être associée à l'apparition de certains types de cancers.. Le Centre international de recherche sur le cancer (CIRC) a classé la dioxine 2,3,7,8 TCDD (2, 3, 7, 8 tétrachlorodibenzo-p-dioxine) dans le groupe 1 « cancérogènes pour l’Homme ». Les autres dioxines sont classifiées dans le groupe 3.
De nombreux cas de contaminations à la dioxine ont été détectés ces dernières décennies. Quelques cas graves ont eu des conséquences importantes dans différents pays. Le premier cas de contamination survient à la suite de la surchauffe d’un réacteur d’une usine à Seveso (Italie) en . Le nuage toxique libéré a contaminé une zone de 15 km2 et ses 37 000 habitants. À la suite de cet incident, des cas de chloracné ont été identifiés. Des études approfondies se poursuivent pour déterminer les effets à long terme sur la population. Des études ont été également réalisées sur « l’agent orange », herbicide défoliant utilisé lors de la guerre du Viêt Nam. Les scientifiques poursuivent leurs recherches sur un lien possible avec certains types de cancers et le diabète.
En résumé, un lien est établi entre une exposition aiguë aux dioxines, et à des doses importantes (à partir du microgramme par kilogramme de masse corporelle par jour) qui peuvent provoquer la chloracné et des perturbations du bilan hépatique. Concernant les expositions chroniques à des doses plus faibles sur de plus longues périodes, les effets sont moins bien identifiés mais semble présents. Chez l’Homme, seuls quelques rares cas de cancers se sont déclarés bien des années après des expositions en milieu professionnel.
Dioxines dans les plantes
Avant 1990, très peu d’information était disponible sur la contamination de différentes parties des végétaux (racines, tiges, feuilles, fruits) et des différentes strates végétales par les dioxines et furanes, alors que ces données sont très importante pour modéliser les risques de contamination du gibier, des animaux d’élevage et de rente, et des produits du jardin ou du potager.
On sait que le taux d’absorption varie selon le type d’organochloré, selon le type de plante et qu’au moins quatre voies d’entrée de ces organochlorés dans les plantes existent à partir du sol, de l’air ou moindrement de l’eau[41] :
- via l’adsorption à la surface des cellules racinaires ;
- via une translocation par la sève, des racines vers les parties aériennes ;
- via l’absorption de dioxines et /ou furanes volatiles directement par les cellules des parties aériennes des végétaux le type de cuticules (cireuses ou non) et de stomates pouvant alors probablement aussi jouer un rôle) ;
- par dépôts de dioxines et furanes sur les feuilles et tiges (dépôts secs ou humides).
Contamination de la strate herbacée
En 1994, McCrady rend compte d’une étude où il a exposé durant 96 h différents végétaux (herbe, azalée, épinette, chou frisé et poivron) et 3 fruits (pomme, tomate et poivron) à du 3H-2,3,7,8-TCDD en phase vapeur. Il constate que le taux de sorption de cette dioxine varie considérablement (de deux ordres de grandeur parfois) pour les différents tissus végétaux et selon l’espèce ; il a estimé[42] que la première voie de contamination des végétaux est le dépôt sur les parties aériennes plutôt que la translocation à partir du sol via les racines. Et il n’observera pas de différence selon que la cuticule soit cireuse ou non (remarque : des informations contradictoires existent sur le rôle des cuticules cireuses dans la captation d’organochorés lipophiles). Cette même année (1994), Huelster et al. montrent que chez le concombre, la contamination se fait essentiellement via les dépôts sur les feuilles[41].
À la même époque, plusieurs équipes de chercheurs suspectent que les dioxines (PCDD et furanes (F) (stockés dans le sol ou apportés par divers intrants tels que compost, boues d'épuration, cendres et autres amendements organiques…) peuvent aussi être volatilisés à partir du sol, notamment quand il est réchauffé par le soleil, pour ensuite être ensuite absorbés par les tissus aériens de la plante.
En effet, Schroll et Scheunert (en 1993) ont analysé la présence d’OCDD dans divers organes de la carotte cultivée ; ils en ont trouvé dans les feuilles, et dans la racine, mais sans observer aucune translocation des racines vers les parties aériennes (durant quatorze jours d’observation). Il montre que la volatilisation des OCDD à partir du sol permet bien une captation foliaire[43].
En 1995, Welsch-Pausch et al. concluent que c’est aussi le cas chez Lolium perenne[44]. En 1996, Trapp et Matthies concluent de leurs travaux que cette voie sol→air→feuille est possible, mais selon eux uniquement en présence de sols très contaminés[45].
Cependant, au même moment (1994), on découvre que certaines plantes (alimentaires) captent les dioxines et furanes via les racines et les transloquent à leurs parties aériennes via la sève : parmi les espèces testées, les citrouilles et courgettes se montrent très « efficace » pour cela ; Cucurbita pepo étant en 1994 celle qui transportait le mieux ces organochlorés du sol vers la partie aérienne de la plante[41], y compris dans le fruit (les cucurbitacées accumulent les dioxines et furanes dans leurs fruits avec des concentrations qui sont jusqu’à deux ordres de grandeur supérieures aux quantités trouvées dans les autres fruits et légumes[41]. Les auteurs posent alors l’hypothèse que cette translocation pourrait être permise parce que les cucurbitacés produisent des exsudats racinaires particuliers[41].
Campanella et Paul (2000) ont confirmé cette hypothèse chez Cucumis melo et Cucurbita pepo qui produisent effectivement des substances pouvant se lier aux dioxines et aux furanes[46].
En 2007, Jou et al. ont analysé la concentration de dioxines dans diverses espèces de plantes ; elle variait de 12,7 à 2 919 ng TEQ de dioxines par kg de matière sèche quand le taux de dioxines du sol variait de 74,6 à 979 000 ng TEQ par kg de sol. La plupart des espèces végétales en contenaient plus dans leurs feuilles que dans leurs racines[47].
En 2008, Fang et al. prouvent chez trois espèces de plantes (Phragmites australis, Polygonum orientale, et Artemisia selengensis) exposées à des dioxines et furanes que ces végétaux se sont majoritairement contaminés (avec accumulation dans certains tissus) à partir de la volatilisation des composés du sol, via les feuilles[48].
En 2009, Zhang et al., pour mieux identifier la part de dioxines et furanes absorbé/adsorbée via l’air celle absorbée /adsorbée via les racines ont calculé, chez le chrysanthème et chez onze espèces de plantes alimentaires, la quantité de dioxines et furanes accumulée dans les plantes par volatilisation d’une part et par translocation à partir du sol (ils ont cultivé des plantes dans un substrat non-contaminé mais près de sols contaminés afin de mesurer la part des dioxines/furanes absorbée directement à partir de l’air via les feuilles[49]. Selon ce travail : chez le maïs, soja, riz, chou, tomate et chrysanthème, la translocation est négligeable ; inversement, elle est majeure chez les cucurbitacées, mais aussi chez le blé et le sorgho (blé et sorgho présentant des facteurs de translocation respectivement de 0,0013 et 0,0012, qui restent inférieurs à celui de la courgette : 0,0089)[49].
En 2013, Hanano et al. se sont intéressés à la capacité d’Arabidopsis thaliana à accumuler la TCDD, montrant qu’elle peut absorber et accumuler 20 ± 2, 27,5 ± 3 et 28,5 ± 2 pg/g dont 20 ± 2, 27,5 ± 3 et 28,5 ± 2 pg/g par translocation quand elle est exposée à des taux de 10, 50 et 100 ng de TCDD L-1 respectivement[50].
En 2017, Urbaniak et al. montrent que cinq semaines de cultures de cucurbitacées suffisent à significativement réduire la phytoxicité racinaire d’un sol ayant reçu des boues d’épuration polluées (dont par des dioxines et furanes) …mais les produits récoltés seront enrichis en ces produits[51] - [52].
Contamination des arbres ?
Plus en hauteur, la strate arborée se montre capable d’intercepter de nombreux polluants et parfois de les adsorber.
Les dioxines, furanes et autres organochlorés aérotransportés se déposent en partie sur les feuillages ; on a montré que les cuticules cireuses des aiguilles de pins peuvent les stocker[53] - [54] (permettant une biosurveillance pour ces composés[55]).
En 2018, dans un site planté de pins exposés durant une décennie aux émissions d’une combustion à ciel ouvert de déchets municipaux solides, Haddad et al. ont étudié le devenir de dioxines ayant contaminé ces arbres. Sur ce site, le taux de dioxines du sol était de 10 à 35 % supérieur à la moyenne attendue, et les auteurs y ont détecté des pics de concentration sous les arbres ; ces « flaques de dioxines » résultent du lessivage des arbres contaminés par les pluies (les chutes d’aiguilles contaminées au sol sont beaucoup plus éparpillantes pour la contamination). Ils concluent qu’il existe un effet de rinçage via les pluies provoquant des taches de concentration sous les arbres[56].
Méthode de prélèvements
Outre les préleveurs en continu, il est souvent nécessaire de faire des mesures ponctuelles. Selon l'Ineris (1999), les préleveurs de pluies, de particules ainsi que des surfaces artificielles peuvent servir de lieux de collecte de dioxines, mais ils risquent de ne pas capter la phase gazeuse, d'être lessivés par les pluies, et surtout, ils ne simulent que très imparfaitement les surfaces biologiques ou naturelles qui fixent les dépôts susceptibles de directement contaminer les organismes et la chaîne alimentaire[1]. Il est donc recommandé d'utiliser des techniques de biosurveillance (ou biomonitoring) basées sur l'analyse d'échantillons de végétaux naturels ou cultivés en place et/ou de végétaux « de simulation » (plantes en pots semées ad hoc sur un substrat et dans un environnement exempt de dioxines (afin de différencier la pollution chronique de retombées récentes)[1], avec comme limite en zone froide ou tempérée le caractère saisonnier de la végétation (ce interdit la comparaison de résultats concernant des lieux et périodes différents). Les sols sont considérés comme le réservoir principal des dioxines, mais les mesures y présentent une grande variabilité « sur un même site et d'un site à l'autre. Ceci implique un nombre de points de prélèvement par site relativement important »[1];
Méthode analytique
L’analyse chimique quantitative des dioxines est complexe, coûteuse et nécessite des précautions en raison de leur toxicité à faible dose. À la fin du XXe siècle dans le monde, peu de laboratoires pouvaient en faire des analyses précises.
La méthode d’analyse dépend du type d'échantillon. Les quantités de dioxine sont souvent de grandeur picométrique, nécessitant une méthode analytique extrêmement sensible et à basse limite de détection, avec des contrôles de qualité précis. La chromatographie gazeuse couplée à la spectrométrie de masse à haute résolution (HRGC/MS) est souvent retenue, car répondant à ces critères. Les quantités d'échantillon et de solvants doivent pouvoir être faibles, car le volume d’injection est de l’ordre du microlitre pour cette méthode, qui est recommandée par l'US EPA et les directives Européennes pour les aliments et l’eau[57] - [58].
Réglementation
Au niveau mondial
- En 1995 (mai), à Nairobi, l'ONU considère la nécessité d’actions internationales pour réduire et d’éliminer les rejets et émissions de polluants organiques persistants (POP).
- En 1997, le Conseil de direction (GC) du PNUE a lancé[59] un travail de recherche et diffusion sur « les alternatives possibles aux POPs, les inventaires des PCBs et des technologies de destruction disponibles, ainsi que les stratégies de gestion pour les PCDD/PCDF »[3].
- En 1998, le Protocole Aarhus de l'UNECE sur les POP est signé dans le cadre de la Convention UNECE sur la pollution atmosphérique transfrontière à longue distance[60] .
- En 1999, le PNUE constate que les quelques inventaires existants de sources d'émissions sont incomplets et basés sur des méthodes différentes, ne permettant pas d'inter-comparaison[3].
- En 2001 (janvier) dans le cadre de l’IOMC (Programme Inter-organisme pour la Gestion rationnelle des Produits Chimiques) sous l'égide de l'ONU, le PNUE Substances Chimiques, a publié un projet d'« Outil Normalisé pour l’Identification et la Quantification de Rejets de Dioxines et de Furannes » sous forme de projet, dit « ToolKit »[3] (traduit en espagnol, français et russe).
Cette même année, la commission du codex Alimentarius adopte un code d’usages pour réduire à la source la contamination des aliments par les substances chimiques (et en 2006, le Codex publiera un Code d’usages pour prévenir et réduire la contamination des aliments par les dioxines et les PCB de type dioxine)[3]. - Mi-2002, la 6e session du Comité Intergouvernemental de Négociation de la Convention de Stockholm (décision 6/4) considère que le ToolKit peut aider à l'évaluation de rejets actuels et projetés de POP (dont dioxines), tout en invitant à encore l'améliorer avant la session suivante, ce qui sera fait pour une publication en 2003[3] ; des ateliers de formation à l'utilisation de l'outil ont été proposés par le PNUE à un niveau infrarégional.
- La Directive européenne « Prévention et contrôle intégrées de la pollution » impose la création d’un Registre européen des émissions polluantes (EPER) pour permettre la diffusion d’informations provenant de différentes installations[61].
En Europe
- L’UE, dans son cinquième programme d’action pour l’environnement, visait une réduction de 90 % des émissions de 1985 à 2005.
De 1985 à 1996, la quantité totale de dioxines d’origine industrielle a été réduite de moitié. Le taux moyen de dioxines du sang humain est passé de vingt à dix picogrammes[alpha 1] TEQ par gramme de lipides en quelques années. L’usage de PCB a été interdit ou abandonné.
Les normes d'incinération se sont durcies (maximum de 0,1 ng de dioxine par mètre cube normalisé de fumée). En Flandre, l’incinération des ordures ménagères a diminué de 85 % ses émissions de dioxines en dix ans.
En Amérique
Le Canada a pris des mesures de réduction et contrôle des dioxines rejetées dans l’environnement, avec notamment des directives sur les rejets de dioxines et de furanes par les incinérateurs de déchets urbains et dangereux. Des règlements visent une élimination quasi totale des rejets de dioxines dans les usines de pâte à papier et de fabrication de produits antiparasitaires. Les dioxines et de furanes ont diminué de 60 % dans l’environnement canadien depuis 1960[62].
Évaluation des risques environnementaux et sanitaires
En 2012, divers auteurs dont George M. Gray[alpha 2] et Joshua T. Cohen[alpha 3] suggèrent de revoir les méthodes d'évaluation des risques liés aux dioxines[63].
L'OMS recommande un seuil sanitaire de dose journalière admissible de 4 pg d'équivalent dioxine par kilogramme de masse corporelle par jour (c'est-à-dire 280 pg/j pour une personne de 70 kg)[64] ou une dose mensuelle tolérable provisoire de 70 pg/kg de poids corporel/mois[65].
Le CITEPA évalue à 117 g d'équivalent toxique, la quantité de dioxine émise dans l'air en France métropolitaine en 2014. Il s'agit du taux le plus bas enregistré en France depuis le début des relevés, en 1990[66].
La stabilité chimique des dioxines leur confère une faible biodégradabilité donc une très longue durée de vie. La production et l'utilisation de dioxines ont été bannies en 2001 par la Convention de Stockholm.
Expositions historiques aux dioxines
Quelques cas parmi les plus documentées sont :
- l'exposition à l'agent orange, un désherbant/défoliant utilisé lors de la guerre du Viêt Nam par l'armée des États-Unis (de 1961 à 1971) sur la jungle vietnamienne. Ce pesticide était contaminé par des dioxines lors de sa fabrication ;
- la catastrophe de Seveso en 1976, dans une usine chimique à Seveso (Italie) ;
- l'affaire de la forte pollution à la dioxine liée à l'incinérateur de Gilly-sur-Isère près d'Albertville en 2001 a également marqué l'histoire judiciaire française[67] ;
- probablement lors de la tentative d'empoisonnement en 2004 sur Victor Iouchtchenko, premier ministre ukrainien au moment des faits.
Cinétique environnementale
Après leur genèse, les dioxines peuvent rapidement retomber au sol et/ou se fixer à des particules aéroportées (suies…) et parcourir ainsi de longues distances. Les pluies lessivant de l'air pollué et les eaux de ruissellement peuvent contaminer des sédiments, le bouchon vaseux d'estuaires et les océans. Les sols sont contaminés par des dépôts aériens, mais surtout par les feux, de déchets contaminés, ou par l'incorporation de cendres ou de boues d'épuration parfois contaminées[3].
Dioxines et furanes ont une longue durée de vie et sont bioaccumulables, notamment dans les tissus gras d'animaux situés au sommet de la pyramide alimentaire. Nombre de ces animaux (ex. : baleines, cachalot, oiseaux, grands poissons prédateurs) sont aussi de grands migrateurs : en migrant d'un continent à l'autre, ces animaux et leurs cadavres sont à l'origine d'une large diffusion de ces polluants. Les nécrophages et la bioturbation sont des sources de remobilisation des dioxines, ainsi que des furanes et des métaux toxiques qui leur sont souvent associés.
Méthode d'inventaire
Pour respecter la Convention de Stockholm, juridiquement contraignante, qui demande aux parties de diminuer autant que possible ou d’éliminer les émissions de PCDD/PCDF, un inventaire national des sources chroniques ou accidentelles de POP doit être fait. Cet inventaire doit permettre le contrôle des émissions et une intercomparaison entre pays[3].
En 1999, le PNUE Substances Chimiques a constaté[68] que seuls quinze pays disposaient d'un inventaire national des émissions de dioxines et furanes. Ces pays étaient tous riches et situés dans l'hémisphère nord. Leur rapport omettait en outre souvent de traiter des sources contaminant les sols et l'eau (ne comptabilisant que les émissions dans l'air).
L'ONU a donc publié une méthode et un outil pour aider les parties de la convention ou d'autres États volontaires à estimer l'inventaire de leurs rejets de polychlorodibenzo-p-dioxines et de polychlorodibenzofurannes (PCDD/PCDF) à l'échelle du pays et de manière standardisée[3].
Notes et références
Notes
- Un picogramme = un millionième de millionième de gramme ou 10−12 g.
- Chercheur, ancien administrateur et conseiller scientifique de l'EPA, et actuel directeur du Center for Risk Science and Public Health (université George-Washington).
- Directeur adjoint du Center for the Evaluation of Value and Risk in Health at Tufts Medical Center (Boston, Massachusetts), ancien membre des comités de l'Académie nationale ayant travaillé avec l'EPA sur l'évaluation des risques toxicologiques posés par les dioxines et ses méthodologies d'évaluation du risque (de 2006 à 2009).
Références
- Nomine M (1999) Dioxines. Méthodologie pour l'évaluation des retombées, INERIS, juin.
- Sous-paragraphe (a) de l’Article 5 de la Convention de Stockholm sur les polluants organiques persistants (POP).
- ONU (2003) Outil spécialisé (Toolkit) pour l'identification et quantification des rejets de dioxines et des furannes.
- « Des molécules à la vie dure », sur univ-fcomte.fr, mai 2011.
- Klimm, C., Schramm, K. W., Henkelmann, B., Martens, D. et Kettrup, A. (1998), Formation of octa-and heptachlorodibenzo-p-dioxins during semi anaerobic digestion of sewage sludge, Chemosphere, 37(9-12), 2003-2011 ; résumé.
- ONU (2003) Outil spécialisé (Toolkit) pour l'identification et quantification des rejets de dioxines et des furannes. ; voir p. 21.
- Holt, E., Von Der Recke, R., Vetter, W., Hawker, D., Alberts, V., Kuch, B., … et Gaus, C. (2008), Assessing dioxin precursors in pesticide formulations and environmental samples as a source of octachlorodibenzo-p-dioxin in soil and sediment, Environmental Science & Technology, 42(5), 1472-1478 (résumé).
- Nicholas J. L. Green, Joanne L. Jones et Kevin C. Jones (2001), PCDD/F Deposition Time Trend to Esthwaite Water, U.K., and Its Relevance to Sources, Environ. Sci. Technol., 35(14), 2882–2888, DOI 10.1021/es000225.
- Tritz A (2014), Oxydation de pyrolyse du dibenzofurane à très faibles concentrations : application à la réduction des émissions de dioxines (Doctoral dissertation, université de Lorraine).
- Haddad, A., Moqbel, S. et Abdelhadi, M. (2018), Evaluating the effecteffect of rain on the fate of polychlorinated dibenzo-p-dioxins (PCDDs) and polychlorinated dibenzofurans (PCDFs) accumulated in polluted trees in Amman, Jordan, Environmental Science and Pollution Research, 25(11), 10644-10653 (lire en ligne).
- Route B.F () Dioxins in Waste Combustion–Conclusions from 20 Years of Research.
- (en) Holt E., Weber R., Stevenson G. et Gaus C. (2012), Formation of dioxins during exposure of pesticide formulations to sunlight, Chemosphere, 88(3), 364-370.
- Holt, E., Weber, R., Stevenson, G. et Gaus, C. (2012), Formation of dioxins during exposure of pesticide formulations to sunlight, Chemosphere, 88(3), 364-370).
- (en) Schmitz M., Scheeder G., Bernau S., Dohrmann R. et Germann K. (2010), Dioxins in primary kaolin and secondary kaolinitic clays, Environmental Science & Technology, 45(2), 461-467.
- Collet S (2000), Facteurs d’émission - Émissions de dioxines, de furanes et d’autres polluants liées à la combustion de bois naturels et adjuvantés, ministère de l'aménagement du territoire et de l'environnement, ministère de l'environnement, INERIS–DRC-no 00/60-MAPA-SCo-25420, février, p. 31.
- (en) Gullett B.K. et al. (2000), The Role of Chlorine in Dioxin Formation, Process Safety and Env. Protection, 78, no 1, S. 47-52.
- (en) Forest fires as a source of PCDD and PCDF, Clement and Tashiro, 11th Symposium on Chlorinated dioxins and related compounds, 1991.
- Rapport sur les facteurs d’émission de polluants de feux simulés de forêt et de décharge, Ineris/Ademe, novembre 2004, 17 p.
- Dragan YP, Schrenk D, « Animal studies addressing the carcinogenicity of TCDD (or related compounds) with an emphasis on tumour promotion », Food Additives and Contaminants, vol. 17, no 4, , p. 289–302 (PMID 10912243, DOI 10.1080/026520300283360).
- Cédric Vonarbourg, Le récepteur d’aryl d’hydrocarbone, lien moléculaire entre alimentation et immunité ; The aryl hydrocarbon receptor, a molecular link between diet and immunity, Med. Sci., Paris, 2012, 28 : 255–258, lire en ligne.
- Dencker L, « The role of receptors in 2,3,7,8-tetrachlorodibenzo-p-dioxin (TCDD) toxicity », Arch. Toxicol. Suppl., vol. 8, , p. 43–60 (ISBN 978-3-540-13670-5, PMID 3006634, DOI 10.1007/978-3-642-69928-3_5).
- Poellinger, L., « Mechanistic aspects—the dioxin (aryl hydrocarbon) receptor », Food Additives and Contaminants, vol. 17, no 4, , p. 261–266 (PMID 10912240, DOI 10.1080/026520300283333).
- (en) Lindén J., Lensu S., Tuomisto J. et Pohjanvirta R., « Dioxins, the aryl hydrocarbon receptor and the central regulation of energy balance », Front Neuroendocrinol, vol. 31, no 4, , p. 452–78 (PMID 20624415, DOI 10.1016/j.yfrne.2010.07.002).
- Okey, A. B., « An aryl hydrocarbon receptor odyssey to the shores of toxicology: The Deichmann lecture », International Congress of Toxicology-XI. Toxicological Sciences, vol. 98, no 1, , p. 5–38 (PMID 17569696, DOI 10.1093/toxsci/kfm096, lire en ligne).
- FN ISI Export Format VR 1.0 PT J TI The J-shaped dioxin dose response curve AU Kayajanian, GM SO ECOTOXICOLOGY AND ENVIRONMENTAL SAFETY VL 51 IS 1 BP 1 EP 4 PY 2002 TC 6 AB This commentary responds to a recent statistical treatment of cancer incidence data in selected workers exposed to dioxin from an earlier NIOSH chemical plant study. Contrary to the NIOSH authors' new findings, the cancer incidence response to increasing dioxin exposure is J-shaped, just as it is in the two major data sets that they failed to reference or explain away. The NIOSH statistical treatment obscured the significant reduction in cancer incidence that occurs at low dioxin exposures. Even though cancer incidence may increase at high dioxin exposures, such increase may be preceded at lower exposures by a significant reduction. (C) 2002 Elserier Science. UT WOS:000173569400001 SN 0147-6513 DI 10.1006/eesa.2001.2115 ER EF.
- Matsumoto M, Ando M, « Mutagenicity of 3-chlorodibenzofuran and its metabolic activation », Environ Mol Mutagen, vol. 17, no 2, , p. 104–11 (PMID 2009865, DOI 10.1002/em.2850170207).
- Pohjanvirta R. et Tuomisto J., « Short-term toxicity of 2,3,7,8-tetrachlorodibenzo-p-dioxin in laboratory animals: effects, mechanisms, and animal models », Pharmacol. Rev., vol. 46, no 4, , p. 483–549 (PMID 7899475).
- Birnbaum L.S. et Tuomisto J., « Non-carcinogenic effects of TCDD in animals », Food Addit. Contam., vol. 17, no 4, , p. 275–288 (PMID 10912242, DOI 10.1080/026520300283351).
- (en) « Dioxins and their effects on human health, Fact sheet no 225 », sur World Health Organization, .
- (en) « Synopsis on dioxins and PCBs », thl.fi, sur thl.fi.
- Geusau A, Abraham K, Geissler K, Sator MO, Stingl G, Tschachler E, « Severe 2,3,7,8-tetrachlorodibenzo-p-dioxin (TCDD) intoxication: clinical and laboratory effects », Environ. Health Perspect., vol. 109, no 8, , p. 865–869 (PMID 11564625, PMCID 1240417, DOI 10.1289/ehp.01109865).
- Sorg O, Zennegg M, Schmid P, Fedosyuk R, Valikhnovskyi R, Gaide O, Kniazevych V, Saurat JH, « 2,3,7,8-tetrachlorodibenzo-p-dioxin (TCDD) poisoning in Victor Yushchenko: identification and measurement of TCDD metabolites », Lancet, vol. 374, no 9696, , p. 1179–1185 (PMID 19660807, DOI 10.1016/s0140-6736(09)60912-0).
- Sweeney M.H. et Mocarelli P., « Human health effects after exposure to 2,3,7,8- TCDD », Food Addit. Contam., vol. 17, no 4, , p. 303–316 (PMID 10912244, DOI 10.1080/026520300283379).
- Alaluusua S, Calderara P, Gerthoux PM, Lukinmaa PL, Kovero O, Needham L, Patterson DG, Tuomisto J, Mocarelli P, « Developmental dental aberrations after the dioxin accident in Seveso », Environ. Health Perspect., vol. 112, no 13, , p. 1313–1318 (PMID 15345345, PMCID 1247522, DOI 10.1289/ehp.6920).
- P. Mocarelli, P.M. Gerthoux, E. Ferrari, D.G. Patterson Jr., S.M. Kieszak, P. Brambilla, N. Vincoli, S. Signorini, P. Tramacere, V. Carreri, E.J. Sampson, W.E. Turner et L.L. Needham, Paternal concentrations of dioxin and sex ratio of offspring, Lancet, 355 (2000) 1858–1863.
- Mocarelli, P., Gerthoux, P. M., Patterson Jr., D. G., Milani, S., Limonta, G., Bertona, M., … et Brambilla, P. (2007), Dioxin exposure, from infancy through puberty, produces endocrine disruption and affects human semen quality. Environmental health perspectives, 116(1), 70-77.
- « ERC Responds to Recent Endometriosis Study » [archive du ], sur Endometriosis Research Center (consulté le ).
- Mayani A, Barel S, Soback S, Almagor M, « Dioxin Concentrations in Women with Endometriosis », Hum Reprod, vol. 12, no 2, , p. 373–5 (DOI 10.1093/humrep/12.2.373).
- INSERM, .
- Santé Canada, lire en ligne.
- Huelster, A., Mueller, J. F. et Marschner, H. (1994), Soil-Plant Transfer of Polychlorinated Dibenzo-P-Dioxins and Dibenzofurans to Vegetables of the Cucumber Family (Cucurbitaceae), Environmental Science & Technology, 28 (6) : 1110-1115.
- McCrady, J. K. (1994), Vapor-phase 2,3,7,8-TCDD sorption to plant foliage—a species comparison, Chemosphere, 28(1), 207-216 (résumé).
- Schroll, R. et Scheunert, I. (1993), Uptake pathways of octachlorodibenzo-p-dioxin from soil by carrots, Chemosphere, 26(9), 1631-1640 (résumé).
- Welsch-Pausch, K., Mclachlan, M. S. et Umlauf, G. (1995), « Determination of the Principal Pathways of Polychlorinated Dibenzo-P-Dioxins and Dibenzofurans to Lolium Multiflorum (Welsh Ray Grass) », Environmental Science & Technology, 29 (4) : 1090-1098.
- Trapp S et Matthies M (1996) Modeling Volatilization of Pcdd/F from Soil and Uptake into Vegetation, Environmental Science & Technology, 31 (1) : 71-74 (résumé).
- (en) Campanella, B., Bock, C. et Schröder, P. (2002), Phytoremediation to Increase the Degradation of Pcbs and Pcdd/Fs, Environmental Science and Pollution Research, 9 (1) : 73-85.
- (en) Jou, J.-J., Chung, J.-C., Weng, Y.-M., Liaw, S.-L. et Wang, M. K. (2007), Identification of Dioxin and Dioxin-Like Polychlorbiphenyls in Plant Tissues and Contaminated Soils, Journal of Hazardous Materials, 149 (1): 174-179 (résumé).
- (en) Fang, L., Zheng, M., Xiao, K. et Yang, Y. (2008) Tissue‐Dependent Distribution and Bioaccumulation of Polychlorinated Dibenzo‐P‐Dioxins and Dibenzofurans in Vegetation Samples Collected from Dongting Lake, China, Environmental Toxicology and Chemistry, 27 (1): 49-56.
- (en) Zhang, H., Chen, J., Ni, Y., Zhang, Q. et Zhao, L. (2009) Uptake by Roots and Translocation to Shoots of Polychlorinated Dibenzo-P-Dioxins and Dibenzofurans in Typical Crop Plants, Chemosphere, 76 (6) : 740-746.
- (en) Hanano A., Almousally I. et Shaban M. (2013), Phytotoxicity Effects and Biological Responses of Arabidopsis Thaliana to 2, 3, 7, 8-Tetrachlorinated Dibenzo-P-Dioxin Exposure, Chemosphere.
- (en) Urbaniak, M., Zieliński, M. et Wyrwicka, A. (2017), The influence of the Cucurbitaceae on mitigating the phytotoxicity and PCDD/PCDF content of soil amended with sewage sludge, International Journal of Phytoremediation, 19(3), 207-213 (résumé).
- Wyrwicka, A., Urbaniak, M. et Przybylski, M. (2019), The response of cucumber plants (Cucumis sativus L.) to the application of PCB-contaminated sewage sludge and urban sediment, PeerJ, 7, e6743.
- (en) Chen J., Zhao H., Gao L., Henkelmann B. et Schramm K.-W. (2006), Atmospheric PCDD/F and PCB levels implicated by pine (Cedrus deodara) needles at Dalian, China, Environ. Pollut., 144(2):510–515, DOI 10.1016/j.envpol.2006.01.039.
- Chen P., Xiao X., Mei J., Cai Y., Tang Y. et Peng P. (2017), Characteristic accumulation of PCDD/fs in pine needles near an MSWI and emission levels of the MSWI in Pearl River Delta: a case study 2017, Chemosphere, 181:360–367, DOI 10.1016/j.chemosphere.2017.04.098.
- Safe S, Brown K, Donnelly K, Anderson C, Marktowicz K, McLachlan M, Relschl A et Hutzlnger O (1992), Polychlorinated dibenzo-p-dioxins and dibenzofurans associated with wood-preserving chemical sites: biomonitoring with pine needles, Environ. Sci. Technol., 26(2) : 394–396, DOI 10.1021/es00026a023.
- (en) Haddad A., Moqbel S. et Abdelhadi M. (2018), Evaluating the effect of rain on the fate of polychlorinated dibenzo-p-dioxins (PCDDs) and polychlorinated dibenzofurans (PCDFs) accumulated in polluted trees in Amman, Jordan, Environmental Science and Pollution Research, 25(11), 10644-10653 (lire en ligne).
- [R. L. Harless, E. 0. Oswald et M. K. Wilkinson, Anal. Chem., 1980, 52, p. 1239-1244].
- [Dirk Krumwieds et Hans Joachim Huebschmann, Thermo Electron Corporation, Brême, Allemagne, DFS-High Resolution GC/MS: confirmation of low lever and Furans in dirty matrix samples].
- Décision 19/13 C du 7 février 1997, du Conseil de direction du PNUE.
- Protocole Aarhus, UNECE.
- Directive IPPC ; documents BAT ; registre EPER.
- (environnement Canada).
- (en) George M. Gray et Joshua T. Cohen, « Policy: Rethink chemical risk assessments », Nature, vol. 489, (résumé).
- (en) « Consultation on assessment of the health risk of dioxins; re-evaluation of the tolerable daily intake (TDI): executive summary », Food Additives and Contaminants, vol. 17, no 4, , p. 223–40 (PMID 10912238, DOI 10.1080/713810655).
- (en) WHO, « Safety Evaluation of Certain Food Additives and Contaminants. Poly-chlorinated Dibenzodioxins, Polychlorinated Dibenzofurans, and Coplanar Polychlorinated Biphenyls », WHO Food Additive Series, , p. 48 (lire en ligne).
- « Dioxines et furanes - PCDD-F », CITEPA (consulté le ).
- Bertrand Olivier, « Dioxine à Albertville : la juge en ligne de mire », Libération, (lire en ligne).
- PNUE Substances Chimiques, 1999.
Annexes
Articles connexes
- Organochloré
- Chloracné
- Facteur d'équivalence toxique
- Poisson : élevage en eaux troubles (documentaire)
- Directive IPPC (Prévention et contrôle intégrées de la pollution) (Union européenne)
- Furane
- Octachlorodibenzodioxine
Liens externes
- Les dioxines et leurs effets sur la santé, sur who.int
- Documents sur la surveillance environnementale, sur developpement-durable.gouv.fr
- Consensus scientifique sur les dioxines, sur greenfacts.org
- Guide EMEP des Inventaires sur les Émissions (EMEP/CORINAIR) : aide à l’application des méthodologies des inventaires sur l’atmosphère, Protocole, EMEP, Guide
- Procédures de quantification et déclaration harmonisées pour les émissisons de produits toxiques (HARP-HAZ) vers le milieu marin (géré par l’Autorité norvégienne de Contrôle de la Pollution (SFT), plus particulièrement fait pour les pays d’Europe du Nord ; lire en ligne
- Bureau de centralisation (lire en ligne) des registres des Rejets et des Transferts de Polluants (PRTR) (cf. recommandations de l'Agenda 21 (chapitre 19) du CNUED voulant que les gouvernements et organisations internationales appropriés, avec la coopération de l’industrie, œuvrent notamment à « améliorer les bases de données et les systèmes d’information concernant les produits chimiques, tels que les programmes d’inventaires sur les émissions. »
Bibliographie
- Mortgat B. (2016), Dioxines et furanes : les détruire, 2268-3798.
- Nomine M. (1999), Dioxines. Méthodologie pour l'évaluation des retombées, INERIS, juin.
- Van Staëvel E. (2003), Natures de la pollution : approche anthropologique des représentations de la dioxine et de son impact sanitaire (Doctoral dissertation, Paris, EHESS) (résumé).