Endométriose
L'endométriose est une maladie gynécologique chronique et inflammatoire, liée à la présence de tissu semblable à la muqueuse utérine, en dehors de la cavité utérine. Elle peut être asymptomatique, mais également provoquer des douleurs, parfois invalidantes (dysménorrhée, dyspareunie), des problèmes d'infertilité[1], ou des symptômes intestinaux (diarrhées, constipation).
| Médicament | Danazol, hydroxyprogesterone, leuprorelin, noréthistérone, ethynodiol diacetate (en), desogestrel (en), nafarelin (en), acétate de goséréline (en), lévonorgestrel, étonogestrel, goséréline, ethinyl estradiol / norethindrone (d), médroxyprogestérone (en), leuprorelin et ethisterone (en) |
|---|---|
| Spécialité | Gynécologie |
| CISP-2 | X99 |
|---|---|
| CIM-10 | N80 |
| CIM-9 | 617.0 |
| OMIM | 131200 |
| DiseasesDB | 4269 |
| MedlinePlus | 000915 |
| eMedicine |
271899 ped/677 emerg/165 |
| MeSH | D004715 |
| Patient UK | Endometriosis-pro |
![]() Mise en garde médicale
Mise en garde médicale
On observe ce phénomène principalement dans la cavité abdominale,
- sur le péritoine (endométriose péritonéale superficielle),
- en zone sous péritonéale (endométriose pelvienne profonde),
- au niveau des ovaires (kyste de l’ovaire endométriosique).
Dans les cas d'endométriose pelvienne profonde, ce tissu ectopique (glandes et/ou de stroma endométrial) peut se retrouver sur les ligaments utéro-sacrés, sur le vagin, sur les organes digestifs, comme le rectum, sur la vessie, voire sur les reins, et plus rarement, sur le diaphragme, les poumons, les tissus mous, les os et le cerveau[2]. Ce tissu endométrial est hormono-sensible, comme l'endomètre et suit donc le cycle menstruel.
Si l'endométriose se situe à l'extérieur de l'utérus, elle est souvent associée à l’adénomyose, correspondant à la présence de glandes et/ou de stroma endométrial dans le myomètre[3].
L'endométriose a été observée pour la première fois au microscope par Karel Rokitansky en 1860, alors que des symptômes évocateurs de l'endométriose (dysfonctionnement menstruel, la grossesse comme remède possible, les douleurs pelviennes et l'infertilité) sont décrits depuis l'antiquité[4]. Toutefois, l'endométriose étant une maladie multifactorielle[5], son étiologie, son évolution, sa physiopathologie font encore l'objet d'investigations[6].
Épidémiologie
Fréquence
Dans le monde, 190 millions de personnes sont concernées par l'endométriose[7], soit près de 10 % des personnes menstruées[8] - [9]. Toutefois, toutes ne sont pas diagnostiquées, car l'affection peut être asymptomatique, présenter des symptômes variables, et communs à d'autres affections, et nécessite de l'imagerie médicale (cœlioscopie, IRM). La prévalence de l'endométriose est supérieure parmi les hommes transgenres par rapport aux femmes cisgenres[10].
L'endométriose est à l'origine de près de la moitié des dysménorrhées[9]. En outre, 5 à 15 % des cas d'infertilité ou de sous-fertilité sont attribués à l'endométriose[11]. L'endométriose entraînerait des difficultés de reproduction jusqu'à 50 % des cas[11].
La prévalence de l'endométriose augmente avec l'âge. Elle touche principalement les femmes autour de la trentaine, mais peut néanmoins se rencontrer dès l'adolescence. Le risque de développer une endométriose pour une fille est cinq fois plus élevé si sa mère est atteinte[5]. Elle est également plus fréquente en cas de
- ménarche précoce,
- volume menstruel important,
- cycles menstruels courts,
- ménopause tardive[9].
Sa fréquence semble augmenter dans les pays développés mais on ignore s'il s'agit d'une augmentation réelle ou d'un meilleur diagnostic. Bien que rarissimes, des cas d'endométriose ont également été rapportés chez des hommes[12] - [13] - [14].
Localisation

Les lésions d'endométriose se situent essentiellement dans la cavité pelvienne, et touchent principalement les organes voisins de l'utérus. Elles peuvent également s'étendre à la cavité abdominale, au diaphragme et à la plèvre. Exceptionnellement, elles peuvent affecter des organes distants, tels le foie, les poumons ou le cerveau.
3 formes d'endométrioses sont caractérisées :
- l'endométriose péritonéale superficielle, affectant la surface du péritoine,
- l’endométriome ovarien, formant un kyste de l’ovaire endométriosique,
- l’endométriose pelvienne profonde (ou sous-péritonéale), affectant la musculeuse des organes abdomino-pelviens, tels que le vagin, la vessie, l’uretère ou le tube digestif[15].
| Localisation | Fréquence (%) |
|---|---|
| ligaments utérosacrés | 50 |
| vagin (cul-de-sac postérieur) | 15 |
| rectum et sigmoïde | 20 - 25 |
| vessie | 10 |
| uretères | 3 |
Un ou plusieurs organes peuvent être atteints chez une même personne.
Plus rarement, elle peut atteindre des organes, à la suite d'une intervention chirurgicale (ex : endométriose pariétale cicatricielle, suite à une césarienne), ou être diffusée par le système lymphatique ou sanguin. Des lésions d’endométriose peuvent ainsi apparaître au niveau d’organes localisés à distance de l’utérus (ex : les poumons ou le cerveau).
Étiologie
Les causes de l’endométriose sont multiples, liées à des facteurs génétiques, environnementaux et en relation avec les menstruations.
Le reflux menstruel
D'après la Haute Autorité de santé, "Le rôle du reflux menstruel dans la physiopathologie de l’endométriose est majeur et permet d’expliquer la répartition asymétrique des lésions, qui prédominent dans le compartiment postérieur du pelvis et à gauche." Cette hypothèse a été proposée dès 1921 par John A. Sampson (en) qui suggérait un reflux de tissu endométrial par les trompes utérines lors des règles. En effet, lors des menstruations, le sang menstruel peut ne pas totalement s'écouler par le vagin ; une partie de ce sang peut refluer vers les trompes et s'écouler dans la cavité pelvienne. Ce sang contient naturellement des cellules endométriales vivantes qui peuvent se greffer sur le tissu péritonéal ou sur d'autres organes, grâce à diverses enzymes (MMPs ou métalloprotéinases de la matrice).
Différents éléments appuient cette hypothèse de la transplantation par reflux tubaire, parmi lesquels le fait de trouver à la laparoscopie du sang dans le cul-de-sac de Douglas lors de menstruations, ainsi que l'apparition de cellules endométriales dans le liquide de dialysat péritonéal chez les femmes en dialyse péritonéale[8] - [16].
Cependant, le reflux menstruel apparaissant chez quasiment toutes les femmes, il faut trouver un facteur plus spécifique. Deux hypothèses sont discutées : un endomètre pathologique à la suite d'une prédisposition génétique, un défaut dans le système immunitaire. La génétique ne permet pas, en l'état actuel des connaissances, de définir un gène ou une combinaison de gènes[17] qui serait impliqué, en raison de la trop grande variété des causes et des effets de la maladie. Pour ce qui concerne l'immunité, par contre, il est bien établi que les mécanismes de défense du corps humain jouent un rôle important. -[18].
L'écoulement des règles déclenche en effet des inflammations, donc une réponse du système immunitaire. On trouve des correspondances entre des pathologies de ce système et l'endométriose. On postule que l'organisme serait en défaut pour reconnaitre des lésions qu'il aurait lui-même déclenchées, vu que le système immunitaire est orienté pour protéger le non-soi. Différentes perturbations de ce système, telles que peuvent en produire des infections microbiennes, ou certains médicaments comme le tristement célèbre distilbène (voir Diéthylstilbestrol), risquent d'induire l'endométriose. Tout ce qui dans l'environnement perturbe le système immunitaire, comme les pesticides, est suspecté. -[18].
Les facteurs génétiques
Les causes génétiques sont envisagées depuis de nombreuses années. En effet, la probabilité de développer une endométriose est cinq fois plus élevé pour les filles ayant une mère atteinte, que dans la population générale[19] De nombreuses publications ont mis en évidence des variants génétiques plus fréquents dans le cas des patients atteints d'endométriose. En août 2021, une équipe de chercheurs britanniques affirment avoir identifié un gène spécifique responsable d'une augmentation du risque d'endométriose[20].
Une mutation sur le gène Kras (gène stimulant la croissance et la prolifération tissulaire) au niveau des let-7 augmenterait le risque de survenue d'une endométriose[21]. Des mutations sur d'autres gènes interviendraient de façon analogue[22]. Tout cela suggère que certains variants génétiques jouent un rôle facilitateur ou inhibiteur au développement de l'endométriose.
Hypothèse métaplasiques
La deuxième série d'hypothèses envisage une métaplasie à partir de cellules étrangères à l'endomètre. L'hypothèse métaplasique coelomique suppose une transformation des tissus du péritoine qui recouvre les organes présents dans la cavité abdominale, tissus qui dériveraient d'un tissu embryologique appelé cœlomique et posséderait des cellules pluripotentes. Ces cellules auraient la capacité de se différencier et de suivre une transformation métaplasique en d'autres tissus, comme du tissu endométrial. Les stimuli capables d'engendrer cette différenciation restent inconnus[8].
Une hypothèse très proche est celle de l'induction, qui envisage une transformation de cellules du péritoine sous l'effet de facteurs hormonaux ou immunologiques[8].
Une troisième hypothèse s'appuie sur une métaplasie à partir des vestiges du canal de Müller sous l'effet d'œstrogènes[8].
La découverte de cas d'endométriose chez des femmes dépourvues d'endomètre et chez des hommes traités avec de fortes doses d'œstrogènes a conduit à imaginer plus récemment une quatrième voie, celle d'une métaplasie à partir de cellules-souches extra-utérines ou de cellules progénitrices issues de la moelle épinière[8].
Hypothèse de la métastase
La dernière hypothèse évoquée est la théorie de la transplantation ou de l'induction. Elle suggère que lors des menstruations, les différents vaisseaux (artérioles spiralées, vaisseaux lymphatiques…) aspirent des cellules endométriales dans la circulation systémique et provoquent l'essaimage dans tout l'organisme. Cette hypothèse a le bénéfice d'expliquer l'apparition de l'endométriose dans une pluralité de localisations[8] - [23].
Aucune hypothèse ne pouvant expliquer à elle seule toutes les localisations, il est probable que ces trois mécanismes puissent jouer de façon conjointe[8].
Les trois facteurs importants qui jouent un rôle sont :
- la présence d'un reflux de sang menstruel dans la cavité péritonéale ;
- la présence de macrophages inefficaces (non- immuno-incompétents) ou dépassés par les quantités à résorber ;
- le fait d'être réglée, donc d'avoir des menstruations.
Hypothèse auto-immunitaire
Malgré la mise en évidence de nombreuses anomalies du système immunitaire (facteur de nécrose tumorale, interleukines…)[8] il n’a jamais été retrouvé d’anticorps spécifiques de l’endométriose ni aucune relation avec une grande pathologie immunitaire connue comme la Thyroïdite de Hashimoto, la polyarthrite rhumatoïde, le syndrome des anti-phospholipides… Et même s'il existe des anomalies dans l’immunité locale, rien ne permet de dire s’il s’agit d’une cause ou d’une conséquence.
Hypothèse toxique
Les perturbateurs endocriniens, notamment la dioxine, les PCB, les phtalates, ont été accusés avec certains arguments[24] - [25]. Toutefois, en 2017, la HAS ne constatait aucune preuve directe de leur responsabilité dans la survenue de l’endométriose.
Hypothèse environnementale
Parmi les hypothèses envisagées figurent le rôle d'une exposition à certains produits toxiques ou polluants de l'environnement. En particulier l’alimentation et/ou une exposition (éventuellement in utero, lors de l'enfance ou lors de l'adolescence) à des perturbateurs endocriniens pourrait être en cause, mais aucune de ces hypothèses n'a à ce jour fait l'objet d'une preuve scientifique forte (notamment d'hypothèse de la pilule contraceptive un temps évoquée comme agent provocateur a été invalidée). Des études sur d'éventuels liens entre phtalates (ou leurs métabolites), fertilité, anomalies de l'appareil reproducteur féminin, puberté précoce ou endométriose laissent suspecter un lien entre taux plasmatiques ou urinaires de phtalates ou de leurs métabolites et endométrioses.
- Une étude a fortement suggéré que l'exposition aux phtalates, notamment présents dans les tampons hygiéniques, pourrait conduire à l'endométriose[26].
- En Italie, Cobellis et coll. (2003) ont comparé les taux sanguins de deux phtalates (DEHP et MEHP) chez 35 femmes victimes de lésions endométriosiques et 24 femmes sans endométriose diagnostiquée ayant consulté pour des kystes ovariens ou de douleurs pelviennes régulières (mais sans difficulté a priori de reproduction). Le DEHP et le MEHP étaient présent dans le sang de la majorité des femmes, avec un taux médian de DEHP plus de 3 fois plus élevé chez celles victimes d’endométriose (0,57 mg/l) par rapport au groupe-témoin (0,18 mg/l). Aucune différence n'a été notée pour le MEHP[27] - [28].
- En Inde, Reddy et coll. (2006) ont étudié[29] les taux sanguins de phtalates de 49 patientes infertiles victimes d’endométriose pelvienne (diagnostiquée sous cœlioscopie), en les comparant à de 38 femmes infertiles et de 21 femmes fertiles (ayant également subi une cœlioscopie mais pour d’autres motifs gynécologiques). Les taux moyens de DEHP, DNOP, BBP et DBP étaient plus élevés chez les patientes ayant une endométriose (2,44, 3,32, 0,66 et 0,44 mg/l respectivement) que dans les 2 groupes de femmes sans endométriose, avec des taux tendant à être d'autant plus élevés que l'endométriose était sévère[28].
- Itoh et al. ont recherché en 2009 une éventuelle corrélation entre phtalates urinaires et sévérité des endométrioses chez 137 Japonaises connaissant des problèmes d'infertilité et diagnostiquées sous cœlioscopie. Les 6 métabolites quantifiés dans les premières urines du matin (MEP, MBP, MEHP, MEHHP, MEOHP, MBzP) étaient retrouvés dans presque tous les échantillons (97 % pour le MBzP). Les niveaux médians les plus élevés de ces métabolites étaient observés chez les patientes atteintes d’endométriose les plus sévères[30] mais les analyses prenant en intégrant les variabilités individuelles de dilution urinaire (avec la créatinine) ne montraient pas de relation dose-réponse[28].
Les 3 premières études sont descriptives et n'éliminent pas certains facteurs de confusion, et elles sont en outre limitées par le fait que la demi-vie des phtalates dans le sang est courte (moins d'une heure pour le DEHP) et ne traduit donc pas l'exposition réelle du moment et encore moins l'exposition passée (l'exposition intra-utérine ou adolescente pourrait éventuellement être en cause aussi). En outre dans certains cas le matériel utilisé pour les prélèvements de sang aurait éventuellement pu contenir lui-même des phtalates contaminant l'échantillon soumis à analyse. Par contre, Itoh et al. ont utilisé un questionnaire standardisé conçu pour traiter différents facteurs de confusion. Les preuves de l’existence possible d’un lien entre phtalates et endométriose sont à ce jour très limitées[28].
Hypothèse infectieuse
Bien que jamais démontrée, l’étiologie infectieuse reste plausible. Elle serait alors plutôt liée à des phénomènes viraux ou de type prion pathogène.
Aspect
L'endométriose peut prendre des aspects très divers en fonction du type de lésions, de leur extension ou des organes atteints. Ces différences font l'objet d'une classification propre[31].
Types de lésions
- Les lésions nodulaires superficielles sont des lésions relativement bleutées, rouges ou blanches à la surface du péritoine ou des ovaires. Elles mesurent quelques millimètres et n'envahissent pas en profondeur.
- Les kystes ovariens ou endométriomes se constituent par l'inclusion progressive de lésions superficielles dans l'ovaire. Ces kystes se constituent car l'endométriose (comme l’endomètre) saigne au moment des règles. Ces kystes, dits parfois « chocolat »[32] pour leur couleur brune, sont remplis d'un liquide dérivé de ce vieux sang. Ils peuvent mesurer de 15 mm à plus de 10 cm.
- Les nodules profonds : ce sont des lésions qui envahissent en profondeur soit un organe soit la zone sous-péritonéale. Il existe encore de grandes incertitudes quant à savoir si ces nodules profonds sont une évolution des nodules superficiels ou se créent d'emblée sous cette forme. Tout laisse néanmoins penser que les deux types de formation sont possibles. Les localisations privilégiées de ces nodules profonds sont les ligaments utéro-sacrés (ligament reliant l'utérus au sacrum en arrière), la zone recto-vaginale, le vagin, le rectum, la fossette ovarienne et les ligaments larges, plus rarement la vessie ou le côlon sigmoïde et encore plus rarement tout autre organe abdominal. La taille de ces nodules va de quelques millimètres à 5 ou 6 centimètres.
- Les adhérences entre organes : l'endométriose tend à « coller » les organes entre eux par des phénomènes inflammatoires. À l'inverse des adhérences post-infectieuses, il s'agit d'adhérences très serrées et très vascularisées. Les localisations les plus fréquentes sont sous les ovaires en arrière de l'utérus et entre utérus et ovaire, mais toutes les localisations sont possibles.
Organes atteints
La particularité de l'endométriose est son polymorphisme. L'endométriose peut se limiter à quelques nodules superficiels millimétriques sur les ligaments utéro-sacrés mais peut aller jusqu'à des kystes bilatéraux associés à des nodules profonds et à des adhérences englobant tout le pelvis et réalisant ce que l'on appelle un pelvis gelé. Tous les intermédiaires sont possibles, y compris des atteintes unilatérales isolées.
Extension des lésions et classifications
L'extension des lésions tant en profondeur qu'en nombre d'organes concernés a conduit logiquement à proposer des classifications. La première fut proposée par Kistner vers 1960, une deuxième par Da Costa en 1973. Elles ont disparu au profit de la classification de l'AFS (American Fertility Society) publiée en 1978 et révisée en 1995[33].
Cette classification (r-AFS) permet d'attribuer des points selon la localisation des lésions sur le péritoine, les trompes, les ovaires, le cul-de-sac de Douglas en fonction de leur extension en taille et en profondeur. Elle prend en compte de la même manière les adhérences en fonction de leur extension, de leur type et de l'extension pour chaque organe. Ces points sont additionnés pour donner un score global. En fonction de ce score, l'endométriose est classée en quatre stades :
- stade 1 ou minime pour les scores de 1 à 5 ;
- stade 2 ou léger pour les scores de 6 à 15 ;
- stade 3 ou modéré pour les scores de 16 à 42 ;
- stade 4 ou sévère pour les scores supérieurs à 42.
Il a été proposé un temps de créer un stade 5 ou extensif pour les scores au-delà de 70.
Un score et un stade peuvent correspondre à des lésions très différentes, ce qui rend ce score d'un intérêt assez limité. De plus, ce score n'a qu'une valeur descriptive relative, et non une valeur pronostique. Le lien entre l'intensité des signes douloureux et le score est limité. En matière d'infertilité, sa valeur prédictive est encore plus faible, hormis le stade extensif. Malgré cette valeur relative, toutes les publications se réfèrent à ce score.
Signes cliniques
L’endométriose peut n’entraîner aucun symptôme[34]. Sinon les deux signes cliniques sont les douleurs et l’infertilité. Ils peuvent être associés. Les complications graves de l’endométriose sont rares.
Les douleurs
Les douleurs les plus caractéristiques sont les dysménorrhées (règles douloureuses). L’intensité est très variable mais elle peut aller jusqu’à la nécessité de prendre des antalgiques puissants, voire dans les cas les plus sévères à l’impossibilité de travailler. Elles apparaissent avec les règles et durent de 12 à 72 heures selon les cas. Ce sont des crampes ou des douleurs sourdes du pelvis qui peuvent irradier vers le dos, les cuisses, l’anus. La plupart des personnes décrivent des douleurs qui ont commencé vers l’âge de 16 ans, puis qui ont disparu ou, au moins, fortement diminué avec la prise de la pilule. À l’arrêt de celle-ci, les douleurs sont réapparues après quelques mois. Ces douleurs peuvent aller de pair avec des signes digestifs (constipation) ou urinaires (envie fréquente d’uriner) laissant craindre une atteinte du rectum ou de la vessie. Elles peuvent aller d’une simple gêne à un véritable handicap social pour les personnes interrompant toutes activités professionnelles et sociales au moment de leurs règles.
Le deuxième type de douleur est la dyspareunie (douleurs pendant et après les rapports sexuels). Elle peut être constante ou simplement à certains moments du cycle. Elle est plus fréquente lors de certaines positions. Son intensité est également très variable allant d’une gêne modérée à une quasi-incapacité d’avoir des rapports, ce qui retentit fortement sur le plan psychologique.
L'infertilité
30 à 50 % des femmes atteintes d'endométriose ont des problèmes de fertilité[35]. Les mécanismes n'en sont pas clairs et sont parfois multiples.
Les complications
Les complications sont rares et de gravité variable. Les ruptures de kystes endométriosiques se traduisent par une douleur brutale et intenable qui oblige à une intervention en urgence. Les atteintes vésicales peuvent entraîner des hématuries (sang dans les urines).
Les atteintes urétérales peuvent entraîner une symptomatologie du type colique néphrétique a minima, mais peuvent évoluer vers un blocage complet avec hydronéphrose. Les atteintes rectales ou intestinales peuvent occasionner la présence de sang dans les selles, des constipations rebelles, exceptionnellement des occlusions.
En janvier 2020, Endofrance a réalisé une enquête aux côtés du laboratoire Gedeon Richter et de l'institut Ipsos. L'enquête révèle que 65% des femmes atteintes d'endométriose estiment que leur maladie affecte leur bien-être au travail[36].
Diagnostic
Le diagnostic peut être posé avec une quasi-certitude :
- si l’examen clinique (toucher vaginal) retrouve un nodule recto-vaginal ;
- si l’échographie vaginale met en évidence un kyste endométriosique (endométriome) dans un ovaire.
Dans tous les autres cas, on parle de suspicion d’endométriose et des examens complémentaires sont nécessaires.
Les arguments en faveur d’une endométriose sont d’abord cliniques : dysménorrhée, dyspareunie, spotting prémenstruel (petites pertes de sang précédant les règles), constipation ou diarrhée au moment des règles, douleurs déclenchées au toucher vaginal en arrière de l’utérus, relative fixité de l'utérus… L'examen peut être cependant strictement normal et reste moins sensible et spécifique que l'échographie trans-vaginale ou l'imagerie par résonance magnétique (IRM)[37].
Les examens paracliniques sont d’un apport assez limité pour établir le diagnostic[38] :
- l’échographie par voie trans vaginale ne permet de bien visualiser que les endométriomes ou l’adénomyose[39], permettant leur caractérisation[40]. Elle permet aussi de visualiser les localisations rectales ou sigmoïdiennes de l'endométriose[41]. Elle ne détecte pas les lésions superficielles et mal les nodules plus importants ;
- l’IRM est très performante;
- de nombreux marqueurs biologiques dans le sang ont été proposés. Le taux de CA 125 peut être élevé mais sa spécificité et sa sensibilité sont médiocres[42].
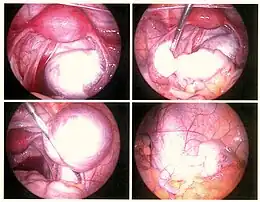
À la fin, la question se pose toujours de réaliser une cœlioscopie pour traiter chirurgicalement. La décision de la cœlioscopie dépend de l’importance de la suspicion mais également des contextes de douleurs et d’infertilité, de l’âge… Cette opération chirurgicale permet de visualiser les lésions d'endométriose sous forme de taches brunâtres ou de petites vésicules.
Un test diagnostique salivaire appelé Endotest a été mis au point par la société française Ziwig[43] - [44]. Le test s'appuie sur l'analyse par un logiciel d'apprentissage automatique de 109 biomarqueurs (fragments d'ARN). Le prélèvement salivaire est pratiqué par la patiente ; l'analyse s’effectue en laboratoire[45]. Cependant il faut rester prudent, car ce test s'appuie sur peu d'études, même si elles sont encourageantes et pertinentes. Il manque une validation des biomarqueurs par un laboratoire indépendant, et il n'est pas prouvé que ces biomarqueurs sont spécifiques à l'endométriose. La découverte de tels biomarqueurs reste hypothétique, tant que la dérégulation biologique qui provoque la maladie n'est pas identifiée. -[18].
Évolution
L'endométriose est une maladie avec une évolution spontanée relativement imprévisible, avec parfois des régressions spontanées[46].
L'âge d'apparition de l'endométriose se situe entre la puberté et 35 ans, mais le délai entre le début de la maladie et son diagnostic est en moyenne de 7 ans.
Après traitement chirurgical conservateur, la récidive est assez fréquente après un délai qui peut aller de quelques mois à quelques années.
Lors de la grossesse, il y a régression de l'endométriose et les femmes ayant été enceintes ont deux fois moins de risque de récidiver que celles qui ne l'ont pas été.
L'endométriose tend à régresser naturellement vers l'âge de 40 à 45 ans et disparaît de façon presque certaine à la ménopause ou en cas d'hystérectomie avec ovariectomie (ablation de l'utérus et des ovaires).
Il y a peu de relations entre l'évolution de l'endométriose et le stade de découverte.
Le risque de survenue d'un cancer de l'ovaire est légèrement augmenté[47].
Traitement
La prise en charge de l'endométriose a fait l'objet de publications de recommandations de l'« European Society of Human Reproduction and Embryology » datant de 2005[48] et mis à jour en 2014[49]. La qualité des 17 études ayant fait l'objet d'une revue en 2014 par Cochrane est qualifiée de très basse à modérée[50].
Il n’existe pas à proprement parler de traitement de l’endométriose si on entend par traitement une méthode thérapeutique ne laissant pas de séquelles et offrant une probabilité de guérison de plus de 90 %.
Il est donc plus rationnel de parler de moyens thérapeutiques et de stratégie thérapeutique. Cette stratégie thérapeutique dépend du contexte et en particulier de la doléance principale qui peut être la douleur ou l’infertilité (ou plus exceptionnellement d’une complication).
Médicaments
Le principe des traitements médicaux relève de quatre principes :
- les lésions de l’endométriose arrêtent d'évoluer après la ménopause, d’où l’usage des analogues de la GnRH qui bloquent l’hypophyse et créent une ménopause artificielle ;
- l’endométriose régresse fortement pendant la grossesse sous l’effet de la progestérone d’où l’idée de donner des progestatifs en continu et à dose élevée ;
- les douleurs de l’endométriose sont principalement présentes pendant les règles d’où le concept de bloquer les règles par des analogues de la GnRH, des progestatifs en continu mais aussi simplement par la classique pilule prise sans interruption ;
- les douleurs dues à l’endométriose sont dues à une libération excessive de prostaglandines d’où la prescription d’anti-inflammatoires non stéroïdiens qui bloquent leur libération.
Analogues de la GnRH
Les analogues de la GnRH bloquent la sécrétion d’œstrogènes par les ovaires. La croissance de l’endomètre et de l’endométriose est bloquée. Mais à l’arrêt des traitements, le processus d’endométriose reprend le plus souvent. Il s’agit de prescription longue le plus souvent pour 3 à 6 mois sous forme injectable retard : 1 injection par mois ou par trois mois. Les effets secondaires de ces produits sont importants : bouffée de chaleur, tendance dépressive, petites pertes de sang et risque d’ostéoporose en cas de prescription au-delà de douze mois. Durant leur utilisation, le blocage de l’hypophyse et de l’ovulation rend une grossesse peu probable. Les produits les plus couramment utilisés en France sont le Décapeptyl 3 mg ou 11 mg et l’Enantone (liste non exhaustive).
Les bénéfices attendus par rapport à un placebo ou à l'absence de traitement sont d'un niveau de preuve faible[50].
Progestatifs
Leur utilisation est ancienne. Initialement, on utilisait surtout les progestatifs du type norstéroïdes (Norluten, Lutometrodiol) pour des périodes de trois à six mois. Mais leur effet androgénique et anabolisant fait qu’ils ne sont plus guère utilisés car ils occasionnaient parfois des prises de poids et un hirsutisme. Le Danazol est un produit assez similaire, mais il n’est plus guère utilisé pour les mêmes raisons. La progestérone naturelle (Utrogestan et autre) est relativement peu efficace. Aussi on lui préfère les progestatifs de type pregnane comme le Lutényl, la Surgestone ou le Lutéran. Ils ont moins d’effets secondaires de type anabolisant (prise de poids). Durant leur prise en continu, il n’y a pas de possibilité de grossesse car ils bloquent l’ovulation. En revanche, une alerte est lancée concernant un risque accru de méningiome associé à l’utilisation d’acétate de nomégestrol (Lutényl ou génériques) ou d’acétate de chlormadinone (Lutéran ou génériques)[51]. Les progestatifs peuvent également être utilisés sous la forme de stérilet à la progestérone (Mirena) qui libère en continu au niveau pelvien une dose infime de progestérone.
Pilule œstroprogestative
La pilule œstroprogestative peut être prise en continu, c’est-à-dire en ne respectant pas l’arrêt classique de 7 jours entre deux plaquettes. L’effet est double. Cette prescription entraîne une atrophie de l’endomètre (et donc de l’endométriose) et empêche la survenue de règles douloureuses. Ceci n’a aucune conséquence délétère supplémentaire par rapport à la prise classique de la pilule. Sous ce type de traitement, la survenue de petites pertes de sang peut se produire qui ne doit pas entraîner l’arrêt. On préfère dans cette indication les pilules dites de première ou de deuxième génération comme le Minidril ou l’Adepal. Bien sûr il n’y a pas de possibilités de grossesse avec ce traitement. La maladie peut cependant continuer à progresser sous pilule en continu et des contrôles réguliers sont conseillés.
Anti-inflammatoires non stéroïdiens
Les anti-inflammatoires non stéroïdiens (AINS) inhibent la sécrétion de prostaglandines ce qui réduit la douleur. Ils sont d’autant plus efficaces qu’ils sont pris tôt dès les premiers symptômes. Les principaux AINS prescrits sont le Ponstyl, l’Antadys, le Biprofenid (liste non exhaustive). Les principaux effets secondaires des AINS sont les brûlures digestives et les problèmes rénaux ; il est recommandé d'éviter ce traitement au long cours[52].
La supériorité d'un traitement AINS par rapport aux placebos est indéterminée selon une méta-revue de Cochrane[50].
Autres médicaments en cours de test
La mélatonine réduit les scores de douleur quotidiens avec une amélioration de la qualité du sommeil[53].
Traitements non médicamenteux
- En France, la HAS fait état d'une amélioration de la qualité de vie de la patiente, pouvant justifier en complément des autres thérapies le recours à l’acupuncture, à l’ostéopathie ou au yoga[52].
- Ultra-sons : En 2017, un essai clinique, conduit à l'Hôpital de la Croix Rousse ( Lyon) vise à tester l'efficacité des ultrasons dans le traitement de l'endométriose. Les médecins ont expérimenté avec succès le traitement par ondes HIFU (Ultrasons Focalisés de Haute Intensité) sur 4 patientes, en utilisant un outil initialement conçu pour traiter par voie endorectale le cancer de la prostate. C'est une 1ère mondiale et l’essai clinique se poursuit actuellement[54] ; Le procédé développé avec l'INSERM (laboratoire pour les Ultra-sons Thérapeutiques, LabTau de l'Université Claude Bernard Lyon 1) pourrait bientôt bénéficier d'une sonde améliorée, plus adaptée à la morphologie féminine[55].
Chirurgie
Il existe deux modalités du traitement chirurgical : le traitement radical et le traitement conservateur.
Traitement radical
En enlevant l’utérus et les ovaires on crée une ménopause. L’intervention se pratique soit par cœlioscopie soit par laparotomie (ouverture de l’abdomen). Ce traitement radical rend impossible toute grossesse ultérieure. Malheureusement il ne garantit pas la disparition des symptômes.
L’ablation de l’utérus (hystérectomie), en conservant les ovaires, entraîne une disparition des douleurs dans 70 % des cas mais n’induit pas une ménopause, et l'endométriose peut cependant continuer à progresser.
Traitement conservateur
Il vise à supprimer les lésions d’endométriose et à lever les adhérences, tout en conservant l’utérus et les ovaires. Les types d’intervention varient en fonction du type de lésions. Ces interventions se font par cœlioscopie dans presque tous les cas.
Lésions superficielles de l’ovaire et du péritoine
Elles peuvent être enlevées au ciseau, coagulées à l’électricité ou vaporisées au laser. Depuis plusieurs années, la technologie Plasma donne des résultats très satisfaisants tout en préservant la fertilité des patientes.
Kystes ovariens d’endométriose ou endométriomes
Il existe deux principes : soit l’ablation du kyste (kystectomie) soit la destruction de la paroi interne du kyste par électrocoagulation, par Laser ou par Plasma-jet. La durée opératoire est sensiblement la même. Les études comparant la destruction (laser ou électricité) à la kystectomie plaident plutôt en faveur de la kystectomie car il y a moins de récidives, plus de grossesse par contre un risque plus élevé d’endommager la réserve ovarienne d’ovocytes. Le Plasma-jet (jet d’argon ionisé) est trop récent pour avoir fait l’objet d’études suffisantes.
Lésions d’endométrioses profondes
Leur simple destruction par laser ou électrocoagulation est impossible ou insuffisante. Il est donc nécessaire d’en faire l’exérèse. La chirurgie des lésions profondes est difficile à résumer en quelques lignes tant elle peut prendre des aspects divers du fait des organes impliqués et de la sévérité de l’atteinte. Nous ne ferons que citer les gestes possibles et insister sur des points importants.
Les lésions au niveau des ligaments utérosacrés sont réséquées avec souvent la nécessité de disséquer les uretères. Il en est de même pour les lésions sous ovariennes.
Les nodules recto-vaginaux sont réséqués avec ablation éventuelle du fond vaginal. Lorsque le rectum est impliqué il est quelquefois nécessaire de faire une résection rectale en « pastille » voire de faire une résection segmentaire qui consiste à enlever une dizaine de cm de cet organe.
En cas de lésions du sigmoïde ou d’une autre partie de l’intestin une résection segmentaire digestive est nécessaire. Tous ces gestes digestifs obligent quelquefois à faire un anus artificiel temporaire (2 à 3 mois).
En cas d’atteinte vésicale, il peut être nécessaire d’enlever une partie de la vessie si la lésion d’endométriose atteinte le muscle vésical.
En cas d’atteinte d’un uretère, il peut être possible de simplement le libérer mais si l’atteinte est plus sévère, une résection de quelques centimètres peut s’avérer indispensable voire une réimplantation de l’uretère dans la vessie.
Adhérences
La levée des adhérences en cas d’endométriose fait partie du traitement. Elle est souvent difficile car il s’agit d’adhérences très serrées et vascularisées. En cas d’adhérences concernant en particulier le tube digestif, le risque de complications est non négligeable.
Ces interventions peuvent être très simples et ne durer que quelques minutes. Elles peuvent être complexes, durer plusieurs heures et nécessiter en plus du gynécologue l’intervention d’un urologue ou d’un chirurgien digestif. Cette chirurgie expose à des complications graves dans 1 à 2 % des cas : fistules urinaires ou digestives principalement. La plupart des gestes sont faits par cœlioscopie mais une laparotomie peut s’avérer utile surtout en cas de lésions digestives. L’intérêt de faire des exérèses complètes, avec en particulier des résections digestives, fait encore l’objet de controverse. Globalement on admet un risque de récidives des lésions de l’ordre de 10 à 20 % même après une chirurgie conservatrice complète. Cette chirurgie est particulièrement indiquée chez les patientes stériles et celles jeunes sans enfant présentant des douleurs invalidantes.
Après chirurgie conservatrice 80 % des patientes sont soulagées de leurs douleurs de façon complète ou partielle. Les résultats sont moins convaincants sur la stérilité avec des taux d’accouchements de 30 à 35 %.
Stimulations de l’ovulation
La stimulation de l’ovulation par FSH ou HMG a prouvé son efficacité dans la stérilité par endométriose après la chirurgie conservatrice.
Assistance médicale à la procréation
L’endométriose représente une indication majeure de l’assistance médicale à la procréation (AMP) que ce soit la fécondation in vitro (FIV) ou l’insémination intra-utérine (IIU).
La FIV donne des résultats satisfaisants dans cette indication et n’expose pas à un risque particulier de faire redémarrer l’endométriose ou de faire flamber une endométriose existante. Les IIU ne se conçoivent que dans des cas particuliers que nous verrons plus loin. La FIV simple ou avec micro-injection est possible dans tous les cas de stérilité.
Les résultats de la FIV en cas d’endométriose sont similaires à ceux obtenus pour les autres indications soit de 20 à 25 % d’accouchement par tentative. Il s’agit d’un chiffre moyen qui peut varier avec l’âge de la patiente, le nombre d’embryons transférés, la prise en compte des embryons congelés et la réserve ovarienne. Le résultat est indépendant du stade de l’endométriose. Les résultats cumulatifs après 4 tentatives de FIV sont compris entre 45 et 60 % d’accouchement.
Psychothérapie
L’endométriose n’est pas considérée comme une maladie psychosomatique dans l'état actuel des connaissances, mais les douleurs intenses et répétitives, les troubles de la sexualité dus aux dyspareunies peuvent avoir un retentissement psychologique important, qui justifie plus une aide psychologique que des drogues psychotropes. Des associations de patientes souffrant d’endométriose et prêtes à aider d’autres femmes existent.
Prise en charge thérapeutique
Elle varie selon la principale plainte (douleurs ou infertilité), l’âge et le désir ultérieur de grossesse. Les paragraphes suivants font un point sur les stratégies de prise en charge recommandées par les sociétés scientifiques.
Depuis le 13 janvier 2022, en France, l'endométriose est reconnue comme une « affection de longue durée »[56].
Prise en charge de la douleur
Souvent l’endométriose est suspectée et une cœlioscopie est pratiquée qui permettra le diagnostic et un traitement chirurgical. La question se pose alors d’un traitement complémentaire si la femme ne désire pas d’enfant immédiatement.
En cas de traitement complet l’option la plus souvent retenue est la pilule en continu, mais il n’a jamais été clairement prouvé qu’elle empêche les récidives. En tout cas elle prévient la récidive des douleurs.
En cas de traitement incomplet, deux options sont possibles : soit la mise sous progestatifs au long cours, soit la mise sous analogues de la GnRH pour une période de 3 à 6 mois (relayée soit par la pilule, soit par les progestatifs).
Dans ces cas, les chirurgies itératives sont à éviter pour ne pas compromettre les potentialités de reproduction ultérieure. Néanmoins, cette éventualité peut s’avérer indispensable dans quelques cas, surtout en cas de récidives d’endométriose recto-vaginale. Mais elle doit être prudente, en particulier pour le traitement des atteintes ovariennes (endométriomes) afin de ne pas trop affecter le stock ovocytaire.
Chez la jeune adulte voire l’adolescente présentant en particulier des dysménorrhées sévères, la question de la cœlioscopie d'emblée est discutée au profit d’un traitement d’essai avec pilule en continu.
Chez la patiente plus âgée ayant des enfants et n’en désirant plus, la mise sous progestatif ou la pose d’un stérilet à la progestérone peut être efficace. En cas d’échec, le recours à l’hystérectomie (avec ovariectomie) est la meilleure solution médicale, mais son caractère nettement invasif fait qu'elle n'est pas toujours facilement acceptée sur le plan psychologique.
Prise en charge de l’infertilité
Recommandations du CNGOF (collège national des gynécologues et obstétriciens français)[57] :
- en cas de suspicion d’endométriose ou d’endométriose avérée le recours à une cœlioscopie est préférable sauf s’il existe une autre indication formelle à pratiquer une fécondation in vitro (sperme très altéré, trompes absentes ou endommagées) ;
- lors de cette cœlioscopie, un traitement chirurgical conservateur est pratiqué autant qu’il ne présente pas de risque majeur de complication ;
- après la cœlioscopie trois cas de figure se présentent :
- en cas de traitement chirurgical notoirement incomplet, l’orientation directe vers la FIV est préférable,
- en cas de traitement complet mais s’il existe des facteurs péjoratifs (âge supérieur à 38 ans, stérilité de plus de 8 ans, atteinte tubaire, adhérences sévères, sperme notoirement altéré), l’orientation directe vers la FIV est préférable,
- en cas de traitement complet et en l’absence de facteurs péjoratifs, il est recommandé de ne pas donner de traitement post-opératoire du type analogues de la GnRH ou progestatif et d’essayer d’obtenir une grossesse immédiatement. L’ajout de clomifène (Clomid) n’a pas d’intérêt. Un délai de 6 à 12 mois en fonction de l’âge sera respecté avant d’envisager un traitement de deuxième ligne. La probabilité de grossesse durant ce temps va de 30 à 50 % selon l’âge.
- Si à la fin de ce délai il n’y a pas de grossesse, deux hypothèses existent :
- s'il y a probable récidive de l’endométriose dépistée sur la récidive des douleurs ou sur l’échographie ou sur l’examen clinique, l’orientation vers la FIV est préférable,
- s'il n’y a aucun signe en faveur d’une récidive, le recours à des stimulations de l’ovulation associées à des IIU est recommandé pour une série maximum de 3 à 4. Cette attitude n’est pas admise par tous.
- S’il n’y a pas grossesse après les IIU, l’orientation vers la FIV est nécessaire ;
- avant prise en charge en FIV et dans tous les cas où persiste de l’endométriose (absence de traitement chirurgical, traitement incomplet ou récidive) il est préférable de traiter médicalement l’endométriose avec des analogues de la GnRH pendant trois mois avec réalisation de la tentative de FIV lors du troisième mois (protocole ultra-long) ;
- une récidive d’endométriose avant ou pendant une tentative FIV n’impose ni l’arrêt du protocole, ni une nouvelle chirurgie. En cas d’endométriome, l’alcoolisation peut être proposée mais son évaluation reste aujourd’hui partielle ;
- une ré-intervention chirurgicale entre des cycles d’AMP doit être évitée sauf complication de l’endométriose ou douleurs invalidantes résistant aux traitements médicaux. En effet, il est tout à fait possible entre deux FIV de traiter médicalement la douleur en particulier par la prise de pilule en continu ;
- une ré-intervention n’est proposée qu’après deux ou trois échecs de FIV en particulier avec mauvaise réponse ovarienne en FIV (peu d’ovocytes ou ovocytes de mauvaise qualité). L’intérêt n’a jamais été démontré ;
- en cas de mauvaise réponse au traitement de stimulation et/ou de mauvais taux de fécondation y compris en ICSI, le recours au don d’ovocytes peut être proposé.
Finalement entre la chirurgie, les IIU et les FIV, deux femmes sur trois seront enceintes. Ce chiffre est à moduler vers le haut ou le bas en fonction de l’âge, de la réserve ovarienne et de la résistance psychologique à des traitements répétitifs pénibles et stressants.
Prise en charge de certaines complications
La survenue de complications graves est rare. Elle peut nécessiter des gestes en urgence ou semi-urgence :
- la sténose d’un uretère nécessite la pose d’une sonde urétérale en urgence puis une résection ou une réimplantation urétérale ;
- l’apparition d’une sténose digestive avec des signes de sub-occlusion peut obliger à la mise en place d’un anus abdominal de dérivation (iléostomie ou colostomie) en même temps que la résection de la zone intestinale atteinte, suivi dans un deuxième temps d’un rétablissement de la continuité digestive avec suppression de l’anus de dérivation ;
- la rupture d’un kyste endométriosique impose une intervention rapide pour laver la cavité péritonéale et faire l’exérèse du kyste ;
- la surinfection d’un endométriome après ponction de FIV crée un abcès de l’ovaire qui doit être drainé mais oblige parfois en l’ablation de l’ovaire.
Notes et références
- (en) Carlo Bulletti, Maria Elisabetta Coccia, Silvia Battistoni et Andrea Borini, « Endometriosis and infertility », Journal of Assisted Reproduction and Genetics, vol. 27, no 8, , p. 441–447 (ISSN 1058-0468, PMID 20574791, PMCID PMC2941592, DOI 10.1007/s10815-010-9436-1, lire en ligne)
- Jean Belaïsch, L'endométriose, Elsevier Masson, , p. 24.
- EndoFrance, « Qu'est que l'Adénomyose ? », sur Association EndoFrance (consulté le )
- (en) Camran Nezhat, « Endometriosis: ancient disease, ancient treatments », Fertility and Sterility, vol. 98, (DOI 10.1016/j.fertnstert.2012.08.001, lire en ligne)
- HAS, Prise en charge de l'endométriose - Recommandations, , 39 p. (lire en ligne)
- Krina T. Zondervan, D.Phil., Christian M. Becker, M.D., and Stacey A. Missmer, Sc.D Endometriosis Endometriosis | NEJM
- « Endométriose », sur Organisation Mondiale de la Santé, (consulté le )
- (en) Burney RO, Giudice LC, « Pathogenesis and pathophysiology of endometriosis », Fertil Steril, vol. 98, no 3, , p. 511-9. (PMID 22819144, PMCID PMC3836682, DOI 10.1016/j.fertnstert.2012.06.029, lire en ligne [html])
- (en) Cynthia Farquhar « Endometriosis » BMJ 2007;334:249-253
- (en) F. Okita, M. Abrao, L.A.S. Lara et M.P. Andres, « Endometriosis in Transgender Men – a Systematic Review with Metanalysis », Journal of Minimally Invasive Gynecology, vol. 28, no 11, , S103–S104 (DOI 10.1016/j.jmig.2021.09.140, lire en ligne, consulté le )
- Anis Fadhlaoui, Jean Bouquet de la Jolinière et Anis Feki, « Endometriosis and Infertility: How and When to Treat? », Frontiers in Surgery, (PMID 25593948, DOI 10.3389/fsurg.2014.00024)
- « Ch@t : L'endométriose », sur Allo docteurs, (consulté le ).
- (en) J D Martin Jr et A E Hauck, « Endometriosis in the male », The American surgeon, vol. 51, no 7, , p. 426-430. (ISSN 0003-1348, PMID 4014886)
- (en) Masaharu Fukunaga, « Paratesticular endometriosis in a man with a prolonged hormonal therapy for prostatic carcinoma », Pathology, research and practice, vol. 208, no 1, , p. 59-61. (ISSN 1618-0631, PMID 22104297, DOI 10.1016/j.prp.2011.10.007)
- (en) Chapron C et Fauconnier A, Deep infiltrating endometriosis: relation between severity of dysmenorrhoea and extent of disease. : Human reproduction., PubMed, 2003 apr
- (en) Sampson JA. « Peritoneal endometriosis due to menstrual dissemination of endometrial tissue into the peritoneal cavity » Am J Obstet Gynecol. 1927;14:442–69.
- « Camille Berthelot : « Comprendre l’origine des règles pourrait aider à soigner l’endométriose » », sur Inserm, (consulté le )
- « L'endométriose sous l'œil des chercheurs », sur www.larecherche.fr (consulté le )
- Collectif, Prise en charge de l’endométriose : ARGUMENTAIRE SCIENTIFIQUE, Haute Autorité de Santé, , 399 p. (ISBN 978-2-11-152307-4)
- « Endométriose : une cause génétique découverte, une potentielle nouvelle cible de traitement », sur Santé Magazine, (consulté le )
- (en) Olga Grechukhina, Rafaella Petracco, Shota Popkhadze, Efi Massasa, Trupti Paranjape, Elcie Chan, Idhaliz Flores, Joanne B. Weidhaas, Hugh S. Taylor, « A polymorphism in a let-7 microRNA binding site of KRAS in women with endometriosis », EMBO Molecular Medicine, vol. 4, no 3, , p. 206–217. (ISSN 1757-4684, PMID 22307873, DOI 10.1002/emmm.201100200, lire en ligne, consulté le )
- (en) Nyholt DR, Low SK, Anderson CA, Painter JN et al. « Genome-wide association meta-analysis identifies new endometriosis risk loci » Nature Genet. 2012;44:1355-9
- (de) Halban J. « Hysteroadenosis metastica [Metastatic hysteroadenosis] » Wien klin Wochenschr. 1924;37:1205–6.
- (en) Kaylon L. Bruner-Tran, Grant R. Yeaman, Marta A. Crispens, Toshio M. Igarashi, Kevin G. Osteen, « Dioxin may promote inflammation-related development of endometriosis », Fertility and Sterility, vol. 89, no 5, , p. 1287-1298. (ISSN 0015-0282, PMID 18394613, DOI 10.1016/j.fertnstert.2008.02.102, lire en ligne, consulté le )
- (en) Buck Louis GM, Peterson CM, Chen Z, Croughan M, Sundaram R, Stanford J, et al., « Bisphenol A and phthalates and endometriosis: the Endometriosis: Natural History, Diagnosis and Outcomes Study. », Fertility and Sterility, vol. 100, , p. 162-169
- (en) Sung Hoon Kim, SiHyun Cho, Hyo Jin Ihm, Young Sang Oh, Seung-Ho Heo, Sail Chun, Hosub Im, Hee Dong Chae, Chung-Hoon Kim, Byung Moon Kang, « Possible Role of Phthalate in the Pathogenesis of Endometriosis: In Vitro, Animal, and Human Data », The Journal of Clinical Endocrinology & Metabolism, vol. 100, no 12., octobre 2015. (ISSN 1945-7197, PMID 26439087, DOI 10.1210/jc.2015-2478, lire en ligne, consulté le )
- COBELLIS L, LATINI G, DE FELICE C, RAZZI S, PARIS I, et coll. High plasma concentrations of di-(2-ethylhexyl)-phthalate in women with endometriosis. Hum Reprod. 2003; 18:1512-1515
- Reproduction et environnement, insem, e-publication (voir le chap 34- Phtalates ; Études épidémiologiques)
- REDDY BS, ROZATI R, REDDY BV, RAMAN NV. Association of phthalate esters with endometriosis in Indian women. BJOG. 2006; 113:515-520
- ITOH H, IWASAKI M, HANAOKA T, SASAKI H, TANAKA T & al. (2009). Urinary phthalate monoesters and endometriosis in infertile Japanese women. Sci Total Environ; 408:37-42
- EndoFrance, « Qu'est ce que l'Endométriose », sur Association EndoFrance (consulté le )
- Dictionnaire de l'Académie nationale de médecine, Kyste endométrial, (lire en ligne), http://dictionnaire.academie-medecine.fr/?q=kyste%20endom%C3%A9trial.
- (en) Rock JA. « The revised American Fertility Society classification of endometriosis: reproducibility of scoring. ZOLADEX Endometriosis Study Group » Fertil Steril. 1995;63(5):1108-10.
- J M Wenger, P Loubeyre, R Marci, J B Dubuisson, « Prise en charge de l’endométriose [Endometriosis: review of the literature and clinical management] », Rev med suisse, vol. 5, no 222, , p. 2085-2086, 2088-2090. (ISSN 1660-9379, PMID 19947450, lire en ligne)
- (en) Macer ML, Taylor HS, « Endometriosis and infertility: a review of the pathogenesis and treatment of endometriosis-associated infertility » Obstet Gynecol Clin North Am. 2012;39:535-49.
- « Endométriose : des conséquences importantes sur le bien-être au travail », sur Bio à la une (consulté le )
- (en) Abrao MS, Gonçalves MO, Dias JA Jr, Podgaec S, Chamie LP, Blasbalg R, « Comparison between clinical examination, transvaginal sonography and magnetic resonance imaging for the diagnosis of deep endometriosis » Hum Reprod. 2007;22:3092-7. [PDF]
- Corinne Balleyguier, « Apports de l'imagerie dans le diagnostic de l'endométriose », Rev Med Suisse, no 646, (lire en ligne, consulté le )
- Moore J, Copley S, Morris J, Lindsell D, Golding S, Kennedy S, A systematic review of the accuracy of ultrasound in the diagnosis of endometriosis, Ultrasound Obstet Gynecol, 2002;20:630-4
- Van Holsbeke C, Van Calster B, Guerriero S et al. Endometriomas: their ultrasound characteristics, Ultrasound Obstet Gynecol, 2010;35:730-40
- Hudelist G, English J, Thomas AE, Tinelli A, Singer CF, Keckstein J, Diagnostic accuracy of transvaginal ultrasound for non-invasive diagnosis of bowel endometriosis: systematic review and meta-analysis, Ultrasound Obstet Gynecol, 2011;37:257-63
- May KE, Conduit-Hulbert SA, Villar J, Kirtley S, Kennedy SH, Becker CM, Peripheral biomarkers of endometriosis: a systematic review, Hum Reprod Update, 2010;16:651-74
- (en) Daraï, Emile, « Salivary MicroRNA Signature for Diagnosis of Endometriosis », Journal of Clinical Medicine, Multidisciplinary Digital Publishing Institute, vol. 11, no 3, , p. 612 (ISSN 2077-0383, DOI 10.3390/jcm11030612, lire en ligne, consulté le ).
- « Endométriose. Cinq questions sur le test salivaire qui promet de détecter la maladie en dix jours »
- Oihana Gabriel, « Endométriose : Un test salivaire innovant permet de dire si une femme souffre de la maladie », 20 minutes, (lire en ligne, consulté le ).
- Hickey M, Ballard K, Farquhar C, Endometriosis, BMJ, 2014;348:g1752
- Kim HS, Kim TH, Chung HH, Song YS, Risk and prognosis of ovarian cancer in women with endometriosis: a meta-analysis, Br J Cancer, 2014;doi:10.1038/bjc
- Kennedy S, Bergqvist A, Chapron C et al. ESHRE guideline for the diagnosis and treatment of endometriosis, Hum Reprod, 2005;20:2698-704
- « Dunselman G et al. ESHRE guideline: Management of women with endometriosis. Human Reproduction 2014 »
- Brown J. et Farquhar C., « Endometriosis: an overview of Cochrane Reviews », Cochrane Systematic Review, no CD009590, (DOI 10.1002/14651858.CD009590.pub2)
- ANSM — Lutényl/Lutéran et génériques : recommandations préliminaires suite à la confirmation du sur-risque de méningiome - Point d'Information.
- HAS, « Prise en charge de l’endométriose Démarche diagnostique et traitement médical », sur has-sante.fr,
- (en) Schwertner A, Conceição dos Santos CC, Dalferth Costa G et al. « Efficacy of melatonin in the treatment of endometriosis: A phase II, randomized, double-blind, placebo-controlled trial » Pain 2013;154:874-81. .
- « Endométriose : nouveau traitement par ultrasons, 1ère mondiale lyonnaise », sur www.reseau-chu.org (consulté le )
- Utilisation d'ondes HIFU pour traiter l’endométriose ; Communiqué publié le 12-04-2017 par le CHU de Lyon (avec vidéo)
- Le Monde avec AFP, « L’endométriose unanimement reconnue comme affection longue durée à l’Assemblée nationale », Le Monde, (lire en ligne, consulté le ).
- H. Fernandez pour le groupe de travail du CNGOF, « Endométriose: un consensus thérapeutique [Endometriosis: a consensus] », Journal de Gynécologie Obstétrique et Biologie de la Reproduction, vol. 36, no 2, , p. 91 (ISSN 0368-2315, PMID 17382193, DOI 10.1016/j.jgyn.2007.03.003, lire en ligne, consulté le )
Bibliographie
- Delphine Lhuillery, Érick Petit et Éric Sauvanet (préf. Amandine Bégot), Tout sur l'endométriose : Soulager la douleur, soigner la maladie, éditions Odile Jacob, coll. « O.J. Médecine », , 288 p. (ISBN 978-2738146007).
Articles connexes
Voir aussi
- Le podcast Happy Endo un podcast en Francais sur l'endométriose
- Fondation pour la Recherche sur l'endométriose - sous l'égide de la Fondation pour la recherche Médicale (FRM)
- ENDOmind France, Association de Patientes
- Endo-France, association française de lutte contre l'endométriose
- ENDOrun, première course française destinée à récolter des fonds pour la recherche sur l'endométriose
- Info-Endométriose, association née en 2015 de la rencontre entre Chrysoula Zacharopoulou, chirurgienne-gynécologue, spécialiste de l’endométriose et députée européenne, et Julie Gayet, actrice, réalisatrice et productrice de cinéma