Eau de mer
L'eau de mer est l'eau salée des mers et des océans de la Terre. On dit qu’elle est « salée » parce qu'elle contient des substances dissoutes, les sels, constitués d'ions, principalement des ions halogénures comme l'ion chlorure et des ions alcalins comme l'ion sodium. On trouve 30 à 40 g de sels dissous pour 1 kg d'eau de mer. L'eau salée s'oppose à l'eau douce, qui contient moins de 1 g de sels dissous par kilogramme. La masse volumique de l'eau de mer à la surface est d'environ 1,025 g/ml, supérieure de 2,5 % à celle de l'eau douce (1 g/ml) à cause de la masse du sel et de l'électrostriction[1].
.jpg.webp)
Volume
Les océans et mers occupent un volume estimé à 1 338 millions de km3, ce qui représente 96,5 % des réserves d'eau présentes à la surface de la Terre[3]. Ce volume n'inclut pas les eaux souterraines (aquifères), dont environ 85 % sont salées à différents degrés.
Origine du sel de l'eau de mer
Les premières théories scientifiques sur l'origine du sel de la mer datent de Edmond Halley qui propose, en 1715, que le sel et les autres minéraux y sont amenés par les rivières[4] : l'écoulement de l'eau en surface (eau de pluie) et dans les rivières dissout des ions par dissolution des roches. Les eaux douces souterraines et de surface sont donc très légèrement « salées » à cause de ces ions ; ceux-ci sont entraînés jusqu'à l'océan, où ils restent tandis que l'évaporation entraine leur concentration (voir le cycle de l'eau). Halley note que les quelques lacs qui ne débouchent pas sur un océan (comme la mer Morte et la mer Caspienne, voir Endoréisme) ont en général une salinité très élevée, ce qu'il appelle la « météorisation continentale » (continental weathering).
La théorie de Halley est en grande partie correcte. En plus du phénomène décrit ci-dessus, le sodium a été arraché au plancher océanique lors de la formation initiale des océans. La présence de l'autre ion dominant du sel, l'ion chlorure, provient du « dégazage » du chlorure d'hydrogène (sous la forme d'acide chlorhydrique) ainsi que d'autres gaz de l'intérieur de la Terre, via les volcans et les monts hydrothermaux. Les ions sodium et chlorure sont ensuite devenus les constituants majeurs du sel de mer.
La salinité moyenne des océans est stable depuis plusieurs milliards d'années, le plus probablement grâce à un processus tectonique et chimique qui enlève autant de sel qu'il en arrive par les rivières. Les ions chlorure et sodium sont ainsi enlevés par les dépôts d'évaporite (les « roches salines »), la « grésification » (le dépôt de sels dans l'eau interstitielle) et les réactions chimiques avec le basalte des fonds marins[5]. Depuis la création des océans, le sodium n'est plus arraché au fond des océans, mais capturé dans les couches de sédiments couvrant les fonds marins. D'autres théories affirment que la tectonique des plaques entraine une partie du sel sous les masses continentales, où il remonte lentement à la surface.
Caractéristiques
Composition
| Anions | g/kg | mol/kg |
|---|---|---|
| Chlorure (Cl−) | 19,3524 | 0,54586 |
| Sulfate (SO42−) | 2,7123 | 0,02824 |
| Hydrogénocarbonate (HCO3−) | 0,1080 | 0,001770 |
| Bromure (Br−) | 0,0673 | 0,000842 |
| Carbonate (CO32−) | 0,0156 | 0,000260 |
| Fluorure (F−) | 0,0013 | 6,84 × 10−5 |
| Hydroxyde (HO−) | 0,0002 | 1,2 × 10−5 |
| Cations | g/kg | mol/kg |
| Ion sodium (Na+) | 10,7837 | 0,46907 |
| Ion magnésium (Mg2+) | 1,2837 | 0,05282 |
| Ion calcium (Ca2+) | 0,4121 | 0,01028 |
| Ion potassium (K+) | 0,3991 | 0,01021 |
| Ion strontium (Sr2+) | 0,0079 | 9,02 × 10−5 |
| Ion lithium (Li+) | 1,73 × 10−4 | 2,49 × 10−5 |
| Ion rubidium (Rb+) | 1,20 × 10−4 | 1,404 × 10−6 |
| Ion baryum (Ba2+) | 2,0 × 10−5 | 1,46 × 10−7 |
| Ions polyatomiques dont molybdène | 1,0 × 10−5 | 1,04 × 10−7 |
| Ions polyatomiques dont uranium | 3,3 × 10−6 | 1,39 × 10−8 |
| Ions polyatomiques dont vanadium | 1,9 × 10−6 | 3,73 × 10−8 |
| Ion fer (Fe2+ ; Fe3+) | 1,3 × 10−6 | 2,33 × 10−8 |
| Ions polyatomiques dont titane | 1,0 × 10−6 | 2,09 × 10−8 |
| Ion aluminium (Al3+) | 1,0 × 10−6 | 3,71 × 10−8 |
| Autres espèces | g/kg | mol/kg |
| Eau (H2O) | 965 | 53,57 |
| Acide borique (B(OH)3) | 0,0198 | 0,000320 |
| Tétrahydroxyborate (B(OH)4−) | 0,0079 | 0,000100 |
| Dioxyde de carbone (CO2) | 4,0 × 10−4 | 9,09 × 10−6 |
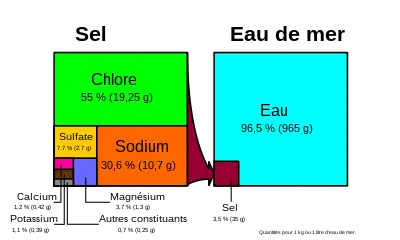
L'eau de mer est composée d'eau et de sels, ainsi que de diverses substances en faible quantité. Si plus des deux tiers des 92 éléments chimiques naturels sont présents dans l'eau de mer, la plupart le sont en faible quantité et difficilement décelables.
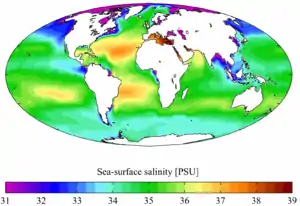
La salinité est un des paramètres les plus importants de l'eau de mer, et désigne la teneur en sels dissous. La salinité moyenne des océans est de 35 g/l, et reste généralement comprise entre 30 g/l (Atlantique Nord) et 40 g/l (mer Rouge)[7]. Les mers intérieures ou assimilées ont une salinité supérieure, parce que l'évaporation y concentre le sel. Les exceptions concernent donc des mers fermées ou semi-fermées, comme pour les valeurs extrêmes de 6 g/l dans les eaux de surface de la mer Baltique et 275 g/l dans la mer Morte. La mer ouverte la plus salée est la mer Rouge.
La grande particularité de l'eau de mer est que les proportions relatives de ses constituants sont sensiblement constantes (c'est-à-dire indépendantes de la salinité) ; cette propriété a été établie par le chimiste allemand William Dittmar, et permet de considérer l'eau de mer comme une solution de onze constituants majeurs dans de l'eau pure, à savoir, par ordre décroissant d'importance, le chlorure, l'ion sodium,le sulfate, l'ion magnésium, l'ion calcium, l'ion potassium, le bicarbonate, le bromure, l'acide borique, le carbonate et le fluorure. La loi de Dittmar permet ainsi de déterminer la salinité de l'eau de mer par une seule mesure : de la concentration d'un de ces constituants (par exemple, Cl−) ou d'une des propriétés physiques de l'eau de mer à une température donnée (comme la densité relative, l'indice de réfraction ou la conductivité).
Les deux principaux ions sont Na+ et Cl−, qui en s'associant forment le chlorure de sodium principal constituant du « sel marin », que l'on extrait dans les marais salants pour obtenir du sel alimentaire.
Les gaz dissous comprennent principalement : 64 % d'azote, 34 % d'oxygène, 1,8 % de dioxyde de carbone (soit 60 fois la proportion de ce gaz dans l'atmosphère terrestre).
L'« odeur de mer » est due, selon Andrew Johnston (université d'East Anglia), au sulfure de diméthyle (DMS)[8]. Il serait plus précis de dire que le DMS est un composant de l'odeur de la mer, un autre étant les phéromones (dictyoptérènes) de certaines algues.
Radioactivité - Anti-réactivité
La radioactivité naturelle de l'eau de mer est d'environ 12,7 Bq/l, essentiellement due au potassium 40 (émetteur β, responsable de 99 % de la radioactivité naturelle totale) et au rubidium 87 (émetteur β pour environ 1 %)[9].
L'eau de mer est anti-réactive principalement du fait du chlore 35 présent dans le chlore naturel avec une abondance de 75,53 %, qui est absorbant aux neutrons thermiques (la section efficace vaut 44 b). L'anti-réactivité apportée par l'eau de mer de salinité standard (35 g/l) supposée envahir le cœur d'un réacteur à eau en substitution de l'eau pure équivaut à celle de l'eau borée à une teneur en bore voisine de 260 ppm soit environ 3 800 pcm.
Indice de réfraction
La densité et donc l'indice de réfraction de l'eau de mer, noté n(λ), dépendent de la salinité. Les fonds marins (< 3 000 m) sont à une température inférieures à 4 °C (environ 2 °C ou moins) car l'eau salée voit son maximum de densité à une température inférieure, et surtout cet extremum s'estompe en un plateau constant avant la congélation[10].
Le mouvement des masses océaniques profondes est dominé par la variation de leur salinité. Elles proviennent principalement de la saumure issue de la formation de la banquise (congélation de l'eau de mer) en hiver aux pôles, ainsi que du refroidissement des eaux de surfaces dans les mêmes conditions. Le tableau ci-dessous montre comment le n(λ) augmente avec la salinité pour les D-lignes de sodium (moyenne : 5 893 Å = 589,3 nm) à 18 °C.
| Salinités (g/kg) | Variations de n(λ) | Emplacements |
|---|---|---|
| 5 | 0,00097 | Mers baltiques nordiques |
| 10 | 0,00194 | |
| 15 | 0,00290 | |
| 20 | 0,00386 | Enfoncements du Biafra |
| 25 | 0,00482 | |
| 30 | 0,00577 | |
| 35 | 0,00673 | Surface de l'océan Atlantique |
| 40 | 0,00769 | Mers rouges nordiques |
L'indice de réfraction est également une fonction de la pression de l'eau, mais la dépendance est tout à fait faible en raison de l'incompressibilité relative de l'eau (comme tous les liquides). En fait, sur les gammes normales des températures (0 - 30 °C), l'augmentation approximative du n(λ) est 0,0000165 quand la pression de l'eau augmente d'une atmosphère.
Les facteurs les plus significatifs affectant le n(λ) sont la longueur d'onde de la lumière et la salinité de l'eau. Néanmoins, le n(λ) excède de moins de 1 % la gamme indiquée des valeurs de ces variables[10].
Autres caractéristiques
La masse volumique de l'eau de mer en surface varie de 1 020 à 1 029 kg/m3, selon la température et la salinité. En profondeur, dans les océans, la haute pression peut augmenter la masse volumique jusqu'à des valeurs de l'ordre de 1 050 kg/m3. L'eau de mer, comme la plupart des liquides, est quasiment incompressible. Toutefois, si l'eau était vraiment incompressible, le niveau des océans serait 30 m plus haut qu'il n'est en réalité[11].
Le pH varie entre 7,5 et 8,4, pour une moyenne de l'ordre de 8,2.
La vitesse du son dans l'eau varie avec la température de l'eau et la pression, elle est donc sensible aux thermoclines ; elle est de l'ordre de 1 500 m/s.
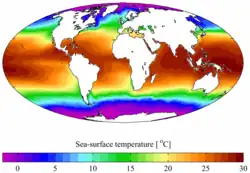 Température moyenne annuelle en surface.
Température moyenne annuelle en surface.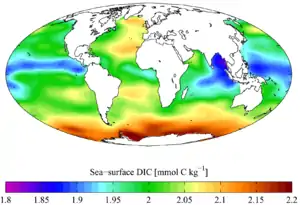 Carbone inorganique dissous.
Carbone inorganique dissous.
Potabilité
L'eau de mer n'est pas potable, et en général ne doit pas être bue par les êtres humains. Le sel en est le responsable : si l'on boit de l'eau de mer, à long terme la quantité d'eau nécessaire pour éliminer ces sels (grâce aux reins) devient supérieure à la quantité d'eau gagnée par absorption d'eau de mer[12]. La non-potabilité de l'eau de mer explique que, sur un navire ou une île au milieu de l'océan, on puisse « manquer d'eau », comme le dit La Complainte du vieux marin :
- « L’eau, l’eau partout,
- Et pas une goutte à boire. »
Si la consommation accidentelle de petites quantités d'eau de mer n'est pas dommageable pour le corps humain, il n'est pas possible de survivre à long terme en buvant uniquement de l'eau de mer. La croyance dans la potabilité de l'eau de mer a pour origine la traversée de l'Atlantique d'Alain Bombard, qui utilisait aussi la chair des poissons et l'eau de pluie. Ainsi, le médecin allemand Hannes Lindemann qui avait voulu réitérer le voyage de Bombard avait montré qu'il n'était pas possible de se passer d'eau douce additionnelle[13]. L'OMS a utilisé ses travaux pour ses recommandations.
Le taux de chlorure de sodium dans le sang humain et dans l'urine se situe généralement autour de neuf grammes par litre (0,9 % en masse), un taux qui varie peu. Boire de l'eau de mer (dont le taux de sel est de 3,5 %) accroît temporairement la concentration de sel dans le sang. Ce sel doit être éliminé, ce qui se fait en utilisant de l'eau provenant de cellules pour uriner. Les cellules finissent par mourir de déshydratation, suivies par les organes et finalement le corps entier.
L'effet de l'absorption d'eau de mer a été étudié sur des rats en laboratoire[14], en faisant varier la concentration d'eau de mer dans leur eau de boisson. Au fur et à mesure que cette concentration augmentait, les rats devaient boire de plus en plus pour uriner davantage, jusqu'à une concentration de 50 %, tandis que leur soif déclinait après 50 %. Ces chercheurs recommandent ainsi de ne pas passer brutalement d'une consommation d'eau douce à une consommation d'eau de mer (pour des naufragés par exemple), mais plutôt d'augmenter progressivement la proportion d'eau de mer dans l'eau douce.
Les manuels de survie conseillent en général de ne pas boire d'eau de mer. Par exemple, le Medical Aspects of Harsh Environments (« Aspects médicaux des environnements hostiles »)[15] présente une analyse de 136 voyages en embarcation de sauvetage. Le risque de décès s'élevait à 39 % pour ceux qui buvaient de l'eau de mer, contre 3 % pour ceux qui n'en buvaient pas.
Pour rendre l'eau de mer potable (processus de dessalement), plusieurs techniques existent. La plus simple est de la diluer avec de l'eau potable jusqu'à ce que la salinité soit acceptable ; on utilise cette technique en agriculture, pour l'irrigation. Les techniques plus complexes, mises en œuvre notamment sur les grands navires, incluent les évaporateurs à vide, les évaporateurs « flash » ou les membranes d'osmose inverse. La re-minéralisation de l'eau en fin de tels traitements doit alors être prévue pour une consommation sur une longue durée.
Prélèvements et utilisations de l'eau de mer
La mer constitue une ressource économique majeure pour les régions côtières : pêche (halieutique), tourisme, transport, logistique (activité portuaire)
L'eau de mer plus spécifiquement est exploitée pour son sel, par la saliculture, dans les marais salants.
La mariculture, partie de l'aquaculture, concerne l'élevage d'animaux marins ou la culture d'algues directement dans le milieu naturel marin ou bien à partir d'eau de mer brute prélevée à proximité du site d'exploitation.
La salinisation des sols est une cause de dégradation de l'agriculture et de perte de biodiversité. L’eau salée est la pire ennemie de l’agriculture[16]. L'eau dessalée est par ailleurs trop coûteuse à produire pour la plupart des cultures ; elle n'est peut-être abordable que pour les cultures à fort rapport économique, en particulier lorsque les investissements sont subventionnés. La principale application du dessalement de l'eau consiste en la fourniture d'eau potable. Les techniques de dessalement les plus courantes sont la distillation thermique — pour le traitement de grands volumes d'eau (55 000 m3/j) — et la technologie des membranes, l'électrodialyse inverse et l'osmose inverse[17].
L'eau de mer est prélevée en remplacement de l'eau douce dans les centrales nucléaires et thermiques de bord de mer pour leur refroidissement. Les centrales suédoises dépendent majoritairement de l'eau de mer pour leur refroidissement. La centrale nucléaire de Fukushima Daiichi est une centrale à eau de mer. Une partie des centrales des États-Unis utilisent de manière semblable l'eau de mer ; où ce sont 55 milliards de gallons US qui sont prélevés par jour dans la mer pour être immédiatement rejetés dans le même milieu à une température légèrement supérieure[18]. Le , une prolifération de méduses a nécessité l'arrêt du réacteur no 3 de la centrale nucléaire d'Oskarshamn en Suède durant trois jours[19], problème déjà rencontré dans d’autres centrales dans le monde.
À Hong Kong, l'eau de mer est disponible pour les chasses d'eau dans les zones métropolitaines et la plupart des nouvelles villes, couvrant environ 80 % de la population. Le département d'approvisionnement en eau de Hong Kong prévoit une extension de l'utilisation de l'eau de mer pour les chasses d'eau lorsque cela est économiquement justifié. Des travaux préparatoires sont en cours pour l'approvisionnement à Hong Kong Disneyland, Pok Fu Lam (en), Tuen Mun East, Yuen Long et Tin Shui Wai. En 1955, l’eau de mer a été utilisée pour la première fois dans un projet pilote. Expérience suivie par l'installation de systèmes de rinçage à l'eau de mer dans toutes les nouvelles maisons et dans certains districts à partir de 1957[20].
Citations
« La mer est salée parce qu'il y a des morues dedans. Et si elle ne déborde pas, c'est parce que la providence, dans sa sagesse, y a placé aussi des éponges » — Alphonse Allais (Citation humoristique)
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Seawater » (voir la liste des auteurs).
- Iver Duedall, Notes de cours - Océanographie, Florida Institute of Technology [lire en ligne].
- Données du World Ocean Atlas, 2001 [lire en ligne].
- Pierre Barthélémy, « Combien d’eau y a-t-il sur Terre ? », sur Passeur de sciences (consulté le )
- (en) E. Halley, « A short account of the cause of the saltiness of the ocean, and of the several lakes that emit no rivers; with a proposal, by help thereof, to discover the age of the world », Phil. Trans., vol. 29, , p. 296-300
- Paul R. Pinet, Invitation to Oceanography, St. Paul: West Publishing Company, 1996 (ISBN 978-0763740795), p. 133.
- UNESCO, Tables océanographiques internationales, citées par Andrew W.Dickson et Catherine Goyet (éds.), Handbooks of methods for the analysis of the various parameters of the carbon dioxide system in sea water, US Department of Energy, version 2, septembre 1994, ORNL/CDIAC-74, chap. 5, partie 6.1 « The major ion composition of seawater », p. V-10 [lire en ligne]
- La salinité de l'océan, sur la.climatologie.free.fr.
- Alice Bomboy, « L'odeur rafraîchissante de l'océan », (consulté le )
- La radioactivité naturelle en 10 épisodes, texte illustré publié par l'association Société française de radioprotection ; voir chap. 5 : Radioactivité en milieu marin ; p. 13/24 du [PDF].
- E. Dorsey, Properties of Ordinary Water Substance in all of its Phases: Water-vapor, Water, and all the Ices, Reinhold Publishing, 1940.
- André Louchet, Les océans : Bilan et perspectives, Paris, Armand Colin, coll. « Cursus géographie », , 179 p. (ISBN 978-2-200-60209-3), p. 22
- Ask A Scientist - Biology Archive lien
- (de) Von Ulli Kulke, « Durst löschen mit Salzwasser », dans Der Spiegel, 14 avril 2006 [lire en ligne (page consultée le 22 décembre 2010)]
- (en) Z. Etzion et R. Yagil, « Metabolic effects in rats drinking increasing concentrations of sea-water », Comp. Biochem. Physiol. A, vol. 86, no 1, , p. 49-55 (ISSN 0300-9629, DOI 10.1016/0300-9629(87)90275-1)
- Medical Aspects of Harsh Environments, chap. 29 « Shipboard Medicine » [lire en ligne]
- L’eau salée, pire ennemie de l’agriculture. lire en ligne, sur courrierinternational.com.
- Comité de l’agriculture, 19e session, Rome, 13-16 avril 2005, Dessalement de l'eau à des fins agricoles, Archives de la FAO
- Hybrid Sankey diagram of 2011 U.S. interconnected water and energy flows [image], Bauer, D., Philbrick, M. et Vallario, B. (2014), The Water-Energy Nexus: Challenges and Opportunities, U.S. Department of Energy, lire en ligne
- Prolifération de méduses en 2013, sur futura-sciences.com.
- Total Water Management, Water Supply Department (consulté le 29 août 2018), lire en ligne
Sources
Références générales
- (en) L.W. Tilton et J.K. Taylor, « Refractive index and dispersion of distilled water for visible radiation, at temperatures 0 to 60 °C », J. Res. Nat. Bur. Stand., vol. 20, , p. 419 (RP1085) (ISSN 0091-0635).
- (en) E. Dorsey, Properties of Ordinary Water Substance in all of its Phases: Water-vapor, Water, and all the Ices, Reinhold Publishing, 1940.
Voir aussi
Articles connexes
Liens externes
- Notices dans des dictionnaires ou encyclopédies généralistes :
- Ressource relative à la santé :
- (en) J. Floor Anthoni, Composition détaillée de l'eau de mer, 2006, sur seafriends.org.nz