Nitroguanidine
La nitroguanidine est un composé chimique de formule H2N–C(=NH)–NH–N+OO−. C'est un solide cristallin incolore, non directement inflammable, qui a une faible sensibilité explosive mais une vitesse de détonation élevée.
| Nitroguanidine | |
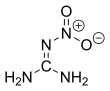 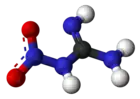 Structure de la nitroguanidine |
|
| Identification | |
|---|---|
| Nom UICPA | 1-Nitroguanidine |
| Synonymes |
Picrite |
| No CAS | |
| No ECHA | 100.008.313 |
| No CE | 209-143-5 |
| PubChem | |
| SMILES | |
| Apparence | Solide cristallin incolore |
| Propriétés chimiques | |
| Formule | CH4N4O2 [Isomères] |
| Masse molaire[1] | 104,068 1 ± 0,002 5 g/mol C 11,54 %, H 3,87 %, N 53,84 %, O 30,75 %, |
| Propriétés physiques | |
| T° fusion | 232 °C |
| T° ébullition | 250 °C (décomposition) |
| Masse volumique | 1 715 kg·m-3 |
| Précautions | |
| SGH[2] | |
 Attention |
|
| Unités du SI et CNTP, sauf indication contraire. | |
Production
La nitroguanidine est produite à partir de guanine, une substance organique qu'on trouve en abondance dans le guano (d'où son nom), qu'on extrait de cette matière première pour l'oxyder en guanidine HN=C(NH2)2[3] avant d'être nitrée en nitroguanidine ; le procédé industriel n'est pas encore dans le domaine public.
En laboratoire, on peut la préparer à partir d'urée O=C(NH2)2 et d'acide sulfamique H3NSO3 pour obtenir du sulfate de guanidine subséquemment nitré en nitroguanidine[4]
Applications
Explosifs
La nitroguanidine est utilisée comme explosif détonant dans les poudres triple-base pour réduire la température du flash sans affecter la pression de détonation.
Astronautique
Un effet similaire peut être obtenu avec la nitroguanidine dans un propergol composite à poudre d'aluminium (tel que les PCPA) pour préserver la poussée tout en limitant la température dans la chambre de combustion.
Autres
- La nitroguanidine et ses dérivés peuvent être utilisés comme insecticides, avec un effet comparable à celui de la nicotine.
- L'effet mutagène de la nitroguanidine peut être utilisé en laboratoire dans les études sur les biosynthèses bactériennes.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) A Strecker, « Untersuchungen über die chemischen Beziehungen zwischen Guanin, Xanthin, Theobromin, Caffein und Kreatinin », Annalen der Chemie und Pharmacie, vol. 118, , p. 151–177 (DOI 10.1002/jlac.18611180203)
- (en) Axt, « Nitroguanidine: from sulphamic acid and urea », Sciencemadness Discussion Board,