Tétranitrate de pentaérythritol
Le tétranitrate de pentaérythritol ou PETN (aussi connu en tant que nitropenta ou pentrite[4]) est l'un des plus puissants explosifs connus, avec un facteur d'efficacité relative de 1,66[5]. Il est plus sensible aux chocs ou à la friction que le TNT. Il est principalement utilisé dans les cordeaux détonants pour les mines ou les carrières, ou dans les cartouches de petits calibres. C'est l'ester nitrique du pentaérythritol.
| tétranitrate de pentaérythritol | |
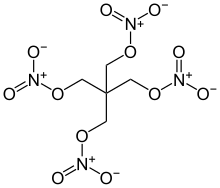
| |
| Structure de la Pentrite | |
| Identification | |
|---|---|
| Nom UICPA | nitrate de 3-(nitrooxy)-2,2-bis[(nitrooxy)méthyl]propyle |
| Synonymes |
1,3-dinitrooxy-2,2-bis(nitrooxyméthyl)propane |
| No CAS | |
| No ECHA | 100.000.987 |
| No CE | 201-084-3 |
| SMILES | |
| InChI | |
| Apparence | solide, blanc cristallin |
| Propriétés chimiques | |
| Formule | C5H8N4O12 [Isomères] |
| Masse molaire[1] | 316,136 6 ± 0,009 g/mol C 19 %, H 2,55 %, N 17,72 %, O 60,73 %, |
| Propriétés physiques | |
| T° fusion | 141,30 °C |
| T° ébullition | décomposition à 190 °C |
| Solubilité | Insoluble dans l'eau |
| Masse volumique | 1,773 g/ml à 20 °C |
| Limites d’explosivité dans l’air | 210 °C |
| Vitesse de détonation | 8 400 m·s-1 |
| Facteur d'efficacité relative | 1,66 |
| Précautions | |
| SGH[2] - [3] | |
 Danger |
|
| Transport | |
| Unités du SI et CNTP, sauf indication contraire. | |
Le PETN est un des composants utilisés dans la fabrication du Semtex. Durant la Seconde Guerre mondiale, la charge explosive du lance-roquettes M9A1 (240 ml de pentolite, un mélange de PETN et TNT), pouvait pénétrer 12 centimètres de blindage.
Les charges de démolition M118, couramment appelées Flex-X ou feuilles explosives, consistent en 4 feuilles de 500 grammes d'explosif flexible, entourées d'une enveloppe de plastique. Chaque feuille mesure approximativement 7,5 centimètres de large, 30 centimètres de long et 1 centimètre d'épaisseur. L'explosif exact contenu dans une charge M118 varie d'un fabricant à l'autre. Actuellement, certains fabricants utilisent le PETN comme explosif basique, d'autres utilisent le RDX.
C'est environ 80 grammes de PETN qu'a tenté de faire exploser Umar Farouk Abdulmutallab le lors du vol 253 Amsterdam Detroit.
En médecine, le PETN est utilisé comme vasodilatateur utilisé pour le traitement des maladies cardio-vasculaires telles l'angine de poitrine[6] - [7]. Le médicament pour les maladies du cœur, Lentonitrat, se compose de PETN presque pur[8].
Propriétés
C'est en étudiant les propriétés chimiques de l'érythritol (qu'il appelait érythroglucine), qu'en 1849 le chimiste écossais John Stenhouse découvrit le tétranitrate de pentaérythritol[9].
La vitesse de détonation du PETN est de 8 400 m·s-1 (pour une densité de 1,7).
La formule du PETN est C(CH2ONO2)4. À l'état pur, sa masse volumique est de 1,773 g·cm-3. Il est inodore et fond au-delà de 141 °C.
Réactivité
Le PETN est sensible aux chocs, aux frottements, aux décharges électrostatiques et aux fortes températures.
Il est incompatible avec les acides forts, les bases fortes et les agents oxydants (réactions vigoureuses possibles).
Au-delà de 190 °C, il se décompose en oxydes d'azote, monoxyde de carbone et dioxyde de carbone.
Il est souvent transporté imprégné à 15 % d'eau, ce qui réduit son potentiel explosif.
Polluant
Le PETN est un produit issu de la pétrochimie, la production et l'utilisation de ce genre de composé peuvent donc amener à une contamination de l'environnement. Le PETN n'est pas sujet à la biodégradation selon la fiche de sécurité du fabricant français Titanite[10], mais certains signalent une dégradation possible par des bactéries, dont la réductase qui dénitraterait celui-ci en trinitrate, puis dinitrate. Le dernier composé de ce processus, le pentaerythritol dinitrate, est ensuite dégradé en produits inconnus. En tout état de cause, il n'existerait pas de bioaccumulation. Par ailleurs, le PETN dégage du CO et du NOx lorsqu'il est détruit par tir ou brûlage.
Production
La préparation du PETN implique la nitration du pentaérythritol avec une solution concentrée d'acide nitrique blanc (sans dioxyde d'azote) et d'acide sulfurique. Cette solution d'acide mixte pouvant créer des sous-produits sulfurés instables, la méthode conseillée pour la nitratation est la méthode ICI, qui utilise plutôt de l'acide nitrique concentré seul à plus de 98 % :
Bibliographie
Voir aussi
Références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- « Special application explosives – Explosia », sur explosia.cz (consulté le )
- « PETN (Pentaerythritol tetranitrate) » (consulté le )
- « New Drugs », Can Med Assoc J, vol. 80, no 12, , p. 997–998 (PMID 20325960, PMCID 1831125)
- (en) Manuchair S. Ebadi, CRC desk reference of clinical pharmacology, , 704 p., Google Books excerpt (ISBN 978-0-8493-9683-0, lire en ligne), p. 383
- (en) Ravi Visvesvaraya Prasad, « Weapons of mass destruction », sur hindustantimes.com, (consulté le ).
- Cf. sa communication John Stenhouse, « Examination of the proximate principles of some of the lichens, Part I », Philosophical Transactions of the Royal Society, Londres, vol. 139, , p. 393-401.
- [PDF]Telecharger la fiche sur le site internet

