Érythritol
L’érythritol (ou tétrahydroxybutane, ou érythrite) est un polyol (ou sucre alcoolisé) découvert en 1874. C'est un édulcorant naturel que l'on trouve dans les fruits, les aliments fermentés ou la sauce au soja. Il possède un pouvoir sucrant inférieur au sucre (de 60-80 % à poids égal)[1], mais présente deux avantages : il contient moins de calories que le sucre de table (0,2 kcal/g contre 4 pour le sucre), et ne cause pas de caries. Il peut être produit à partir du glucose en fermentant celui-ci avec des levures appropriées dans des solutions aqueuses.
| Érythritol | ||
| ||
 | ||
| Identification | ||
|---|---|---|
| Nom UICPA | (2R,3S)-butane-1,2,3,4-tétrol | |
| Synonymes |
méso-érythritol |
|
| No CAS | |
|
| No ECHA | 100.005.217 | |
| No CE | 205-737-3 | |
| No E | E968 | |
| SMILES | ||
| Apparence | Solide blanc inodore, non hygroscopique et thermostable[1] |
|
| Propriétés chimiques | ||
| Formule | C4H10O4 [Isomères] |
|
| Masse molaire[2] | 122,119 8 ± 0,005 1 g/mol C 39,34 %, H 8,25 %, O 52,41 %, |
|
| Propriétés physiques | ||
| T° fusion | 121 °C sous 1 bar | |
| T° ébullition | 329 à 331 °C sous 1 bar | |
| Solubilité | Soluble dans l'eau (100 g·l-1 à 20 °C), légèrement soluble dans l'éthanol, insoluble dans l'oxyde de diéthyle[1]. |
|
| Masse volumique | 1,45 g·cm-3 (20 °C) | |
| Précautions | ||
| Directive 67/548/EEC | ||
 Xi |
||
| Unités du SI et CNTP, sauf indication contraire. | ||
Source
L'érythritol fut extrait en 1848 par l’Écossais John Stenhouse [3]. Cette substance sucrée est naturellement présente dans divers algues et lichens, libre ou à l'état de di-ester de l’acide orsellinique. On l'extrait de Roccella tinctoria ou de Roccella fuciformis, qui sont des lichens dits à orseille. Il est aussi présent dans de nombreux fruits communs et produits fermentés tels que[4] :
Structure et propriétés
Structure
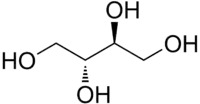
L'érythritol est un polyol qui ressemble au xylitol, mais avec un atome de carbone en moins. Il possède quatre fonctions alcool. Il est le composé méso (R, S) du butane-1,2,3,4-tétrol, diastéréoisomère du thréitol. C'est un composé de formule : CH2OH-CHOH-CHOH-CH2OH et sa masse molaire est de 122,1 g/mol.
Propriétés physiques
L'érythritol est un corps polymorphe qui se présente sous une forme cristalline blanche qui fond à 121 °C. Il forme de gros prismes pyramidaux.
L'érythritol est très soluble dans l'eau (100 g·l-1 à 20 °C) mais moins que le saccharose. Les solutions aqueuses sont peu conductrices.
Comme il n'est pas hygroscopique (il n'attire pas l'humidité), il conduit, en cas de cuisson, à des produits qui ont tendance à se dessécher si un autre composé hygroscopique n'entre pas dans leur composition.
Lors de sa dissolution dans l'eau, l'érythritol engendre une réaction endothermique. Le même effet se produit en bouche lors de la consommation de cristaux d'érythritol ce qui provoque une sensation de froid (frais).
Goût frais
Les cristaux d'érythritol engendrent un effet de froid lorsqu'ils se dissolvent dans la bouche à cause du caractère endothermique de la dissolution ; cette impression est renforcée éventuellement par des saveurs à base de menthe (pseudo-chaleur). Cet effet rafraîchissant est similaire à celui du mannitol et du sorbitol, mais inférieur à celui du xylitol qui est le plus prononcé parmi les polyols[5]. Pour cette raison, l'érythritol est utilisé comme édulcorant de friandises « rafraîchissant l'haleine ».
Propriété édulcorante
L'érythritol possède une saveur sucrée très vive qui tend à s'estomper plus vite que celle du saccharose et son pouvoir sucrant est moins intense, de 0,6-0,8 à poids égal[6].
L'érythritol possède une synergie avec les autres édulcorants et la propriété intéressante de pouvoir masquer certains effets indésirables comme l'amertume et le goût métallique d'autres produits.
Non cariogène
L'érythritol ne favorise pas la carie dentaire, il est considéré comme non cariogène, il ne subit pas de la part des bactéries buccales une fermentation suffisante pour abaisser le pH de la plaque dentaire à des niveaux propres à contribuer à une érosion de l'émail dentaire[7].
Métabolisme
Depuis longtemps l'érythritol est utilisé dans les cures de régime. Il passe dans le flux sanguin au niveau de l'intestin grêle, il est presque excrété en totalité dans l'urine. Comme l'érythritol est absorbé en grande partie avant d'arriver dans le gros intestin, il ne présente pas les effets laxatifs observés, par exemple, après une grande consommation d'autres polyols, et la plupart des consommateurs d'érythritol ne constatent pas d'effets secondaires. Comme il n'est pas dégradé il n'apporte pas ou peu de calorie (0,2 calorie par gramme).
Cette absorption s'effectue d'une manière bien spécifique et unique, les autres polyols n'étant pas absorbés de cette manière, directement dans le corps.
Un effet laxatif peut cependant être constaté en cas de consommation excessive de grandes quantités d'érythritol. Ceci se produit si le produit n'a pas le temps d'être complètement absorbé. Les bactéries ne digèrent pas facilement l'érythritol qui n'occasionne pas de ballonnements contrairement aux maltitol, sorbitol et lactitol.
Utilisation
La directive européenne 2006/52/CE permet l'utilisation de l'érythritol (E968) comme édulcorant au même titre que les autres polyols, sans limite d'utilisation (Quantum satis)[8]. Ce produit est utilisé dans l'industrie alimentaire comme exhausteur de goût, support, humectant, stabilisant, épaississant, agent de charge et séquestrant[6] - [8].
Des doutes avaient été émis en 2003 quant à son usage dans les boissons non alcoolisées par le SCF (comité scientifique de l'alimentation), qui craignait notamment l'apparition de troubles gastro-intestinaux (dont un effet laxatif), surtout chez les jeunes enfants. Ce produit devient en effet laxatif au-delà d'un seuil de 0,71 g/kg de poids corporel (seuil presque atteint par les gros consommateur de boissons non alcoolisées industrielles qui sont en moyenne à 0,59 g/kg)[9]. Alors qu'il est utilisé dans plus de 60 pays (dont Chine, États-Unis, Inde et Japon) l’autorité européenne de sécurité des aliments (Efsa) a émis en 2015 un avis positif à propos de son ajout aux boissons non alcoolisées en Europe. Cet avis fait suite à une demande répétée du groupe Cargill (producteur d'érythritol sous le nom de « Zerose » qui a redemandé une autorisation pour un usage jusqu'à 2,5 % dans les boissons. L'Efsa a considéré ce taux trop à risque. À la suite d'une nouvelle étude conduite chez des enfants de 4 à 6 ans, Cargill a abaissé sa demande à un taux de 1,6 %. Selon les chiffres apportés par Cargill en « l’exposition à l’érythritol passerait à 0,3 g/kg de poids corporel pour les 5 % de consommateurs les plus intensifs, un écart avec le seuil d’effets laxatifs jugé suffisant par l’Efsa »[9]. Une autorisation par la Commission européenne pourrait suivre (pour la stévia, elle a été effective 20 mois après l’avis positif de l'Efsa)[9].
Il est souvent utilisé en mélange avec du sucralose, à haut pouvoir sucrant afin de pallier son faible pouvoir sucrant lors d'utilisation pour remplacer du sucre et depuis peu, à de la stévia à très haut pouvoir sucrant.
Cet effet de rafraîchissement est mis à profit dans les barres de chocolat glacées, les chewing-gums ou les friandises. Mélangé à des graisses solides comme l'huile de noix de coco, le beurre de cacao ou de vache, l'effet de rafraîchissement tend à renforcer, de façon défavorable, l'aspect graisseux du produit. Ceci est très net dans le cas des barres de chocolat à l'érythritol.
Pour éviter cet effet de rafraîchissement non recherché, on ajoute très souvent de l'inuline à l'érythritol car ce composé se dissout avec un apport de chaleur, sans cristalliser. Malheureusement des quantités importantes d'inuline occasionnent des ballonnements, pour les personnes non habituées à en consommer. D'autres produits sont utilisés avec l'érythritol : l'isomalt pour sa faible chaleur de dissolution négative et la glycérine qui possède une chaleur de dissolution positive, une hygroscopie modérée et une forme liquide qui ne cristallise pas.
Production
La production industrielle de l'érythritol est obtenue par la fermentation de farine (blé et/ou maïs) par l'enzyme hydrolysate et par une levure osmophilique (Moniliella pollinis ou Trichosporonoides megachilensis). Le mélange est stérilisé, puis filtré avant purification sur résine échangeuse d'ions, charbon actif, ultrafiltration et cristallisation[6].
Notes et références
- Parlement européen et Conseil de l'europe, « Directive 2008/60/CE établissant des critères de pureté spécifiques pour les édulcorants pouvant être utilisés dans les denrées alimentaires. », Journal officiel de l’Union européenne, no L 158, , p. 17-40 (résumé, lire en ligne).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- La découverte de l'érythritol, que Stenhouse appelait « érythro-glucine » (sucre rouge), a été annoncée dans Stenhouse, J., « Examination of the proximate principles of some of the lichens », Philosophical Transactions of the Royal Society of London, vol. 138, , p. 63–89; Cf. notamment la p. 76 (DOI 10.1098/rstl.1848.0004)
- (en) Goossens J, Gonze M. Nutritional properties and applications of erythritol: Advances in Sweeteners. 1996, Bodmin, Blackie A&P, pp. 150-186.
- (en) R Steagall & L O’Brien Nabors, « Polyols: Beyond Sweet Taste », sur www.foodproductdesign.com, (consulté le )
- (en) JECFA, WHO, « ERYTHRITOL », Monograph de la FAO, sur www.fao.org, (consulté le ), p. 1-2 [PDF]
- (en) Kawanabe J, Hirasawa M, Takeuchi T, Oda T & Ikeda T, « Noncariogenicity of erythritol as a substrate », Caries Res., vol. 26, no 5, , p. 358-62 (résumé)
- Parlement européen et Conseil de l'Europe, « Directive 2006/52/CE du Parlement européen et du Conseil du 5 juillet 2006 », Journal officiel de l'Union européenne, no L 204, , p. 10-22 (lire en ligne [PDF], consulté le ).
- Loury, Romain (2015) "Après la stévia, l’érythritol", publié Le 11 mars 2015 par le Journal de l'Environnement
Annexes
Articles connexes
Liens externes
- Les édulcorants
- Information About Erythritol from Cargill, a US-Producer of Erythritol
- (en) ERYTHRITOL Compendium of Food Additive Specifications (Addendum 7) - Joint FAO/WHO Expert Committee on Food Additives 53rd session - Rome, 1-10 June 1999