Daphnia magna
Daphnia magna est une espèce de petits crustacés planctoniques mesurant de 1,5 à 5 mm appartenant à la sous-classe des Phyllopodes, groupe existant depuis le Précambrien. On trouve cette espèce dans divers habitats d'eau douce partout dans l'hémisphère nord et en Afrique du Sud[1]. Elle est utilisée en recherche en biologie depuis le XVIIIe siècle[2]. On l'utilise couramment en écologie, biologie évolutive et écotoxicologie[3]. Cette espèce sert également de nourriture pour poisson en aquaculture et aquariophilie[4].

Description

D. magna possède les traits morphologiques généraux du genre Daphnia. La femelle mesure jusqu'à 5 mm, le mâle mesure environ 2 mm. L'organisme est protégé par une carapace translucide qui comprend une ouverture ventrale et cinq paires d'appendices thoraciques. Cette carapace est faite de chitine, un polysaccharide transparent[5]. Des rangées de pointes sont visibles le long de la face dorsale de la carapace. L'intestin est en forme de crochet et possède deux cæca. La tête est composée de deux paires d'antennes et d'un large œil composé qui lui permet de se repérer lors de ses déplacements[6] - [7]. Les femelles adultes se distinguent d'espèces similaires comme D. pulex grâce à l'absence de peigne sur la griffe abdominale et à la présence de deux peignes distincts sur l'abdomen. Les mâles sont plus petits que les femelles et leur première paire d'antennes est plus développée, ce qui permet de les distinguer clairement des femelles.
Écologie
D. magna est une espèce clé de nombreux habitats lentiques. On la trouve dans des lacs et des mares peu profonds dont le sédiment est riche en matière organique[7]. La présence de prédateurs (principalement des poissons) peut engendrer des réponses phénotypiques plastiques. Les kairomones émis par les poissons provoquent chez Daphnia le développement de structures protectrices visibles telles qu'une épine allongée et un casque[8]. C'est un important consommateur primaire ainsi que la proie préférée de nombreux poissons planctivores[9]. Les autres prédateurs comprennent les larves de Chaoborus, les hémiptères (Notonecta) et les Triops. La taille importante des daphnies adultes les protège de la prédation par certains invertébrés planctivores.
Répartition et habitat
D. magna est répandue dans l'hémisphère nord et en particulier dans le Paléarctique[10]. On la trouve dans des étendues d'eau douce de différentes tailles, des lacs aux mares. Elle se trouve typiquement dans les mares éphémères et les bassins de rochers en bord de mer. Elle tolère jusqu'à 20 % de salinité, ce qui est plus élevé que chez ses consœurs du genre[5]. C'est une espèce pélagique car elle se nourrit de particules suspendues dans la colonne d'eau. Néanmoins on la trouve souvent proche du substrat (contrairement aux autres espèces de Daphnia) où elle se nourrit de périphyton[11] et de sédiment[12].
Nutrition
D. magna se nourrit en filtrant les particules suspendues dans l'eau[12]. Les appendices thoraciques forment un appareil filtreur spécialisé qui génère un courant d'eau à l'intérieur de l'ouverture thoracique de la carapace. Ce courant permet l'ingestion de la nourriture. D. magna se nourrit d'algues unicellulaires, de bactéries et de détritus[11] - [12], ce qui lui procure un avantage compétitif par rapport aux filtreurs strictement pélagiques dans certains environnements lorsqu'il y a temporairement peu de particules suspendues dans l'eau comme en haute altitude.
Reproduction
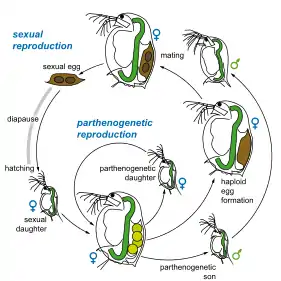


Comme la plupart des espèces du genre Daphnia, D. magna se reproduit par parthénogenèse cyclique. Cette forme de reproduction se caractérise par l'alternance de la production d’œufs asexuels (reproduction clonale) et haploïdes qui doivent être fécondés. Les œufs sexuels (jusqu'à plusieurs dizaines par ponte) sont diploïdes et donnent en général des femelles ou alors des mâles lorsque les conditions deviennent défavorables. Les œufs asexuels éclosent dans la poche reproductrice de la femelle un jour après la ponte et sont expulsés après trois jours. Les juvéniles subissent quatre à six mues avant d'arriver à maturité, alors âgés de cinq à dix jours. Une femelle adulte pond tous les trois ou quatre jours jusqu'à sa mort, la taille de ponte pouvant aller jusqu'à une centaine d’œufs. Un individu peut vivre plus de deux mois en laboratoire[13]. En réponse à des conditions environnementales défavorables (précédant le gel ou l’assèchement de la mare par exemple), la femelle produit deux gamètes haploïdes pouvant être fécondés par un mâle et emballés dans une poche protectrice appelée éphippium. Ces œufs entrent alors dans une phase de diapause et peuvent résister à des conditions difficiles pendant de très longues périodes de temps. L'éclosion est engendrée par des stimuli favorables tels qu'une augmentation de la photopériode ou de la température. Ces œufs sexuels produisent uniquement des femelles. Certaines souches de D. magna qui ne produisent pas de mâles peuvent se reproduire par parthénogenèse automictique. Dans ce cas deux cellules haploïdes produites par méiose fusionnent, donnant un zygote femelle sans fertilisation préalable. Ce mécanisme tend à rendre la progéniture homozygote, ce qui peut devenir délétère[14].
Comportement
Le nom commun de D. magna puce d'eau semble venir de sa nage typique qui ressemble à une série de petits sauts. Le mouvement de la seconde paire d'antennes génère un saut vers le haut suivi d'une coulée de l'animal. Bien que plus commun chez d'autres espèces lacustres, des phénomènes de migrations horizontale et verticale ont été observés chez cette espèce. La migration verticale de Viel (DVM)[15] est un déplacement des individus dans les couches d'eau supérieures, où ils passent la nuit, vers les couches d'eau inférieures plus sombres où ils passent la journée. Ce comportement réduit l'exposition aux prédateurs visuels (de nombreux poissons) en trouvant refuge près du fond où il y a moins de lumière pendant la journée et permet à l'animal de se nourrir sans risque pendant la nuit là où la nourriture est plus abondante[5]. Ce comportement est un comportement phototactique (mouvement de l'organisme vers ou éloigné d'une source de lumière).
Chez D. magna ce comportement est en partie inné (génétique) et en partie acquis (induit par la présence de kairomones de poissons)[8]. Dans le cas d'une migration horizontale de Viel, D. magna trouve refuge dans des herbiers aquatiques proches de la rive pendant la journée et migre vers le large pendant la nuit. Des cas de migration inversée ont été observés lorsque le risque de prédation visuelle est plus important au fond ou sur le littoral, par exemple lorsque certains poissons chassent dans les herbiers aquatiques. D. magna, tout comme la plus petite D. pulex, est capable de modifier son comportement de nutrition lorsque les particules suspendues sont insuffisantes. Elle remue alors le sédiment avec sa deuxième paire d'antennes ce qui libère de nouvelles particules en suspension dans l'eau[12] - [16].
Parasitisme
De nombreux parasites de D. magna ont été identifiés et étudiés (Table 1), ce qui fait de cette espèce un bon modèle pour l'étude des interactions hôte-parasite. D. magna présente une spécificité hôte-parasite très importante, c'est-à-dire que la résistance au parasite ainsi que les comportements induits par le parasite varient fortement selon les génotypes[17].


| Taxon | Parasite | Tissu ou site d'infection | Transmission |
| Bacteria | Pasteuria ramosa | Sang, extracellulaire | Horizontale, de l'hôte mort |
| Spirobacillus cienkowskii | Sang, extracellulaire | Horizontale, de l'hôte mort | |
| Fungi | Metschnikowia bicuspidata | Cavité corporelle, extracellulaire | Horizontale, de l'hôte mort |
| Microsporidia | Flabelliforma magnivora | Corps gras, ovaire, intracellulaire | Verticale |
| Hamiltosporidium tvärminnensis | Intracellulaire | Horizontale et verticale | |
| H. magnivora | Intracellulaire | Horizontale et verticale | |
| Glucoides intestinalis | Paroi intestinale, intracellulaire | Horizontale, de l'hôte vivant | |
| Ordospora colligata | Paroi intestinale, intracellulaire | Horizontale, de l'hôte vivant | |
| Larssonia obtusa | Corps gras, intracellulaire | ? | |
| Amoeba | Pansporella perplexa | Paroi intestinale, extracellulaire | Horizontale, de l'hôte vivant |
| Chytrid fungus | Caullerya mesnili | Paroi intestinale, intracellulaire | Horizontale, de l'hôte vivant |
| Nematoda | Echinuria uncinata | Cavité corporelle, extracellulaire | Horizontale, vers un deuxième hôte |
| Cestoda | Cysticercus mirabilis | Cavité corporelle, extracellulaire | Horizontale, vers un deuxième hôte |
Microbiote
D. magna peut être considérée comme un écosystème complexe, colonisée par une communauté de microorganismes commensaux, symbiotiques et pathogènes[18] - [19] également appelée microbiote. La proximité immédiate du microbiote et de son hôte permet une interaction étroite, capable d'influencer le développement[20], la résistance aux maladies[21] - [22] ainsi que la nutrition[23]. L'absence de microbiote chez D. magna entraîne une croissance ralentie, une diminution de la fécondité et une augmentation de la mortalité[24]. Le microbiote intestinal a également été étudié sous diverses conditions. En effet ce microbiote se modifie après la mort de l'individu et sa complexité est réduite et stabilisée en cas de faible nutrition[25]. La présence du microbiote dans une situation de nourriture suffisante ou abondante a un large effet positif sur D. magna[26].
Daphnia magna comme organisme modèle
Ses nombreux avantages font de D. magna un modèle largement utilisé en recherche. Sa transparence permet l'observation des structures internes au microscope, tandis que sa reproduction par parthénogenèse cyclique permet de produire des lignées clonales (reproduction asexuelle) ou bien de réaliser des croisements entre souches (reproduction sexuelle). En recherche, D. magna est considérée facile à conserver en laboratoire. Parmi ses avantages pour l'expérimentation on trouve un temps de génération court, un espace de stockage limité, un nourrissage aisé et économique et une maintenance aisée. D. magna est utilisée dans différents champs de recherche comme l'écotoxicologie, la génétique des populations, l'évolution du sexe, la plasticité phénotypique, l'écophysiologie (incluant la biologie du changement climatique) et les interactions hôte-parasite[27].
Historiquement, D. magna a permis de tester certaines théories et de conduire des études pionnières :
- Les macrophages attaquent les parasites dans le cadre de l'immunité cellulaire (Metchnikoff[28] – Prix Nobel 1908)
- Études écotoxicologiques (Einar Naumann[29])
D'autres études récentes ont utilisé les éphippies de D. magna présentes dans le sédiment d'une mare afin de reconstruire l'histoire évolutive de la population de cette mare en relation avec l'un de ses parasites P. ramosa[30].
Enfin, cette daphnie est utilisée depuis 1934 pour mesurer des écotoxicités[31].
Références
- (en) « Daphnia magna », sur Animal Diversity Web (consulté le )
- J-C. Schaffer, Die grünen Armpolypen, die geschwänzten und ungeschwänzten zackigen Wasserflöhe und eine besondere Art kleiner Wasseraale, Allemagne, Regensburg, 1755
- (en) Winfried Lampert et Ulrich Sommer (trad. de l'allemand), Limnoecology : The Ecology of Lakes and Streams, Oxford, OUP Oxford, , 324 p. (ISBN 978-0-19-921392-4, lire en ligne)
- exemple en aquariophilie: http://www.aqualiment.eu/achat/produit_details.php?id=5
- (en) Dieter Ebert, Ecology, Epidemiology, and Evolution of Parasitism in Daphnia, National Center for Biotechnology Information (US), (ISBN 1-932811-06-0, lire en ligne)
- (de) Heinz Streble et Dieter Krauter, Das Leben im Wassertropfen : Mikroflora und Mikrofauna des Süßwassers. Ein Bestimmungsbuch, Kosmos, , 432 p. (ISBN 978-3-440-12634-9, lire en ligne)
- (en) Methods for measuring the acute toxicity of effluents and receiving waters to freshwater and marine organisms, DIANE Publishing (ISBN 978-1-4289-0404-0, lire en ligne)
- (en) Luc De Meester, « Genotype, Fish-Mediated Chemical, and Phototactic Behavior in Daphnia Magna », Ecology, vol. 74, no 5, , p. 1467-1474 (DOI 10.2307/1940075, lire en ligne)
- (en) W. Lampert, « Daphnia: Model herbivore, predator and prey. », Polish Journal of Ecology, (lire en ligne, consulté le )
- (en) John A. H. Benzie, The Genus Daphnia : (including daphniopsis) (anomopoda : daphniidae), Ghent/Leiden, Kenobi Productions, , 376 p. (ISBN 978-90-5782-151-6, lire en ligne)
- (en) Silvana Siehoff, Monika Hammers-Wirtz, Tido Strauss et Hans Toni Ratte, « Periphyton as alternative food source for the filter-feeding cladoceran Daphnia magna », Freshwater Biology, vol. 54, no 1, , p. 15–23 (ISSN 1365-2427, DOI 10.1111/j.1365-2427.2008.02087.x, lire en ligne)
- (en) Geoffrey Fryer, « Functional Morphology and the Adaptive Radiation of the Daphniidae (Branchiopoda: Anomopoda) », Philosophical Transactions of the Royal Society of London B: Biological Sciences, vol. 331, no 1259, , p. 1–99 (ISSN 0962-8436, DOI 10.1098/rstb.1991.0001, lire en ligne)
- (en) « Daphnia magna », sur cfb.unh.edu (consulté le )
- (en) Nils Svendsen, Celine M. O. Reisser, Marinela Dukić, Virginie Thuillier, Adeline Ségard, Cathy Liautard-Haag, Dominique Fasel, Evelin Hürlimann et Thomas Lenormand, « Uncovering Cryptic Asexuality in Daphnia magna by RAD Sequencing », Genetics, vol. 201, no 3, , p. 1143–1155 (ISSN 1943-2631, PMID 26341660, PMCID 4649641, DOI 10.1534/genetics.115.179879, lire en ligne)
- (en) Bart T. J De Stasio, N. Nibbelink et P. Olsen, « Diel vertical migration and global climate change: a dynamic modeling approach to zooplankton behavior », Verh. Internat. Verein. Limnol., (lire en ligne, consulté le )
- (en) P. A. Horton, M. Rowan, K. E. Webster et R. H. Peters, « Browsing and grazing by cladoceran filter feeders », Canadian Journal of Zoology, vol. 57, no 1, , p. 206–212 (ISSN 0008-4301, DOI 10.1139/z79-019, lire en ligne)
- (en) T. J. Little, W. Chadwick et K. Watt, « Parasite variation and the evolution of virulence in a Daphnia-microparasite system », Parasitology, vol. 135, no 3, , p. 303–308 (ISSN 1469-8161, PMID 18005474, DOI 10.1017/S0031182007003939, lire en ligne)
- (en) J Lederberg et AT McCray, « 'Ome Sweet 'Omics—a genealogical treasury of words », Scientist, vol. 15, , p. 8 (lire en ligne)
- (en) The NIH HMP Working Group, Jane Peterson, Susan Garges, Maria Giovanni, Pamela McInnes, Lu Wang, Jeffery A. Schloss, Vivien Bonazzi et Jean E. McEwen, « The NIH Human Microbiome Project », Genome Research, vol. 19, no 12, , p. 2317–2323 (ISSN 1088-9051, PMID 19819907, PMCID 2792171, DOI 10.1101/gr.096651.109, lire en ligne)
- (en) Jennifer M. Bates, Erika Mittge, Julie Kuhlman, Katrina N. Baden, Sarah E. Cheesman et Karen Guillemin, « Distinct signals from the microbiota promote different aspects of zebrafish gut differentiation », Developmental Biology, vol. 297, no 2, , p. 374–386 (DOI 10.1016/j.ydbio.2006.05.006, lire en ligne)
- (en) Andrew J. Macpherson et Nicola L. Harris, « Interactions between commensal intestinal bacteria and the immune system », Nature Reviews Immunology, vol. 4, no 6, , p. 478–485 (DOI 10.1038/nri1373, lire en ligne)
- (en) Hauke Koch et Paul Schmid-Hempel, « Socially transmitted gut microbiota protect bumble bees against an intestinal parasite », Proceedings of the National Academy of Sciences, vol. 108, no 48, , p. 19288–19292 (ISSN 0027-8424, PMID 22084077, PMCID 3228419, DOI 10.1073/pnas.1110474108, lire en ligne)
- (en) Les Dethlefsen, Margaret McFall-Ngai et David A. Relman, « An ecological and evolutionary perspective on human–microbe mutualism and disease », Nature, vol. 449, no 7164, , p. 811–818 (DOI 10.1038/nature06245, lire en ligne)
- (en) M. P. Sison-Mangus, A. A. Mushegian et D. Ebert, « Water fleas require microbiota for survival, growth and reproduction », The ISME journal, (DOI 10.1038/ismej.2014.116, lire en ligne, consulté le )
- (en) Heike M. Freese et Bernhard Schink, « Composition and Stability of the Microbial Community inside the Digestive Tract of the Aquatic Crustacean Daphnia magna », Microbial Ecology, vol. 62, no 4, , p. 882–894 (ISSN 0095-3628, DOI 10.1007/s00248-011-9886-8, lire en ligne)
- (en) Martijn Callens, Emilie Macke, Koenraad Muylaert, Peter Bossier, Bart Lievens, Michael Waud et Ellen Decaestecker, « Food availability affects the strength of mutualistic host–microbiota interactions in Daphnia magna », The ISME Journal, vol. 10, no 4, , p. 911-920 (DOI 10.1038/ismej.2015.166, lire en ligne)
- (en) Dieter Ebert, « A Genome for the Environment », Science, vol. 331, no 6017, , p. 539–540 (PMID 21292957, DOI 10.1126/science.1202092, résumé)
- (en) Elie Metchnikoff, « Uber den Kampf der Zellen gegen Erysipelkokken. Ein Beitrag zur Phagocytenlehre. », Archiv für pathologische Anatomie und Physiologie und für klinische Medicin, (lire en ligne, consulté le )
- (en) Einar Naumann, « Über die Anwendung von Daphnia magna Straus als Versuchstier zur experimentellen Klarlegung der Lebensverhältnisse im Wasser », Internationale Revue der gesamten Hydrobiologie und Hydrographie, vol. 31, no 1, , p. 421–431 (ISSN 1522-2632, DOI 10.1002/iroh.19340310126, lire en ligne)
- (en) Ellen Decaestecker, Sabrina Gaba, Joost A. M. Raeymaekers, Robby Stoks, Liesbeth Van Kerckhoven, Dieter Ebert et Luc De Meester, « Host–parasite ‘Red Queen’ dynamics archived in pond sediment », Nature, vol. 450, no 7171, , p. 870–873 (DOI 10.1038/nature06291, lire en ligne)
- Winfried Lampert, Ulrich Sommer, Limnoecology: The Ecology of Lakes and riversStreams, OUP Oxford, 2007. (ISBN 9780199213924).
Liens externes
| Identifiants externes pour Daphnia magna | |
|---|---|
| Encyclopédie de la Vie | 1020231 |
| GBIF | 2234822 |
| SITI | 83884 |
| NCBI | 35525 |
| WoRMS | 148372 |
| Also found in: Wikispecies, ADW | |
- (en) Référence Catalogue of Life : Daphnia (Ctenodaphnia) magna Straus, 1820 (consulté le )