Bilateria
Les bilatériens (Bilateria) forment un des plus grands clades des métazoaires, ayant un côté droit et un côté gauche (contrairement aux méduses et aux éponges de mer). Ils incluent la majorité des animaux connus, comme les mammifères, les insectes, les mollusques ou les « vers ». Ils comptent environ 1 200 000 espèces. Les bilatériens ont aussi souvent un ventre et un dos, un avant et un arrière, en plus d'avoir un côté droit et un côté gauche[1] - [2] - [3]. Ces axes de polarité sont hautement corrélés avec la complexification du système nerveux, les mouvements de localisation des cellules étant gérés ou régulés par les gènes homéotiques[4]. « La polarité antéropostérieure détermine la centralisation des informations sensorielles et la céphalisation de l'animal, alors que la polarité dorso-ventrale oriente le système nerveux en position soit ventrale (hyponeurien) soit dorsale (épineurien)[5] ».

Infra-règnes de rang inférieur
- clade Eubilateria :
- † Proarticulata
- Triploblastica (Lankester, 1877 )

La symétrie bilatérale présente l'intérêt de favoriser des déplacements dans une seule direction, développant la spécialisation des segments entre la tête et la queue[6].
Description et caractéristiques
Les bilatériens ou artiozoaires sont caractérisés, au moins au stade larvaire, par une symétrie bilatérale (cette symétrie définit des axes de polarité antéro-postérieur, dorso-ventral et transversal droite/gauche[7]) à l'origine de leur nom (l'adjectif grec ἅρτιος (ártios) signifie pair (multiple de deux)[8]), la présence de trois feuillets embryonnaires[1] - [3] (ils sont triploblastiques) ectoderme, mésoderme et endoderme (au lieu de deux pour les autres métazoaires dits diploblastiques), et un tube digestif. Le système nerveux n'est souvent pas constitué d'un plexus nerveux, et les neurones sont souvent regroupés au sein de structures diverses : ganglions, chaîne nerveuse ou cerveau.
Il existe deux grandes divisions de bilatériens selon que, lors du développement embryonnaire, la bouche apparaît avant l'anus ou le contraire : les protostomiens (bouche en premier) que sont principalement les arthropodes et les mollusques, et les deutérostomiens (bouche en second) que sont les vertébrés et les échinodermes. Possiblement, les Xenacoelomorphes présentent une troisième division des Bilatériens selon les phylogénies[9] (ils sont parfois placés dans les deutérostomiens par les analyses génétiques[10]). Les Xénacoelomorphes ne possédant pas d'anus, leur développement n'est ni deutérostome, ni protostome. Il faut cependant faire attention à bien différencier les clades Deuterostomia et Protostomia du development protostome (protostomie) ou deutérostome (deutérostomie). En effet, plusieurs taxons du clade Protostomia ont un development deutérostome comme les priapuliens ou les chaetognathes[11]. Ce caractère peut grandement varier chez les Spiralia (Protostomia), au sein du même phylum, par exemple chez les Brachiopoda, certains ayant un développement deutérostome comme Novocrania anomala et d'autres un développement protostome, comme Terebratalia transversa[12], voir au sein d'un même genre d'annélide par exemple entre Owenia fusiformis (protostomie)[12] et Owenia collaris (deutérostomie)[13].
Certains bilatériens comme les échinodermes ne présentent une symétrie bilatérale qu'au stade larvaire qu'ils perdent une fois adulte pour une morphologie radiaire. De même, les gastéropodes ont perdu la symétrie bilatérale de leurs organes internes.
Le plus ancien représentant connu des bilatériens serait Vernanimalcula guizhouena, apparu durant l'Édiacarien, il y a 555 millions d'années[14].
Phylogénie
Cladogramme selon les études de Philippe, Marlétaz et Yamazaki[15] - [16] - [17] :
| Bilateria | |
Origine évolutive des bilatériens
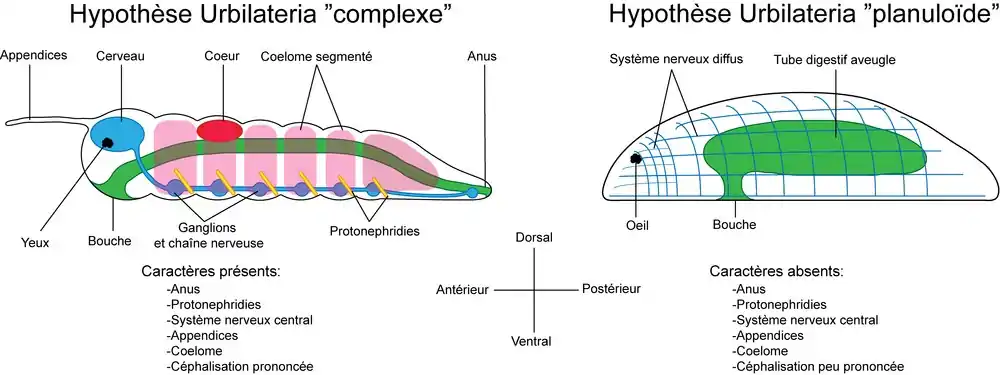
L'ancêtre hypothétique des bilatériens est souvent appelé Urbilateria et des discussions subsistent sur les différents caractères que possédait cet organisme[18].
Plusieurs hypothèses sont suggérées pour expliquer l'origine des bilatériens[19].
- L'hypothèse planuloïde selon laquelle les bilatériens auraient pour origine une larve planula similaire à celle trouvée chez les cnidaires. Selon cette hypothèse l'ancêtre des bilatériens était acoelomate.
- L'hypothèse archicoelomate ou gastrulation amphistomique (gastrulation à deux orifices)[12] selon laquelle l'ancêtre diploblastique des bilatériens possédait une bouche en forme de fente qui se serait refermée en son milieu, donnant ainsi deux orifices : un antérieur, la bouche, et un postérieur, l'anus. Selon cette hypothèse l'ancêtre des bilatériens était coelomate par internalisation de poches gastriques.
- L'hypothèse de la métamérie primaire, selon laquelle la métamérie des bilatériens provient de la répétition de poches gastriques ancestrales d'un ancêtre diploblastique. Selon cette hypothèse, l'ancêtre des bilatériens était coelomate et métamérisé.
- L'hypothèse coloniale primaire selon laquelle l'origine des bilatériens serait une colonie d'organismes diploblastiques chacun donnant un segment. Selon cette hypothèse, l'ancêtre des bilatériens était coelomate et métamérisé.
Ces hypothèses se basent sur la paléontologie et l'embryologie[19], cependant aujourd'hui la phylogénie a aussi pris une place cruciale dans cette discussion[20], et une des questions qu'il reste difficile à résoudre est de savoir si l'ancêtre des bilatériens était un organisme relativement complexe[21] et segmenté[22] - [23] ou acoelomate et relativement simple[24], voire microscopique[25]. À ce titre, la position phylogénétique des Xenacoelomorpha ainsi qu'une bonne connaissance de l'évolution interne de ce groupe sont cruciales pour soutenir ou pas l'hypothèse d'une origine acoelomate des bilatériens[26] - [27]. De plus les organismes non bilatériens peuvent aussi apporter des éléments de réponse, comme les cnidaires dont la larve planula possède une symétrie bilatérale, ainsi que la cavité digestive des anthozoaires. Certains auteurs estiment donc que la symétrie bilatérale serait donc un caractère plésiomorphe des bilatériens (ce caractère serait apparu avant l'origine des bilatériens)[18] - [28].
Registre fossile
La plus ancienne preuve d'existence de bilatérien provient de fossiles découverts dans des sédiments d'âge édiacarien. Jusqu'en 2020, un fossile de Kimberella était considéré comme celui du premier bilatérien, et daté de 555 millions d'années environ[30]. En mars 2020 une étude parue dans la revue PNAS[31] indique la découverte à plus de 100 mètres sous la première apparition de Kimberella à Nilpena et aux Flinders Ranges (en Australie) de fossiles d'Ikaria wariootia (en), un animal vermiforme, considéré dès lors comme le plus ancien bilatérien connu - fossiles datés de 555 millions d'années[32].
Les fossiles antérieurs sont controversés. Un fossile de Vernanimalcula (entre 600 et 580 millions d'années) a été présenté comme le premier bilatérien connu, mais sa morphologie a été attribuée par certains spécialistes à des cristallisations de phosphates[33] - [34]. Des terriers créés par des formes de vie bilatérales ont été trouvés dans la formation de Tacuarí en Uruguay et datés de 585 millions d'années[35], cependant l'âge des roches a été contesté[32].
Le stade vermiforme
Caractérisation fonctionnelle des types vermiformes
L'organisation de type « ver » est une nouvelle réponse apportée à une question centrale du règne animal, celle de l'alimentation. La stratégie de base des organismes de type « ver » (vermiforme) est de se déplacer pour aller chercher la nourriture, au lieu d'attendre qu'elle passe à portée. Cette stratégie permet notamment d'exploiter des déchets organiques, qui peuvent être à haute valeur nutritive, mais ne se déplacent pas.
Ainsi, une grande majorité des animaux ou métazoaires (exception faite de quelques grands groupes à l'origine évolutive ancienne comme les éponges et les Cnidaires) sont des bilatériens, qui dérivent d'un schéma fondamental : le tube. Le développement est organisé autour d'un axe tête/queue d'une part, mais aussi dos/ventre d'autre part chez de nombreux groupes. Ces deux axes conduisent à un plan d'ensemble où les côtés droits et gauche tendent à être symétriques, d'où le nom de bilatérien.
Caractères propres des bilatériens
La principale caractéristique propre aux bilatériens est invisible : il s'agit des gènes de développement HOX, qui régulent le développement différencié des organes d'avant en arrière, et leur coordination avec le système nerveux. Ce système permet l'apparition d'une anatomie différenciée, et la coordination opérationnelle de son activité par le traitement de flux d'informations, qui ouvre la voie à une céphalisation évolutive.
Les vers les plus simples marquent une étape qualitative supplémentaire par rapport aux cnidaires : les cellules nerveuses s'organisent en un système nerveux cohérent, prototype de ce qui deviendra le cerveau dans les animaux supérieurs. C'est cette capacité de déplacement et de réaction à l'environnement qui fait considérer que le degré d'organisation vermiforme est le premier stade indiscutablement « animal ».
La deuxième caractéristique majeure propre aux vers (absente chez les vers plats) est la présence d'un canal alimentaire et d'une fonction digestive : à une extrémité, une bouche absorbe la nourriture, à l'autre, un anus excrète les déchets. Entre le « tube extérieur » qui forme la peau (ectoderme) et le « tube intérieur » (endoderme) qu'est le canal alimentaire, un tissu intermédiaire, le mésoderme, peut se développer et former des organes internes de plus en plus complexes.
L'évolution du tube digestif à partir de la cavité gastrique ancestrale semble avoir été faite en deux étapes principales. Chez les protostomiens, les deux orifices du canal alimentaire sont formés à partir du blastopore, dont les lèvres se rapprochent pour former un canal par soudure longitudinale. Chez les deutérostomiens, l'orifice du blastopore devient l'anus, le canal alimentaire étant formé par un percement ultérieur qui évoluera vers la bouche.
Les « vers » sont à l'origine d'une seconde innovation majeure de l'évolution : la segmentation (métamérie). L'apparition de ce processus semble également s'être produite dans plusieurs branches différentes.
- Les types d'organisation présentés ici sont des grades évolutifs ne correspondant généralement pas à des groupes monophylétiques, mais paraphylétiques (ne comportant pas tous les descendants d'un même ancêtre — exemple : les descendants d'ancêtres vermiformes ne sont pas tous aujourd'hui des vers, etc.).
- En jaune : les principales explosions radiatives.
Explosion radiative des vers
La formule « bilatérien » est un type d'organisation polyvalent, qui a servi de base à des explorations fonctionnelles et à des groupes animaux majeurs :
- les mollusques développent la langue râpeuse, la radula, qui leur permet de brouter. Ils ont initialement exploré la fonction de protection qu'apportaient des plaques calcaires sur l'épiderme, même si ce n'est plus la caractéristique essentielle du groupe ;
- les arthropodes, segmentés et disposant d'une carapace de chitine, développent la marche et la préhension, rendue possible par des pattes articulées. Cette formule a été un succès immédiat, conduisant à l'explosion radiative des arthropodes ;
- les poissons ont acquis et développé la capacité à nager en pleine eau. Plus tard; avec l'apparition des tétrapodes et la conquête de la terre ferme par les amniotes, ce groupe a subi une deuxième explosion radiative, avec, par exemple, les sauropsides et les mammifères ;
- les Échinodermes ont perdu la symétrie bilatérale d'origine dans la forme adulte et sont généralement à symétrie radiaire ;
- enfin, certains bilatériens comme les entoproctes ou les tuniciers, ont abandonné à l'âge adulte la fonctionnalité essentielle des vers, la mobilité, pour retourner à un mode de vie fixé caractéristique des éponges.
| EXPLOSION RADIATIVE DES ANIMAUX | |||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
EUKARYOTES |
se nourrissent d'organismes dont ils sont dissociés | ||||||||||||||||
|
├─o Éponges |
hydres, méduses symétrie bilatérale | ||||||||||||||||
| PROTOSTOMIENS | DEUTÉROSTOMIENS | ||||||||||||||||
| LOPHOTROCHOZOAIRES : | notochorde | ||||||||||||||||
| vers plats vers à anneaux | |||||||||||||||||
| crâne squelette mâchoires squel. osseux émail | |||||||||||||||||
| double coquille reptation crâne, bec corné | |||||||||||||||||
| ECDYSOZOAIRES : | mues cuticulaires |
|
pattes et doigts sac amniotique | ||||||||||||||
| carapace externe | |||||||||||||||||
| chélicères |
|||||||||||||||||
| lézards, serpents | |||||||||||||||||
| araignées, scorpions | |||||||||||||||||
| mandibules | |||||||||||||||||
| OISEAUX | adaptation au vol | ||||||||||||||||
| crabes, langoustes | |||||||||||||||||
| 6 pattes, larves |
gl. sudoripares, néocortex | ||||||||||||||||
Liste des infra-règnes
Selon ITIS (31 janvier 2014)[36] :
- infra-règne Deuterostomia
- infra-règne Protostomia
Selon Paleobiology Database (31 janvier 2014)[37] :
- Acoelomorpha
- Eubilateria
- genre Vetustovermis
Groupes subordonnés
Références taxinomiques
- (en) Référence Animal Diversity Web : Bilateria
- (fr+en) Référence ITIS : Bilateria
- (en) Référence Tree of Life Web Project : Bilateria
- (en) Référence Paleobiology Database : clade Bilateria
- (en) Référence NCBI : Bilateria (taxons inclus)
Notes et références
- Guillaume Guillaume et Hervé Le Guyader, Classification phylogénétique du vivant. Tome 2, Paris, Belin, 831 p. (ISBN 978-2-410-00385-7 et 2410003850, OCLC 987914329)
- (en) Pablo Vargas et Rafael Zardoya, The Tree of Life, Sinauer Associates is an imprint of Oxford University Press, , 713 p. (ISBN 978-1-60535-229-9), Chapitre Bilateria
- (en) Richard C. Brusca, Wendy Moore et Stephen M. Shuster, Invertebrates, 3rd edition, Sunderland (Mass.), Sinauer Associates is an imprint of Oxford University Press, , 1104 p. (ISBN 978-1-60535-375-3)
- Jean Chaline, Didier Marchand, Les merveilles de l'évolution, éditions Universitaires de Dijon, , p. 38.
- Marie-Hélène Canu, Vincent Bérézowski, Patrick Duriez, Cécile Langlet, Pascal Mariot, Olivier Pétrault, Physiologie humaine, Dunod, (lire en ligne), p. 58.
- (en) Loren E. Babcock, « Asymmetry in the fossil record », European Review, vol. 13, no (Supplement S2), , p. 135-143 (DOI 10.1017/S1062798705000712)
- Michaël Manuel, « Early evolution of symmetry and polarity in metazoan body plans », Comptes Rendus Biologies, vol. 332, nos 2-3, , p. 184–209 (ISSN 1631-0691, DOI 10.1016/j.crvi.2008.07.009, lire en ligne, consulté le )
- Bernard Le garff, Dictionnaire étymologique de zoologie : comprendre facilement tous les noms scientifiques, Delachaux, , 205 p. (ISBN 978-2-603-01099-0)
- (en) Johanna Taylor Cannon, Bruno Cossermelli Vellutini, Julian Smith et Fredrik Ronquist, « Xenacoelomorpha is the sister group to Nephrozoa », Nature, vol. 530, no 7588, , p. 89–93 (ISSN 0028-0836 et 1476-4687, DOI 10.1038/nature16520, lire en ligne, consulté le )
- (en) Hervé Philippe, Henner Brinkmann, Richard R. Copley et Leonid L. Moroz, « Acoelomorph flatworms are deuterostomes related to Xenoturbella », Nature, vol. 470, no 7333, , p. 255–258 (ISSN 0028-0836 et 1476-4687, PMID 21307940, PMCID PMC4025995, DOI 10.1038/nature09676, lire en ligne, consulté le )
- (en) José M. Martín-Durán, Ralf Janssen, Sofia Wennberg et Graham E. Budd, « Deuterostomic Development in the Protostome Priapulus caudatus », Current Biology, vol. 22, no 22, , p. 2161–2166 (ISSN 0960-9822, DOI 10.1016/j.cub.2012.09.037, lire en ligne, consulté le )
- (en) José M. Martín-Durán, Yale J. Passamaneck, Mark Q. Martindale et Andreas Hejnol, « The developmental basis for the recurrent evolution of deuterostomy and protostomy », Nature Ecology and Evolution, vol. 1, no 1, , p. 0005 (ISSN 2397-334X, DOI 10.1038/s41559-016-0005, lire en ligne, consulté le )
- (en) Tracey I. Smart et George Von Dassow, « Unusual Development of the Mitraria Larva in the Polychaete Owenia collaris », The Biological Bulletin, vol. 217, no 3, , p. 253–268 (ISSN 0006-3185 et 1939-8697, DOI 10.1086/bblv217n3p253, lire en ligne, consulté le )
- (en) Victoria A. Petryshyn, David J. Bottjer, Jun-Yuan Chen et Feng Gao, « Petrographic analysis of new specimens of the putative microfossil Vernanimalcula guizhouena (Doushantuo Formation, South China) », Precambrian Research, vol. 225, , p. 58–66 (DOI 10.1016/j.precamres.2011.08.003).
- Ferdinand Marlétaz, Katja T. C. A. Peijnenburg, Taichiro Goto, Noriyuki Satoh et Daniel S. Rokhsar, « A new spiralian phylogeny places the enigmatic arrow worms among gnathiferans », Current Biology, vol. 29, no 2, , p. 312–318.e3 (DOI 10.1016/j.cub.2018.11.042, lire en ligne)
- Hiroshi Yamasaki, Shinta Fujimoto et Katsumi Miyazaki, « Phylogenetic position of Loricifera inferred from nearly complete 18S and 28S rRNA gene sequences », Zoological Letters, vol. 1, , p. 18 (PMCID 4657359, DOI 10.1186/s40851-015-0017-0, lire en ligne)
- Hervé Philippe et al. Mitigating Anticipated Effects of Systematic Errors Supports Sister-Group Relationship between Xenacoelomorpha and Ambulacraria. Science Direct (2019).
- Schmidt-Rhaesa, Andreas., The evolution of organ systems, Oxford University Press, (ISBN 978-0-19-856669-4, 0198566697 et 9780198566687, OCLC 137312929)
- (en) V. V. Malakhov, « New ideas on the origin of bilateral animals », Russian Journal of Marine Biology, vol. 30, no S1, , S22–S33 (ISSN 1063-0740 et 1608-3377, DOI 10.1007/s11179-005-0019-4, lire en ligne, consulté le )
- (en) Andreas Hejnol et Christopher J. Lowe, « Embracing the comparative approach: how robust phylogenies and broader developmental sampling impacts the understanding of nervous system evolution », Phil. Trans. R. Soc. B, vol. 370, no 1684, , p. 20150045 (ISSN 0962-8436 et 1471-2970, PMID 26554039, PMCID PMC4650123, DOI 10.1098/rstb.2015.0045, lire en ligne, consulté le )
- (en) Detlev Arendt, Alexandru S. Denes, Gáspár Jékely et Kristin Tessmar-Raible, « The evolution of nervous system centralization », Philosophical Transactions of the Royal Society of London B: Biological Sciences, vol. 363, no 1496, , p. 1523–1528 (ISSN 0962-8436 et 1471-2970, PMID 18192182, DOI 10.1098/rstb.2007.2242, lire en ligne, consulté le )
- E. M. De Robertis, « The molecular ancestry of segmentation mechanisms », Proceedings of the National Academy of Sciences, vol. 105, no 43, , p. 16411–16412 (PMID 18948592, PMCID PMC2575432, DOI 10.1073/pnas.0808774105, lire en ligne, consulté le )
- (en) Guillaume Balavoine et André Adoutte, « The Segmented Urbilateria: A Testable Scenario », Integrative and Comparative Biology, vol. 43, no 1, , p. 137–147 (ISSN 1540-7063, DOI 10.1093/icb/43.1.137, lire en ligne, consulté le )
- (en) Andreas Hejnol et Mark Q. Martindale, « Acoel development supports a simple planula-like urbilaterian », Philosophical Transactions of the Royal Society of London B: Biological Sciences, vol. 363, no 1496, , p. 1493–1501 (ISSN 0962-8436 et 1471-2970, PMID 18192185, PMCID PMC2614228, DOI 10.1098/rstb.2007.2239, lire en ligne, consulté le )
- Jakob Vinther, « Animal Evolution: When Small Worms Cast Long Phylogenetic Shadows », Current Biology, vol. 25, no 17, , R762–R764 (ISSN 0960-9822, DOI 10.1016/j.cub.2015.07.003, lire en ligne, consulté le )
- (en) Gerhard Haszprunar, « Review of data for a morphological look on Xenacoelomorpha (Bilateria incertae sedis) », Organisms Diversity & Evolution, vol. 16, no 2, , p. 363–389 (ISSN 1439-6092 et 1618-1077, DOI 10.1007/s13127-015-0249-z, lire en ligne, consulté le )
- Andreas Hejnol et Kevin Pang, « Xenacoelomorpha's significance for understanding bilaterian evolution », Current Opinion in Genetics & Development, vol. 39, , p. 48–54 (ISSN 0959-437X, DOI 10.1016/j.gde.2016.05.019, lire en ligne, consulté le )
- John R. Finnerty, « The origins of axial patterning in the metazoa: how old is bilateral symmetry? », The International Journal of Developmental Biology, vol. 47, nos 7-8, , p. 523–529 (ISSN 0214-6282, PMID 14756328, lire en ligne, consulté le )
- Manuel Michaël, « Évolution animale : les péripéties de la phylogénie », sur Encyclopædia Universalis, (consulté le )
- Fedonkin, M. A. et Waggoner, B. M., « The Late Precambrian fossil Kimberella is a mollusc-like bilaterian organism », Nature, vol. 388, no 6645, , p. 868–871 (DOI 10.1038/42242, Bibcode 1997Natur.388..868F)
- (en) Scott D. Evans, Ian V. Hughes, James G. Gehling et Mary L. Droser, « Discovery of the oldest bilaterian from the Ediacaran of South Australia », Proceedings of the National Academy of Sciences, vol. 117, no 14, , p. 7845–7850 (ISSN 0027-8424 et 1091-6490, PMID 32205432, DOI 10.1073/pnas.2001045117, lire en ligne, consulté le )
- « Bilaterian – Oldest Specimen Found in the Ediacaran of South Australia », sur austhrutime.com (consulté le )
- Bengtson, S. et Budd, G., « Comment on 'small bilaterian fossils from 40 to 55 million years before the Cambrian'. », Science, vol. 306, no 5700, , p. 1291a (PMID 15550644, DOI 10.1126/science.1101338)
- Bengtson, S., Donoghue, P. C. J., Cunningham, J. A. et Yin, C., « A merciful death for the 'earliest bilaterian,' Vernanimalcula », Evolution & Development, vol. 14, no 5, , p. 421–427 (PMID 22947315, DOI 10.1111/j.1525-142X.2012.00562.x, lire en ligne)
- E. Pecoits, K. O. Konhauser, N. R. Aubet, L. M. Heaman, G. Veroslavsky, R. A. Stern et M. K. Gingras, « Bilaterian burrows and grazing behavior at >585 million years ago », Science, vol. 336, no 6089, , p. 1693–1696 (PMID 22745427, DOI 10.1126/science.1216295, Bibcode 2012Sci...336.1693P, S2CID 27970523)
- Integrated Taxonomic Information System (ITIS), www.itis.gov, CC0 https://doi.org/10.5066/F7KH0KBK, consulté le 31 janvier 2014
- Fossilworks Paleobiology Database, consulté le 31 janvier 2014
Voir aussi
Bibliographie
- Daniel Richard (dir.), Biologie, Dunod, (lire en ligne), p. 98-103