Ctenophora
Les cténophores (Ctenophora, du grec ktenos, « peigne » et phorein, « porter », référence à la structure en peigne de leurs rangées de cils) ou cténaires sont des organismes marins carnivores transparents et à symétrie rotationnelle. Ils sont planctoniques et pélagiques (plus rarement benthiques) et représentés par près de 150 espèces, répandues dans tous les océans du monde. Ils se déplacent grâce à des cils locomoteurs alignés en 8 rangées sur des plaques ciliées et formant des peignes. Ils constituent une bonne part de la biomasse planctonique mondiale.

Classes de rang inférieur
Leur ressemblance superficielle avec les méduses les a fait autrefois classer auprès de ces dernières dans le groupe des cœlentérés, classification aujourd'hui tombée en désuétude. Contrairement aux méduses, les Ctenophora ne possèdent pas de cnidocytes (cellules urticantes), mais des colloblastes (cellules collantes) ; ils sont de plus hermaphrodites.
Les cténaires les plus connus du public sont la groseille de mer (Pleurobrachia pileus) et la ceinture de Vénus (Cestum veneris). Certaines espèces de ces pseudo-méduses, comme la groseille de mer, peuvent atteindre des populations si denses et importantes qu'elles peuvent colmater les filets des pêcheurs voire les prises d'eau de centrales nucléaires (ex : centrale nucléaire de Gravelines)[2] ; d'autres ne sont connues que par quelques spécimens.
Morphologie
Aspect général
Les cténophores ont une forme ovoïde, rubanée, en poire ou en cloche. Translucides et gélatineux, ils ont le plus souvent 8 rangées de cils vibratiles soudés à la base, formant des peignes locomoteurs, et la plupart portent 2 grands tentacules.
Les cténophores sont extrêmement fragiles, donc très difficiles à prélever et à étudier.
Les espèces les plus communes ne font souvent que quelques centimètres de long. Exceptionnellement, l'espèce Cestum veneris peut atteindre 1,5 m.
Coloration
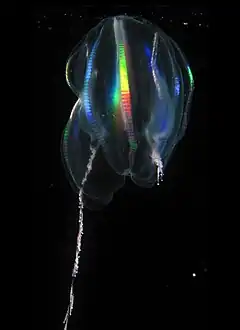
Les cténophores sont généralement translucides et incolores, mais certaines espèces peuvent être rouges, orange voire noires. Les rangées de peignes locomoteurs (cténidies) sont de plus souvent iridescentes, par diffraction de la lumière.
Les espèces d'eau profonde, comme la « Red tortuga » (qui ne possède pas actuellement de nom scientifique), peuvent apparaître vivement colorées grâce à des pigments qui absorbent certaines longueurs d'onde de la lumière visible (les radiations bleues). Elles apparaissent donc rouge sombre dans la mer.
De nombreuses espèces de Ctenophora sont par ailleurs capables d'émettre de la lumière par bioluminescence. Une espèce en particulier, Eurhamphaea vexilligera, peut produire une sorte d'encre rouge qui émet une lueur bleue dans l'obscurité, peut-être pour dissuader les prédateurs.
Anatomie
Symétrie et organisation interne
Les Ctenophora ont une symétrie intéressante, nommée symétrie biradiaire, mais ils présentent quelques structures asymétriques, comme les pores anaux, le statocyste ou parfois les rangées de peignes natatoires. À cette symétrie s'ajoute une symétrie bilatérale chez les Tentaculata.
Leur organisation est diploblastique (ils ne possèdent que deux feuillets embryonnaires transparents).
Le feuillet externe, ou ectoderme, donne naissance à l'épiderme externe, constitué de deux couches de cellules, en grande partie recouvert par une couche protectrice de substance visqueuse sécrétée par des cellules glandulaires. L'endoderme (épiderme interne) entoure une cavité qui sert d'estomac, reliée à l'extérieur et à l'ouverture de la bouche par un œsophage long et étroit. Les proies capturées sont prédigérées dans l'œsophage par de puissantes enzymes, puis leur hydrolyse s'achève dans l'estomac.
Les cténophores ne possèdent pas de système circulatoire très différencié, ni d'organe respiratoire.
Les échanges gazeux et l'excrétion de certains déchets du métabolisme comme l'ammoniaque se réalisent au niveau de la surface entière de l'organisme par simple diffusion.
Système digestif
On a longtemps cru qu'il n'existait pas de véritable « sortie » de l'estomac, hormis deux pores anaux que l'on a jusqu'en 2016 supposé à tort peu utilisés pour l'excrétion des déchets indigestibles que l'on pensait depuis plus de 100 ans essentiellement rejetés par la bouche[3].
Récemment (2016) des vidéos ont montré de manière fine la digestion de poissons ou crevettes chez deux espèces marines gélatineuses de pleine eau (Mnemiopsis leidyi et Pleurobrachia bachei). Ces deux cténophores (ou « cténaires ») appartiennent à une lignée très ancienne d’animaux (apparus bien avant l'apparition supposée de l'anus) et n'étaient pas eux-mêmes considérés comme dotés d'un anus. Ces vidéos ont été présentées aux spécialistes de ces espèces le 15 mars 2016 à St. Augustine (Floride) lors d’une rencontre scientifique internationale consacrée aux cténophores (rencontre dénommée Ctenopolooza[4]). William Browne, biologiste évolutionniste de l'Université de Miami et auteur de ces vidéos, a montré que les Cténophores défèquent en réalité non pas par leur bouche comme on le croyait, mais par des pores fermés par un sphincter, comparable à ceux de l'anus chez d’autres espèces[3].
Des évacuations de matières peut-être digestives et métaboliques par ces pores avaient déjà été observées dans le passé chez des cténophores : Carl Chun (zoologiste allemand) avait signalé en 1880 l’existence de deux petits pores situés à l’opposé de la bouche à l'arrière de l'animal ; pores par lesquels le cténophore pouvait sécréter une substance, mais il a également observé et dit que ces animaux déféquaient par leur bouche[3].
En 1997, d’autres biologistes avaient à nouveau observé et signalé des excrétions de matière « indigestes » par ces mêmes pores[3]. Les excrétions buccales existent bien, mais elles pourraient être des vomissements – peut-être induits par une nourriture inappropriée ou distribuée en trop grosse quantité en aquarium[3]. William Browne a fait consommer à ses cténophores des poissons zèbres génétiquement modifiés pour être fluorescents, ce qui permet de suivre dans le corps transparent du cténophore le trajet et la décomposition du poisson lors de sa digestion et de suivre le cheminement de certains des déchets de la digestion. Après deux à trois heures de digestion, des particules indigestes étaient bien évacuées à travers les pores de l'arrière de l’animal[3].
Selon les données phylogénétiques disponibles, les cténophores ont évolué plus tôt que les autres lignées animales considérées comme n’ayant qu’un seul orifice à la fois oral, génital et anal, tels que les anémones de mer et les méduses, et peut-être les éponges marines (quelques études suggèrent cependant que les éponges auraient pu apparaître en premier)[3].
Il est possible que les cténophores aient évolué en développant un système digestif qui leur est propre, indépendamment de tous les autres animaux, il y a des centaines de millions d'années. Il est également possible qu’un ancêtre unique des cténophores, mais aussi anémones, méduses et éponges actuelles, ait eu un ou plusieurs pores anaux puis les ait perdus au cours de l’évolution (Matsumoto[5] suggère qu’une anémone ou une éponge collées à un rocher ou à un autre substrat (algue par exemple) ont tout intérêt à éjecter leurs excréments dans le milieu ambiant plutôt qu’à l’accumuler sous leur organisme[3]. Browne explore actuellement cette dernière hypothèse en recherchant si les cténophores activent, lors du développement de leurs pores, des gènes proches de ceux que d'autres animaux activent lors de la formation de l’anus[3].
Les cils vibratiles situés dans les canaux du système digestif pourraient servir à pomper l'eau vers l'intérieur ou l'extérieur de la mésoglée, pour ajuster la pression osmotique interne, par exemple lorsque le cténophore passe d'un milieu strictement marin à de l'eau saumâtre côtière.
Mésoglée
L'espace situé entre les épidermes externe et interne est occupé par la mésoglée, une couche gélatineuse visqueuse et transparente formée de collagène et de tissu conjonctif. L'important réseau de protéine structurale est maintenu par des cellules particulières ressemblant à des amibes (amibocytes). La mésoglée est parcourue par de petits canaux utilisés pour le transport et le stockage des nutriments. La position de ces canaux varie en fonction des espèces, mais ils se trouvent principalement en dessous des tissus qu'ils desservent.
La mésoglée pourrait aussi jouer un rôle dans la flottabilité de ces animaux.
Elle est aussi parcourue par un réseau simple de cellules nerveuses (neurones), sans centre nerveux différencié. Ces neurones sont concentrés autour de la bouche, des tentacules (quand ils existent), des cténidies (rangées de peignes locomoteurs) et du statocyste. Ils sont reliés aux cellules musculaires de la mésoglée et avec la couche de cellules la plus interne de l'épiderme externe. Cette organisation complexe de la mésoglée lui confère, selon certains auteurs, le statut de mésenchyme.
Statocyste et peignes locomoteurs
Il s'agit d'un système spécialisé servant aux cténophores d'organe d'équilibration et qui contrôle aussi leurs mouvements. Il se trouve à l'extrémité opposée de celle de l'ouverture de la bouche. Il est constitué d'un ensemble formé d'une centaine de cellules calcifiées appelées statolithes, reposant en équilibre sur leurs flagelles sinueux et répartis en quatre groupes horizontaux. Lorsque les conditions extérieures poussent le cténophore à changer de position, le statolithe exerce davantage de pression sur un des quatre groupes de flagelles et moins sur les trois autres. Cette information sensorielle est transmise à l'ectoderme via le réseau de neurones. Le cténophore ajustera donc l'activité de ses rangées de peignes locomoteurs en réponse à cette stimulation.
Ces peignes sont généralement disposés en 8 rangées allongées dans le sens longitudinal, appelées cténidies. Chaque peigne est formé d'une rangée de plusieurs centaines de cils vibratiles, fusionnés à la base, formant ainsi une sorte de palette natatoire de 2 à 5 mm de long. En soulevant ces peignes successivement, le cténophore les utilise comme des rames qui, quand les huit cténidies sont convenablement synchronisées, lui permettent de se propulser dans l'eau. Chacun des quatre groupes de cellules flagellées du statocyte contrôle un quart de l'animal, soit 2 rangées de peignes. Le rythme de battement et la synchronisation des peignes se propage automatiquement, de façon mécanique, sans intervention des cellules nerveuses. La position dans l'espace du cténophore (géotaxis) provoque l'action de la gravité sur le statocyste, augmentant ou diminuant la fréquence des battements. Le cténophore peut aussi modifier le rythme de battements des rangées de peignes pour nager vers le haut ou le bas de la colonne d'eau. La position dans l'espace est déterminée par le cténophore grâce au statocyste et au réseau nerveux, mais aussi grâce à la détermination de la quantité de lumière ambiante.
Tentacules

De nombreuses espèces de cténophores possèdent deux tentacules implantés vers le milieu du corps, opposés par rapport à l'axe de symétrie. Ils sont utilisés pour capturer les proies ; chaque tentacule peut se rétracter entièrement par enroulement dans une poche située à sa base, la gaine tentaculaire. Ils ont une croissance continue par la base, qui compense l'usure de l'extrémité. Ces tentacules portent des ramifications appelées tentilles qui, contrairement aux tentacules des Cnidaires, ne contiennent pas de cellules urticantes (cnidocytes), mais des cellules collantes (colloblastes). Ces cellules se déploient brutalement quand une proie entre en contact avec un tentacule : le filament cytoplasmique en spirale qui constitue leur base se détend alors, projetant la partie apicale collante de la cellule vers la proie, qui sera alors capturée. Contrairement aux cnidocytes, les colloblastes ne sont pas détruits après usage : grâce à l'élasticité du filament cytoplasmique, ils peuvent, une fois débarrassés de la proie, reprendre leur position initiale[6].
Biologie et comportement
Locomotion
De nombreux cténophores se laissent simplement porter par les courants. Ils peuvent cependant nager, parfois assez rapidement, grâce aux battements de leurs peignes locomoteurs. Ce sont les plus gros animaux qui se déplacent à l'aide de cils vibratiles. Ils peuvent atteindre une vitesse de 5 cm/s. Les battements coordonnés des peignes confèrent à cet animal une nage sans à-coups, ce qui pourrait être un avantage au niveau de l'évolution, car cette nage ne génère pas de vibrations susceptibles d'alerter les proies ou les prédateurs.
Certaines espèces nagent grâce aux battements de leurs lobes oraux lorsqu'ils fuient, d'autres se déplacent grâce à des ondulations de leur corps, voire rampent comme des vers plats.
Mode d'alimentation

Les Ctenophora sont des animaux prédateurs qui utilisent leurs tentacules pour capturer leurs proies (plancton, larves d'animaux marins, vers marins, crustacés (comme les copépodes), cnidaires, autres Ctenophora, et parfois petits poissons. Quand leurs tentacules ont capturé une proie, ils sont rétractés vers la bouche et débarrassés de la proie. La nourriture est alors ingérée. La progression vers l'estomac se fait soit à l'aide de mucus, soit par l'action de cils vibratiles internes, situés dans le système digestif.
Les cténophores ne possèdent pas tous des tentacules. Certains, comme le Beroe, ingèrent directement des proies gélatineuses. D'autres utilisent les lobes musculeux qui entourent leur bouche pour capturer les proies.
Cas particuliers
Les espèces du genre Haeckelia se nourrissent presque exclusivement de cnidaires, mais ne digèrent pas leurs cnidocystes. Ces derniers seront réutilisés par incorporation au niveau de l'épiderme de leurs propres tentacules (kleptocnides). Ce « vol » a pendant longtemps désarçonné les zoologistes, qui présumèrent à tort que certains cténophores pouvaient eux aussi produire des cnidocytes.
Le parasitisme n'a été observé que dans un seul genre, Lampea, qui parasite les salpes quand il est trop petit pour les ingérer en entier.
Reproduction

À l'exception de quelques espèces de l'ordre des Platyctenida, chez qui la reproduction est parfois asexuée, la reproduction est sexuée.
Presque tous les cténophores sont hermaphrodites, possédant à la fois les organes reproducteurs mâle et femelle, situés directement en dessous des cténidies, à proximité des canaux de la mésoglée. Cependant, le genre Ocyropsis, de l'ordre des Lobata, présente des sexes séparés.
À maturité, les produits sexuels sont émis dans la mer par de petites ouvertures dans l'ectoderme nommées « gonopores ». Le déclenchement de l'émission des gamètes est stimulé par certaines conditions lumineuses. La fécondation est donc externe ; l'autofécondation est rare. L'espèce Tjalfiella tristoma, de l'ordre des Platyctenida, est cependant vivipare : les larves se développent dans une cavité de l'organisme parental.
Il existe aussi chez certains cténophores un phénomène très particulier dit de dissogonie : il y a deux phases de maturité sexuelle, une chez la forme larvaire et une autre chez la forme adulte. On retrouve ce phénomène notamment chez les lobés[7] et les Platyctenida [8]. Ceci pose bien sûr le problème de la néoténie : certaines formes de cténaires pourraient être des formes juvéniles portant des gamètes dont on n'a pas encore trouvé la forme définitive [9].
Certaines espèces de cténophores, comme Beroe ovata, ont une méthode particulière pour éviter la polyspermie. Lors de la fécondation, plusieurs spermatozoïdes ont pénétré l'ovule. Le pronucleus femelle se met alors à migrer dans le cytoplasme de l'ovule, et choisit le pronucleus mâle avec lequel il fusionnera, les autres seront rejetés. Le principal critère de sélection semble être l'absence de consanguinité.
Après fécondation, la cellule-œuf commence à se diviser. La segmentation de la cellule-œuf est totale, inégale et à détermination précoce. Dès la deuxième division de la cellule-œuf (stade 4 cellules), on voit apparaître la symétrie radiaire. L'embryon se développe alors en une larve cydippide nageuse. Les cydippides sont très semblables entre eux, même quand ils appartiennent à d'autres espèces de cténophores. Certains auteurs critiquent l'appellation de « larve », car parfois, le cydippide ressemble fortement à l'adulte. Dans certains ordres par exemple, comme les Lobata et les Platyctenida, la larve cydippide et l'adulte ne sont pas différents morphologiquement, de sorte que l'appellation "larve" est dans ce cas guère appropriée.
La larve subira une métamorphose plus ou moins importante selon les espèces, parfois inexistante, pour passer à l'état adulte. Les cténophores sont monomorphes : ils ne présentent jamais de stade fixé.
L'extrême fragilité de leur constitution rend la recherche sur leur mode de vie très difficile ; c'est pourquoi il n'y a pas de données sur leur durée de vie. Mais il est connu que les cténophores commencent à se reproduire à un âge précoce, et on peut ainsi supposer qu'ils ont un cycle de génération court.
Régénération
Les cténophores ont d'extraordinaires capacités de régénération ; même si la moitié de l'organisme est détruit, la partie restante peut reformer un individu complet. Certains organes, comme le statocyste, peuvent se régénérer même s'ils sont entièrement détruits.
Répartition et habitat
Habitat
_2.jpg.webp)
Tous les cténophores sont marins, il n'y a pas d'espèces d'eau douce. Ils vivent à des profondeurs variant de la surface de la mer jusqu'à -4 000 m.
Certaines espèces peuvent passer sans dommage des eaux océaniques aux eaux saumâtres des estuaires.
Les espèces les mieux connues vivent au milieu du plancton dans les couches océaniques situées près de la surface. Cependant, comme ils sont majoritairement transparents, extrêmement fragiles et ne dépassent que rarement quelques centimètres en longueur, ils sont généralement inconnus du grand public. Les promeneurs peuvent éventuellement rencontrer des espèces du genre Pleurobrachia (groseilles de mer) échouées sur la plage. Les genres Bolinopsis, Mnemiopsis et Beroe peuvent aussi être rencontrés assez fréquemment.
Environ 35 espèces de cténophores sont benthiques et vivent sur le fond marin. Ces espèces font partie de l'ordre des Platyctenida, appelé ainsi car ses membres ont une forme aplatie qui les fait davantage ressembler à des limaces de mer ou à des vers plats.
Répartition
En tant que membre du plancton, les cténophores sont sujets à de grands déplacements au gré des courants marins, même si certaines espèces sont inféodées à un habitat particulier. On peut les trouver dans toutes les mers et océans du globe. Ils sont particulièrement abondants sous les tropiques et aux deux pôles.
Le cténophore Mertensia ovum est un des membres prédominants du plancton des eaux arctiques.
Espèces invasives
Bien que les cténophores soient généralement discrets et que leur influence sur un écosystème soit de toute évidence assez faible, ils peuvent tout de même provoquer des dommages quand ils apparaissent dans des eaux dont ils ne sont pas natifs.
L'espèce Mnemiopsis leidyi est originaire de l'ouest de l'Atlantique, entre Cape Cod, États-Unis (41° N, 70° W) au nord et la Péninsule de Valdez, Argentine (43° S, 64° W) au sud. Elle fut accidentellement importée en mer Noire dans les années 1980, transportée dans l'eau contenue dans des ballasts de navires[10]. Sur place, l'espèce s'est rapidement répandue. En dix ans, l'industrie de pêche à l'anchois en mer Noire a subi une forte récession, car le cténophore nouvellement introduit se nourrit du même plancton que la larve d'anchois, qui s'est ainsi retrouvée affamée par cette concurrence. La biomasse de cténophores en mer Noire a atteint jusqu'à un million de tonnes.
Depuis la similaire soudaine apparition, en 1997, d'un autre cténophore étranger en mer Noire, Beroe ovata (qui se nourrit de Mnemiopsis leidyi), l'équilibre fut en quelque sorte rétabli ; mais la mer Noire est dorénavant occupée par deux espèces allochtones. Le même scénario, avec les mêmes espèces, est en train de se dérouler en mer Caspienne depuis les années 1998-1999, et Mnemiopsis leidyi a été signalée en mer du Nord en 2006. On estime donc que le même scénario est à redouter en mer Baltique, où les scientifiques finlandais ont découvert que Mnemiopsis leidyi avait survécu à l'hiver et se multipliait rapidement : une expédition récente (2007) a mesuré 600 cténophores par mètre cube dans la mer Baltique[11]
Prédateurs et parasites
Plusieurs animaux sont des prédateurs des cténophores. On trouve parmi eux des cnidaires, des tortues marines, divers poissons (comme le saumon, le maquereau et le lump), des oiseaux de mer, et même les autres espèces de cténophores.
Les cténophores sont souvent infestés de crustacés parasites du groupe des amphipodes.
Histoire de la taxinomie et de la phylogénie des cténophores
Fossiles de cténophores
Le corps mou des cténophores rend très improbable la fossilisation, de sorte que la phylogénie des cténophores fossiles est très peu documentée.
Parmi les fossiles appartenant de façon indéniable au groupe des cténophores, on peut citer Archaeocydippida hunsrueckiana et Paleoctenophora brasseli, datant du Dévonien ; ces fossiles, conservés dans le schiste à grain très fin de Hunsrück, présentent de nombreux détails permettant une identification.
Il y a par contre des discussions en ce qui concerne l'espèce Maotianoascus octonarius, pour savoir si ce fossile de la faune de Chengjiang (datant du Cambrien inférieur) est un cténophore ou non. Dans la faune de Burgess, datant du Cambrien, on trouve trois espèces qui appartiennent sans doute au groupe des cténophores : Ctenorhabdotus capulus (qui possédait 24 rangées de peignes), Fasciculus vesanus et Xanioascus canadensis.
Les fouilles, rapportées par la revue Science en 2019[12] puis par le magazine La Recherche[13], d'une équipe de paléontologues chinois et américains sur le site de Qingjiang (situé à 1 000 km de Chengjiang, sur la berge de la rivière Danshui, dans la province de Hubei en Chine), ont révélé de nombreux fossiles particulièrement bien conservés d'organismes à corps mous datant de l'"explosion du Cambrien", il y a 530 millions d'années ; la moitié d'entre eux n'avaient jamais été observés jusqu'alors. Ce site est daté plus précisément de 518 millions d'années, comme celui de Chengjiang (Yunnan), soit 10 millions d'années de plus que celui des Schistes de Burgess dans les Rocheuses canadiennes en Colombie Britannique. Parmi ces fossiles d'organismes à corps mous, on a recensé des spécimens de cnidaires (méduses, coraux, anémones de mer), mais aussi de nombreux cténophores qui sont bien plus rares sur les autres sites. À leur propos, William Rowe-Pirra, de La Recherche, rappelle :
« La position de ces derniers [les cténophores] dans l'arbre évolutif du vivant est encore largement discutée au sein de la communauté des chercheurs [voir sections suivantes]. En effet, certains suggèrent que les cténophores constituent le groupe d'animaux le plus basal —c'est-à-dire le groupe frère de tous les autres (le plus ancien)— une place généralement attribuée aux éponges[13]. »
Il conclut :
« Les précieuses informations apportées par ces nouveaux fossiles devraient permettre d'éclairer ce débat, que même les données moléculaires n'ont pas permis de clore[13]. »
[Voir les éléments de ce débat taxinomique dans les sections suivantes].
Première classification
Les marins avaient observé des cténophores depuis fort longtemps, mais la première observation consignée par écrit, réalisée par un médecin de bord, ne date que de 1671. Le taxonomiste suédois Carl von Linné classa les cténophores avec les autres invertébrés « primitifs » (tels que les spongiaires ou les cnidaires) sous le nom de zoophytes (« animal-plante »), faisant ainsi allusion à leur mode de vie passif, en apparence « végétatif ». Le zoologiste français Georges Cuvier soutint cette classification. Ce n'est qu'au XIXe siècle que les cténophores furent reconnus comme un taxon à part entière.
Place du taxon dans la systématique
La position des cténophores au sein des métazoaires est disputée entre les cinq lignées pluricellulaires présentes il y a plus de 600 millions d'années : les Ctenophora, Porifera, Placozoa, Bilateria et Cnidaria, auxquelles appartiennent tous les animaux actuels.
La classification classique des cténophores plaçait ce groupe dans les Cœlentérés (Coelenterata), au côté des cnidaires :
Classification classique
- Eumetazoa
- Coelenterata
- Cnidaria
- Ctenophora
- Bilateria
- Coelenterata
Cette classification a été détrônée par les apports de la cladistique, méthode actuellement utilisée pour reformer la classification des espèces, apports qui montrent que les cténophores sont plus proches des Bilateria (animaux à symétrie bilatérale) que des cnidaires (Cnidaria). Le critère retenu pour étayer ce rapprochement est l'existence de tentacules symétriques par rapport à un plan, ce qui complique leur symétrie biradiée d'une symétrie bilatérale. Autre argument, la forme des spermatozoïdes de cténophores, qui ne possèdent qu'un seul grand acrosome, est plus proche de celle des spermatozoïdes des Bilateria. De plus, les cténophores possèdent un vrai tissu musculaire.
Les cténophores diffèrent donc des cnidaires sur ces trois points (les cnidaires ne possèdent ni véritable tissu musculaire, ni ébauche de symétrie bilatérale, et leurs spermatozoïdes possèdent plusieurs vésicules acrosomales).
Pour ces raisons, une nouvelle classification a été proposée, plaçant le groupe des cténophores dans les Acrosomata[14], au côté des Bilateria :
Nouvelle classification
- Eumetazoa
- Cnidaria
- Acrosomata
- Ctenophora
- Bilateria
Cette approche présupposait que les cténophores étaient le groupe frère des bilatériens, or d'autres études[15] - [16] considèrent les cnidaires plus proches des bilatériens que les cténophores.
Il a aussi été suggéré que les cténophores pourraient avoir une parenté avec les vers plats, à cause entre autres des similarités existant entre ces derniers et les cténophores benthiques de forme aplatie de l'ordre des Platyctenida. Mais d'autres zoologistes considèrent cette ressemblance trop superficielle pour justifier une parenté.
Genomique comparées
En 2013, le génome d'un cténophore, Mnemiopsis leidyi, suggère que les cténophores seraient le groupe frère du reste des autres animaux. Jusqu'alors, c'était les éponges qui étaient supposées occuper cette place car, contrairement aux cténophores, elles ne possèdent ni neurones ni cellules musculaires. Ce qui suggèrerait que ces structures complexes ont évolué indépendamment chez le cténophore ou bien qu'elles qu'elles ont été perdues par les éponges au cours de l'évolution[17] - [18]. Cependant, cette hypothèse a été invalidée en 2015 par une nouvelle étude publiée dans PNAS[19].
Classification des différents ordres de Ctenophora
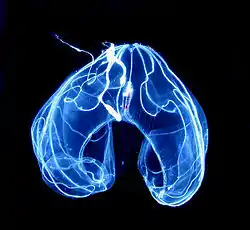
C'est un groupe encore assez mal connu qui pose un problème dans la classification phylogénétique car nous ne possédons que très peu de données et certains gènes ont un taux d'évolution lent comparé aux bilatériens.
De nos jours, une centaine d'espèces sont connues et décrites ; elles sont traditionnellement divisées en deux classes : les Tentaculata (aussi nommés "Tentaculifera") et les Nuda (aussi nommés "Atentaculata").
- Les Tentaculata sont constitués et de loin par le plus grand nombre d'espèces. Ils possèdent des tentacules, parfois vestigiaux. Cette classe est divisée en 8 ordres[20] :
- Cydippida, ordre incluant la groseille de mer (Pleurobrachia pileus)
- Platyctenida, ordre incluant le genre Ctenoplana
- Ganeshida (sans doute une forme larvaire)
- Thalassocalycida
- Lobata
- Cestida, ordre incluant la ceinture de Vénus (Cestum veneris)
- Cryptolobiferida
- Cambojiida
- Les Nuda ne contiennent qu'un seul ordre, Beroida, auquel appartient le genre Beroe. Ils ne possèdent pas de tentacules, pas même à l'état vestigial.
Du fait de l'incertitude passée et actuelle sur la classification des cténophores, il n'est pas certain que la classification ci-dessus reflète la véritable phylogénie des cténophores. Des études moléculaires indiquent que la classe Cydipidda est un groupe paraphylétique, ce qui signifie qui n'inclut pas tous les descendants de leur ancêtre commun. La classification ci-dessus serait donc à réviser.
Le diagramme suivant montre une phylogénie des cténophores basée sur des critères morphologiques et sur des données moléculaires concernant l'ARN :
Ctenophora |--Cydippida (Mertensiidae) |-- |--Platyctenida |-- |--Cydippida (Pleurobrachidae) |-- | |--Nuda Beroida | |--Cydippida (Haeckeliidae) | |-- |--Lobata |--Cestida |--Thalassocalycida
Cette classification n'est pas confirmée. Pour le moment, la phylogénie des cténophores doit être considérée comme non établie.
Plusieurs organismes de taxinomie proposent cependant des classifications provisoires :

|
Selon World Register of Marine Species (10 avril 2015)[21] : ___
|
Selon ITIS (10 avril 2015)[1] :
|

 Aulacoctena sp. (Aulacoctenidae)
Aulacoctena sp. (Aulacoctenidae) Euplokamis sp. (Euplokamididae)
Euplokamis sp. (Euplokamididae).3.cropped.jpg.webp)


Notes et références
- Integrated Taxonomic Information System (ITIS), www.itis.gov, CC0 https://doi.org/10.5066/F7KH0KBK, consulté le 10 avril 2015
- Compte rendu de la réunion de la commission «Sécurité des populations» de la CLI de Gravelines, du 14 décembre 2007, CLI de Gravelines, évoquant Pleurobrachia pileus
- Maxmen, Amy (2016) ; “Why watching comb jellies poop has stunned evolutionary biologists” Biologie Plants & Animals ; Science mag ; 23 mars 2016, DOI: 10.1126 / science.aaf4031
- http://ctenopalooza.whitney.ufl.edu/ présentation du Ctenopalooza 2016 (14 et 15 mars) ; voir aussi About us
- George Matsumoto ; biologiste marin du « Monterey Bay Aquarium Research Institute »
- Beaumont A et Cassier P, Biologie animale, tome 1, Dunod université, Paris, 1981 (réimpr. 1991), 147-153 p. (ISBN 2-04-011432-7)
- Mayer, A. G. 1912. Ctenophores of the Atlantic coast of North America. Carnegie Institute Publications, Washington, D.C., 162.
- Komai T. 1922. Studies on two aberrant ctenophores, Coeloplana and Gastrodes. Publié par l’auteur, Kyoto.
- Madin L. P. et Harbison G. R. 1978. Thalassocalyce inconstans, new genus and species, an enigmatic ctenophore representing a new family and order. Bulletin of marine science 28(4) : 680-687
- Invasion of the Caspian Sea by the comb jelly Mnemiopsis, First international meeting, Baku (Azerbaïdjan), avril 2001
- Internytt, 2007-08-27
- N.d.A. : D. Fu et alii, Science, 363, 1338, 2019.
- William Rowe-Pirra, « Les fossiles d'étranges animaux marins révélés », mensuel La Recherche, n° 547, , p. 14
- Peter Ax, 1995, Das System der Metazoa I-III. Ein Lehrbuch der phylogenetischen Systematik, Gustav Fischer Verlag, Stuttgart/Spektrum Akademischer Verlag, Heidelberg, (ISBN 3-8274-0972-1); 1996, Multicellular animals: a new approach to the phylogenetic order in nature, Springer, (ISBN 3-540-60803-6)
- Allen G. Collins, 1998, Evaluating multiple alternative hypotheses for the origin of Bilateria: an analysis of 18S rRNA molecular evidence. Proc. Natl. Acad. Sci. USA 95:1545863
- Mónica Medina, Allen G. Collins, Jeffrey D. Silberman & Mitchell L. Sogin, Evaluating hypotheses of basal animal phylogeny using complete sequences of large and small subunit rRNA.
- Sciences et avenir n° 804, février 2014, p 16
- http://www.sciencemag.org/content/342/6164/1242592.abstract
- (en) Davide Pisani, Walker Pett, Martin Dohrmann, Roberto Feuda, Omar Rota-Stabelli, Hervé Philippe, Nicolas Lartillot, Gert Wörheide, « Genomic data do not support comb jellies as the sister group to all other animals », PNAS, (DOI 10.1073/pnas.1518127112, lire en ligne).
- Mills, C.E. Internet 1998-present. Phylum Ctenophora: list of all valid species names. Electronic internet document available at http://faculty.washington.edu/cemills/Ctenolist.html. Published by the author
- World Register of Marine Species, consulté le 10 avril 2015
Références taxonomiques
- (en) Référence World Register of Marine Species : taxon Ctenophora Eschscholtz, 1829 (+ liste classes + liste ordres)
- (fr+en) Référence ITIS : Ctenophora Eschscholtz, 1829
- (en) Référence Tree of Life Web Project : Ctenophora
- (en) Référence Animal Diversity Web : Ctenophora
- (fr) Référence Catalogue of Life : Ctenophora
- (en) Référence uBio : site déclaré ici indisponible le 7 avril 2023
- (en) Référence Fauna Europaea : Ctenophora Meigen, 1803 (consulté le )
- (en) Référence NCBI : Ctenophora (taxons inclus)
Voir aussi
Bibliographie
- Beaumont A et Cassier P, Biologie animale Tome 1, Paris, Dunod université, (réimpr. 1991), 147-153 p. (ISBN 2-04-011432-7)
- D. T. Anderson, Invertebrate Zoology, 2d ed, Oxford Univ. Press, 2001, Ch. 3, p. 54, (ISBN 0-19-551368-1)
- R. S. K. Barnes, P. Calow, P. J. W. Olive, D. W. Golding, J. I. Spicer, The invertebrates – a synthesis, 3rd ed, Blackwell, 2001, ch. 3.4.3, p. 63, (ISBN 0-632-04761-5)
- R. C. Brusca, G. J. Brusca, Invertebrates, 2d Ed, Sinauer Associates, 2003, ch. 9, p. 269, (ISBN 0-87893-097-3)
- J. Moore, An Introduction to the Invertebrates, Cambridge Univ. Press, 2001, ch. 5.4, p. 65, (ISBN 0-521-77914-6)
- E. E. Ruppert, R. S. Fox, R. P. Barnes, Invertebrate Zoology – A functional evolutionary approach, Brooks/Cole 2004, ch. 8, p. 181, (ISBN 0-03-025982-7)
- W. Schäfer, Ctenophora, Rippenquallen, in W. Westheide and R. Rieger: Spezielle Zoologie Band 1, Gustav Fischer Verlag, Stuttgart 1996
- Bruno Wenzel, Glastiere des Meeres. Rippenquallen (Acnidaria), 1958, (ISBN 3-7403-0189-9)
- Harbison, G. R. 1985. On the classification and evolution of the Ctenophora. p. 78-100 in The Origins and Relationships of Lower Invertebrates. (S. C. Morris, J. D. George, R. Gibson and H. M. Platt, eds.). Oxford University Press, Oxford.
- M. Q. Martindale, J. Q. Henry, Ctenophora, in S. F. Gilbert, A. M. Raunio, Embryology: Constructing the Organism, Sinauer, 1997, p. 87
- C.E. Mills. Internet 1998-present. Phylum Ctenophora: list of all valid species names. Web page established March 1998, last updated (see date at end of page).
- M. Podar, S. H. D. Haddock, M. L. Sogin, G. R. Harbison, A molecular phylogenetic framework for the phylum Ctenophora using 18S rRNA genes, Molecular Phylogenetics and Evolution, 21, 2001, p. 218
- T. A. Shiganova, Invasion of the Black Sea by the ctenophore Mnemiopsis leidyi and recent changes in pelagic community structure, Fisheries Oceanography, 1998, p. 305
- G. D. Stanley, W. Stürmer, The first fossil ctenophore from the lower devonian of West Germany, Nature 303, 1983, p. 518
Liens externes
- University of Washington - cténophores
- (en) « Introduction to Ctenophora », University of California Museum of Paleontology
- Ctenophores from the São Sebastião Channel, Brazil
- Video of ctenophores at the National Zoo in Washington DC
- Mills C.E. (1998). Phylum Ctenophora: list of all valid species names