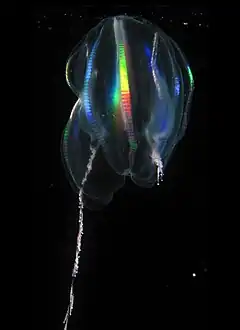
Méduse (animal)
Le terme méduse est un nom vernaculaire désignant les formes libres de nombreux groupes de cnidaires et qui s'opposent donc aux formes polypes, sessiles. En apparence, ces animaux gélatineux sont très frustes. Ils sont dépourvus de squelette, de cerveau et de poumon mais, en réalité, leur structure est complexe, et ils peuvent posséder des structures sensorielles très élaborées comme des ocelles, rassemblées au sein de rhopalies.
l'appellation « Méduse » s'applique en français à plusieurs taxons distincts.

Taxons concernés
Les méduses sont généralement des prédatrices, elles paralysent leurs proies grâce à leurs cnidocystes. Certaines appartenant à la classe des Cubozoa peuvent être mortelles pour l'Homme.
Les méduses sont par ailleurs considérées — au vu des résultats récents de phylogénie moléculaire — comme un caractère propre à l'un des deux groupes de cnidaires, appelé en conséquence Medusozoa (composé des classes : Cubozoa, Scyphozoa et Hydrozoa), l'autre groupe étant celui des Anthozoa[1]. Cependant l'origine évolutive exacte de la forme méduse est encore mal comprise, le génome de nombreuses espèces n'étant pas encore séquencé[2].
Dans le cycle de vie de certains groupes de cnidaires, la forme méduse peut alterner avec la phase polype généralement sessile et benthique, mais d'autres vivent uniquement à l'état de méduse. La forme libre est assimilée au zooplancton car si les contractions musculaires assurent la propulsion, les mouvements natatoires lents font que les méduses se laissent généralement entraîner par les courants. Les Scyphozoaires sont les vraies méduses, avec un stade polype fixé très réduit et parfois absent, qui vivent dans les eaux salées, en haute mer ou dans les régions néritiques. Les Staurozoaires, les Cubozoaires et les Hydrozoaires, caractérisés par l'alternance successive de formes polypes (asexués) et de formes méduses (sexuées), ont également des espèces essentiellement marines à l'exception de l'ordre des Hydroida qui vit en eau douce.
Il existe environ 1 500 espèces de méduses répertoriées au début du XXIe siècle, essentiellement des hydroméduses[3].
Malgré l'équivocité des émotions qu'elles suscitent, entre dégoût, effroi et fascination, une mauvaise réputation accompagne le plus souvent les méduses, en raison de leur caractère urticant et envahissant, de leur mucus gluant, et par le fait qu'elles rappellent la peur ancestrale liée aux profondeurs abyssales de l'océan[4]. Cette perception souvent négative a longtemps entravé l'évaluation des services écosystémiques rendus par ces animaux. Dans certaines régions, les perturbations du milieu peuvent également donner lieu à des pullulations parfois problématiques.
Histoire


Les méduses sont apparues sur Terre il y a environ 650 millions d'années pendant l'Édiacarien (fossiles représentés par un disque, sur lequel est fixé un rameau strié pourvu d'un axe médian) et figurent probablement parmi les premiers métazoaires[5]. Les fossiles, très rares, sont favorisés par des pullulations. Le site paléontologique de Cerin montre comment peut s'opérer la fossilisation d'un animal aussi mou : très tôt après leur mort, les méduses échouées sur une plage se retrouvent enfoncées dans le sable qui pénètre dans leur cavités internes, formant une empreinte (en creux) ou une contre-empreinte (en relief)[6]. La finesse et la mollesse du sédiment associées à son caractère anoxique permettent la conservation de l'empreinte un certain temps du fait de la lenteur de la décomposition bactérienne, et son recouvrement par les sédiments ultérieurs. De plus, les bactéries qui recouvrent les méduses peuvent les protéger en produisant du mucilage sous forme de gangue[7].

Pendant des siècles, les méduses sont largement méconnues des zoologistes qui, en raison de la simplicité de leur structure proche de certaines plantes, utilisent volontiers pour les décrire un vocabulaire emprunté au monde végétal et les incluent dans l'embranchement des zoophytes (littéralement plante-animal)[8]. Ainsi, dans sa première édition (1735) du Systema Naturae, Linné, en bon botaniste, place les méduses dans l'ordre des Zoophyta, désignant les tentacules comme les étamines des méduses (Stamina Medusarum), leurs bras oraux comme les pistils (Pistilla)[9]. Les méduses sont classées dans ce taxon jusqu'au XIXe siècle, comme le montre la collection du Règne animal de Georges Cuvier en 1817[10].
C'est Linné qui le premier en 1746[11] leur assigne le nom générique de méduse alors que ce nom mythologique avait d'abord été donné par des amateurs d'histoire naturelle à des astéries du genre Euryale[12]. Le savant suédois leur donne ce nom à cause de leurs tentacules qui s'étirent puis se rétractent comme la reptation ondulatoire des serpents couvrant la tête de Méduse, l'une des trois Gorgones de la mythologie grecque, n'utilisant le terme de « méduse » que pour un seul genre, classé parmi les vers, dans lequel il range les dix-huit espèces connues à l'époque[13]. L'analogie avec la Gorgone porte aussi sur l'habitat, le naturaliste François Péron pensant que la disparition saisonnière des méduses est liée à leur migration dans les ténèbres abyssales où se réfugient les trois Gorgones[14]. L'élève de Linné, Pehr Forsskål, décrit une vingtaine d'espèces collectées lors de son périple en Méditerranée et en mer Rouge, toutes incluses dans ce grand genre Medusa. Réaumur qui étudie une méduse bleue sur les côtes de La Rochelle l'appelle « gelée de mer » en 1710, d'où le terme anglais de jellyfish (littéralement « poisson-gelée ») pour désigner l'ensemble des méduses et l'expression gélification des océans[15]. Le zoologue Georges Cuvier crée en 1800 le deuxième genre, Rhizostoma (signifiant littéralement bouche en forme de racines), pour une méduse des côtes françaises atlantiques[16].
La Révolution française et son nouvel univers mental où dominent rationalisme et laïcité, ont contribué au développement de l'histoire naturelle, et notamment à l'essor des études sur les méduses[17]. Lamarck décrète en 1809[18] que la vie commence dans les masses gélatineuses qui dérivent dans l'océan[19]. Avec son soutien, les naturalistes François Péron et de Charles Alexandre Lesueur dénombrent jusqu'à 70 espèces différentes de méduses à la suite de l'expédition Baudin dans les Terres australes, Péron attribuant à ces spécimens des noms gravitant autour des Gorgones : ses Phorcynia et ses Cetosia sont dédiées aux parents des Gorgones ; les rayons dorés de Chrysaora rappellent l'épée d'or de Chrysaor, fils de Poséidon et de Méduse ; les six tentacules de Geryonia évoquent les six bras du géant Géryon, fils de Chrysaor[20]. La monographie ultérieure de ces deux naturalistes en 1810 décrit 122 espèces de méduses qu'ils partagent en 39 genres[21]. Dans sa monumentale monographie Das System der Medusen: erster Theil einer Monographie der Medusen (1880), Ernst Haeckel fait constamment référence aux textes de Péron et aux planches de Lesueur[22]. En 1899, Haeckel publie son célèbre Formes artistiques de la nature dont les planches de travail inspirent les maîtres de l’Art nouveau comme le sculpteur Constant Roux qui réalise le lustre-méduse[23] exécuté par la Maison Baguès en 1904 pour le Musée océanographique de Monaco[24]. À Iéna, le biologiste et philosophe allemand nomme sa maison la Villa Medusa (la), en l'honneur de ces invertébrés et décore les plafonds de sa résidence avec ces animaux[25].
Alors que la description naturaliste se révèle particulièrement difficile au XIXe siècle, en raison de la fragilité des spécimens récoltés, les expéditions scientifiques du siècle suivant continuent à découvrir de nouvelles espèces, leur recensement s'appuyant sur les publications scientifiques et la description par les chercheurs. Au XXIe siècle, les méduses continuent de livrer leurs secrets, notamment sur le fonctionnement de leurs nématocystes ou leurs cycles de vie qui restent inconnus pour la plupart[26]. L'étude de leur biologie, de l'anatomie au fonctionnement des cellules, montre que ces animaux considérés comme « primitifs » préfigurent les systèmes circulatoires des vertébrés (sens de circulation des fluides vitaux chez Aurelia), leurs yeux (concentration des organes des sens et des neurones sensitifs qui évoquent une ébauche de céphalisation) et leurs muscles (cellules musculaires striées)[27]. Les chercheurs y reconnaissent également des caractères évolués comme la segmentation du corps par strobilation, la production d'hormones pour la nidation des œufs, la symétrie bilatérale chez quelques espèces (les genres Amphinema (nl) et Solmundella n'ont que deux tentacules diamétralement opposés), et même du collagène de type humain[26].
Anatomie
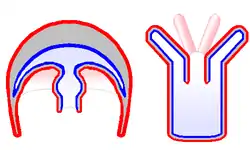
Axes, surfaces et pôles d'une méduse

Le terme « méduse » s'applique généralement au stade pélagique de nombreux groupes de cnidaires, qui pour des raisons essentiellement de convergence évolutive ont développé une forme de cloche contractile, avec une bouche en position inféro-centrale, entourée de bras servant à capturer la nourriture. La méduse n'a ni droite ni gauche, sa symétrie radiaire la distingue des animaux à symétrie bilatérale. Sur cette base, une grande complexité de formes a évolué, impliquant également le ratio entre les stades planctonique et benthique.
Caractéristiques
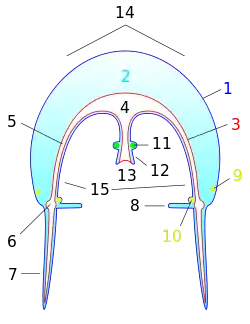
Au niveau morphologique, une méduse « classique » (scyphozoaire) est essentiellement formée d'une ombrelle en forme de cloche qui comprend une sous-ombrelle et une ex-ombrelle, de tentacules (généralement quatre ou un multiple de quatre, certaines comme la grande méduse bleue n'en ayant pas)[28], qui débouchent dans un canal circulaire qui fait le tour de l'ombrelle et d'un axe vertical, le manubrium, sorte de trompe pendant sous la cavité sous-ombrellaire et à l'extrémité duquel se trouve la cavité buccale parfois bordée d'appendices (appelés bras buccaux ou bras oraux, lisses ou frangés en chou-fleur) recueillant le plancton ou le necton[29]. La plus grande méduse connue (tentacules compris) est Cyanea capillata : son ombrelle a un diamètre de 50 cm à 2,50 m qui héberge souvent de jeunes poissons à l'abri de ses 800 fins tentacules pouvant mesurer 40 m de long[30].
Au niveau anatomique, les méduses sont des Cnidaires, animaux diploblastiques formés à partir de deux feuillets cellulaires embryonnaires seulement, l'endoderme et l'ectoderme (contrairement aux triploblastiques, qui en ont trois), séparés par une masse gélatineuse, la mésoglée. Des prolongements de l'estomac, les canaux radiaires, rayonnent dans l'ombrelle et rejoignent un canal circulaire marginal bordant l'ombrelle. Les produits de la digestion circulent en sens centrifuge dans les canaux radiaires jusqu'au canal marginal, puis le courant s'inverse pour ramener les produits de l'excrétion vers la cavité orale où ils sont expulsés sous forme de pelotes muqueuses[31].
Le poids de leur corps est généralement composé de 95 à 98 % d'eau et de 2 à 5 % de matières sèches[N 1] (contre 63 % d'eau pour le corps humain)[32], cette composition variant en fonction de l'espèce et de la salinité du milieu. Ainsi Aurelia aurita contient de 95,3 à 95,8 % d'eau en Méditerranée, 97,9 % dans la mer du Nord et 98,2 % en mer Baltique[33]. Le corps mou des méduses est constitué d'une substance gélatineuse, la mésoglée, qui contient, outre ses 98 % d'eau, du collagène (similaire au collagène humain[N 2]), des cellules totipotentes indifférenciées qui se transforment pour reconstituer un tissu lésé[34].
Leur masse gélatineuse a une densité d’eau voisine de celle de l’eau de mer, ce qui explique que la majorité des méduses se maintiennent en équilibre dans la couche d'eau superficielle de la zone littorale, bien que certaines se rencontrent à plus de 1 500 m de profondeur, telle Tiburonia granrojo, espèce abyssale de Scyphoméduse découverte en 1993 en Californie, Deepstaria enigmatica à 1 500 m, Deepstaria enigmatica à 7 000 m[35].
La grande majorité des méduses sont marines, seules de rares espèces comme Craspedacusta sowerbyi vivent en eau douce (environ 1 %). La plupart sont entraînées par les courants marins, faisant partie du zooplancton, à l'exception des méduses du genre Cassiopea (méduse benthique, sédentaire) qui se tiennent posées sur le fond, l'ombrelle retournée[36].
Le système gastro-vasculaire situé dans l'épaisseur de la mésoglée est le seul véritable organe de la méduse. Les proies plus volumineuses (copépodes, poissons et leurs larves) sont piégées par les tentacules rétractiles qui acheminent cette nourriture (notion de « feeding reaction ») vers la cavité buccale. La digestion (de quelques minutes pour du microphytoplancton à quelques heures pour du macrozooplancton) se produit dans la cavité gastro-vasculaire envahie de filaments gastriques. Les produits de la digestion sont distribués à l'ensemble de l'organisme par de nombreux canaux radiaires puis par le canal circulaire. Les produits d'excrétion empruntent le trajet inverse et sont éliminés par cavité buccale sous forme de sortes de pelotes de réjection[29].
Les méduses ont une ébauche de cerveau avec une chaîne de ganglions nerveux situés sur le pourtour de l'ombrelle et composés de cellules nerveuses en lien avec des organes des sens et dont l'activité principale consiste à assurer les battements rythmiques de l'ombrelle[37]. Elles possèdent à la base des tentacules ou dans des échancrures de l'ombrelle des zones de concentration d'organes récepteurs, les rhopalies dans lesquelles certaines cellules s'organisent autour d'ocelles (yeux simples ou complexes avec cornée, cristallin et rétine), d'autres autour de statocystes (récepteurs fonctionnant comme ceux de l'oreille interne humaine et sensibles à l'équilibre pour s'orienter dans l'eau, d'autres encore deviennent fossette olfactive. Les rhopalies sont ainsi des organes photorécepteurs, statorécepteurs et chimiorécepteurs[38]. Ce système nerveux simple et diffus permet de déclencher des mouvements orientés, notamment les migrations verticales nycthémérales, mais les biologistes s'interrogent encore sur ce que voient les méduses[39] car manifestement beaucoup d'entre elles n'utilisent pas l'information visuelle pour se nourrir[40]. Leur larve appelée planula porte des cellules ciliées photoréceptrices, ce qui leur permet de se diriger par phototaxie.
Lorsque l'environnement se dégrade, certaines méduses entrent en dégénérescence, se fabriquant des kystes dans lesquels les tissus se désorganisent puis, lorsque les conditions environnementales s'améliorent, les kystes s'ouvrent et en l'espace d'une journée, on retrouve ces méduses qui ont régénéré leurs cellules. Certaines espèces comme Turritopsis nutricula parviennent aussi à repasser du stade de méduse à polype, la rendant potentiellement immortelle (uniquement biologiquement)[41].
Écologie et comportement
Alimentation


La majorité des espèces se nourrissent de microplancton piégé par leurs tentacules marginaux ou péri-ombrellaires, filaments rétractiles attachés au bord de l'ombrelle. En étirant au maximum leurs tentacules très élastiques, les méduses augmentent considérablement le volume d’eau prospecté[42]. Certaines espèces, comme dans l'ordre des Rhizostomeae, ont des prolongements buccaux soudés sans orifice buccal distinct, l'alimentation étant réalisée au niveau de nombreux et minuscules orifices buccaux sur les bras buccaux coalescents, et se supplémentent en sucres grâce à des algues symbiotiques qui vivent dans ces bras. D'autres se nourrissent en capturant des proies plus volumineuses (copépodes, larves et œufs de poissons, poissons de quelques cm de longueur). Certaines méduses se renversent, l'ombrelle tournée vers le haut, et attendent que le plancton qui chute vers le fond tombe dans leur cavité buccale[43]. En cas de nourriture abondante, elles peuvent manger jusqu'à la moitié de leur poids en une journée, mais elles peuvent aussi jeûner, et même manger leurs propres gonades pour survivre en cas de disette prolongée[44].
Dans leur stratégie optimale de recherche de la nourriture, les méduses pratiquent aussi bien la chasse passive que la chasse à l'affût. Ces stratégies diffèrent selon la taille et la forme de l'ombrelle, le nombre, la taille et la disposition des tentacules[45].
Des méduses utilisent la bioluminescence pour faciliter la prédation sur des proies, telle la méduse casquée (en) (l'émission de lumière correspond à une réaction enzymatique entre un substrat, la luciférine, et la luciférase) ou la méduse Aequorea victoria et sa protéine fluorescente verte (GFP). Sa découverte en 1962 et ses applications ont été couronnées par le prix Nobel de chimie décerné à Osamu Shimomura, Martin Chalfie et Roger Tsien le [46].
Reproduction et cycle de développement
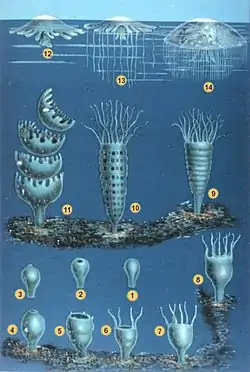
Certaines méduses peuvent bourgeonner d'autres méduses sur le rebord de l'ombrelle mais la majorité de la reproduction asexuée est effectuée à partir du polype appelé scyphistome, le plus souvent solitaire et de quelques mm de long. Ce dernier produit de jeunes méduses (éphyrules (it) ou éphyra) par strobilation[47]. Au moment de la reproduction sexuée, les méduses deviennent de véritables « gonades flottantes », toute leur alimentation étant engagée à produire ces glandes. Les cellules sexuelles sont différenciées dans les gonades qui se développent autour du manubrium chez les anthoméduses, le long des canaux radiaires chez les leptoméduses et trachyméduses, dans des poches génitales reliées à l'estomac chez les scyphoméduses. Elles libèrent dans la colonne d'eau les gamètes (spermatozoïdes pour les méduses mâles, ovules pour les femelles) qui se dispersent dans l'océan et fécondent les ovules : la fécondation est externe, à l'exception de Stygiomedusa gigantea ou d'Aurelia aurita qui sont vivipares. Une fois la reproduction assurée, les méduses meurent. Ce cycle de vie[48] est une sémelparité qui est favorisée par la courte durée de la forme libre, ce qui peut correspondre à une stratégie énergétique spécifique[49]. En dispersant les œufs, elles contribuent à la colonisation de nouvelles aires géographiques. Le développement embryonnaire est marqué par différents stades et aboutit à la formation d'une larve ciliée, la planula, à l'exception d'espèces dont la larve donne directement des bébés méduses (Pelagia noctiluca). Les polypes fixés tapissent alors le fond de l'océan. Ces polypes se développent différemment en fonction de l'espèce (polypes solitaires ou bourgeonnant). Certains ne peuvent se développer qu'après un demi-siècle. Plus généralement, il faut qu'un changement important intervienne (ex: changement de température, d'oxygène, coup de tonnerre) pour leur permettre de libérer les méduses ainsi formées[50].
La durée de vie des méduses va généralement de quelques jours à deux mois pour les petites espèces, un à deux ans pour les plus grandes[29]. Le stade pélagique des méduses est généralement éphémère car ces animaux sont sémelpares mais la méduse casquée (en) présente en Antarctique mais aussi en Arctique, peut atteindre 30 ans[51].
Locomotion
Les battements continus de l'ombrelle contractile permettent aux méduses de flotter et de se propulser. Les contractions des myofibrilles (cellules myoépithéliales endodermiques et ectodermiques) formant une nappe sous-ombrellaire accentuent la convexité de l'ombrelle et provoquent l'éjection d'eau. Le retour à la position de repos est passif et est dû à l'élasticité de la mésoglée. Lorsque les méduses se dirigent activement vers le fond, elle se retournent, l'ex-ombrelle vers le bas, de telle façon que l'éjection d'eau vers le haut assure la propulsion vers le bas. L'intensité du déplacement est liée à la puissance de la contraction de la sous-ombrelle et au degré d'occlusion du velum. Les vitesses obtenues par ce jet-propulsion varient généralement entre 5 et 15 cm par seconde[52] - [53]. Les mouvements natatoires restent généralement lents et peu prolongés, les méduses se laissant généralement entraîner par les courants et faisant partie du macroplancton[54].
Des recherches en biophysique[55] - [56] suggèrent que les méduses nagent plus efficacement que tout autre animal aquatique : les contractions de l'ombrelle créent autour de leurs corps des zones de haute et basse pression qui à la fois les aspirent (phénomène de succion) et les propulsent en avant (phénomène de poussée). La succion (en) a pour effet qu'un tiers de leur propulsion est réalisée sans l'action musculaire. Elles consomment ainsi moins d'oxygène et d'énergie, en proportion de leur taille, que des dauphins ou des requins. Les mouvements du bord de la cloche ont pour effet de faire descendre le tourbillon annulaire (zone de basse pression) sous l’animal, ce qui fait remonter de l’eau sous pression à l’intérieur de la cloche et lui donne une seconde poussée[57]. Cette propulsion efficace pourrait être une source de bio-inspiration pour les ingénieurs en mécanique[58].
Interactions biologiques



Il existe des relations symbiotiques avec des crustacés minuscules qui s'abritent entre les ramifications des bras oraux et dans l’ombrelle des méduses pour se protéger et qui, en échange, les débarrassent de parasites potentiels. Il existe aussi des cas de commensalisme (alevins qui s'abritent parmi les tentacules urticants de méduses, argonautes de l'espèce Argonauta argo« chevauchant » une méduse sur son ombrelle). Ces animaux se sont au préalable enduits du mucus de la méduse qui contient une substance empêchant les cnidocytes de fonctionner[59]. Enfin des cas de parasitisme sont observés avec des dinoflagellés, ciliés, larves d'anthozoaires, balanes pédonculées, isopodes et amphipodes qui bénéficient seuls de leurs interactions avec les méduses[60].
Rôles dans les écosystèmes marins
Dans les écosystèmes marins, et plus rarement en eau douce ou saumâtre (Craspedacusta sowerbyi ou Limnocnida tangany, première méduse d'eau douce connue[61]), les méduses jouent un rôle encore mal compris[62], mais probablement important dans la régulation des populations de poissons et de zooplancton[62], ainsi que le cycle des nutriments[62].
Ces écosystèmes abritent de multiples communautés benthiques. Les méduses, selon les espèces, peuvent se fixer sur des fonds rocheux, sur des coquilles (polypes épilithes)[63] ou sur des algues, des phanérogames (épiphytes, telles les méduses fixées des stauroméduses grâce aux boutons adhésifs situés sur leurs tentacules)[64].
On observe à intervalles plus ou moins réguliers (pseudo-cycliques) des pullulations cycliques de méduses qui parfois frappent les pêcheurs et les populations côtières ; on parle alors d'année à méduses (exemple : 2008, pour le golfe du Lion selon l'IFREMER).
Prédateurs
Très souvent fuie à cause de ses cellules urticantes qui constituent son principal moyen de défense en l'absence de squelette[65], la méduse a néanmoins des prédateurs (124 espèces de poissons et 34 espèces d'autres animaux — anémones de mer, thons, requins, dauphins, espadons, tortues de mer, manchots, pingouins — recensés), et il semble que leur nombre ait été sous-estimé, comme l'a été l'importance des méduses dans le réseau trophique marin[66] - [67] - [68]. Cette sous-estimation s'explique par le fait qu'il est difficile de savoir quels animaux consomment des méduses car une fois ingérées, elles deviennent vite non-identifiables dans le tractus digestif du prédateur[62].
Quelques grands consommateurs de méduses sont depuis longtemps connus, dont la tortue Luth[69] et la tortue Caouanne (sauf au stade néritique)[70] - [71]). Le poisson lune a été confirmé grand consommateur de méduses, de même - ce qui est nouveau - que les thons (Thunnus thynnus, Euthynnus alletteratus...), notamment juvéniles, et l'espadon (Xiphias gladius), qui semblent en être aussi très friands[62], ainsi que certains oiseaux de mer, aussi variés que les manchots et les albatros[62].
Ces analyses isotopiques ont montré que par contre le plancton gélatineux n'est pas mangé par le Tassergal (Pomatomus saltatrix), le Requin bleu (Prionace glauca), la Liche amie (Lichia amia), la Bonite (Sarda sarda), le Dauphin bleu et blanc (Stenella coeruleoalba) ou la tortue Caouanne (Caretta caretta) au stade néritique.
Dans une moindre mesure, des crustacés (homard par exemple[62]) et des échinodermes apprécient les cadavres de certaines espèces. Certaines espèces peuvent manger des congénères plus petits qu'elles.
Une hypothèse émise dans les années 1980-1990 est que les pullulations de méduses de plus en plus fréquentes et intenses pourraient être dues à l'Homme[72], et en particulier à une régression de leurs prédateurs en raison de la surpêche de ces derniers[73] - [74], et que sans le retour de ces prédateurs[75], l'océan risquait d'évoluer, régresser vers un écosystème primitif dominé par un « plancton gélatineux »[76], phénomène qui semble en cours et qui pourrait être exacerbé par le réchauffement climatique[77] - [78]. Cette idée n'était cependant pas encore étayée par de véritables preuves scientifique[62].
Le biologiste marin Luis Cardona de l'Université de Barcelone, intrigué par les pullulations récentes de Pelagia de noctiluca a eu l'idée d'utiliser l'analyse isotopique (isotopes du carbone et l'azote) pour étudier le régime alimentaire de 20 espèces de prédateurs et de 13 proies potentielles : il a été surpris de constater que « les méduses jouent un rôle majeur dans le régime alimentaire du thon rouge (Thunnus thynnus), de La Thonine commune (Euthynnus alletteratus) et du marlin Tetrapturus belone[79]. Et dans le cas des thons rouges juvéniles, les méduses et d'autres animaux gélatineux (ex Cténophores) représentaient jusqu'à 80 % de l'apport alimentaire total ». Pour le « thon rouge » juvénile, les méduses et d'autres organismes gélatineux pourraient être les proies les plus importantes[62]. Toutes ces espèces sont cependant victimes de surpêche dans la mer Méditerranée.
L'Homme peut aussi être qualifié de prédateur, étant donné qu'elle est consommée en Asie (en Chine, au Japon ou encore en Corée). Voir la section infra.
Pullulations

Plusieurs espèces connaissent des phénomènes de multiplication massive et cyclique connus sous le nom de pullulation de méduses, comme la célèbre Pelagia noctiluca en Méditerranée[62]. De nombreux facteurs (réchauffement climatique, surpêche, eutrophisation, pollution physique et chimique[80]) sont donnés pour expliquer ces blooms de méduses, au point que certaines d'entre elles comme la méduse casquée (en) deviennent des prédateurs dominants[81]. Toutefois, les différentes espèces de méduses ont différentes réponses, et on pense qu'il existe de nombreuses autres causes encore inconnues responsables de tels phénomènes.
Les conséquences de ces invasions sont diverses. Elles peuvent poser problème pour la baignade, la plongée sous-marine, la pêche (en provoquant l’éclatement des filets et en contaminant les prises), plus rarement les fermes aquacoles[82], le refroidissement de porte-avions à propulsion nucléaire (cas de la méduse mosaïque)[83] et de centrales nucléaires[84] (en bloquant les crépines d’aspiration)[85] ou certaines industries nécessitant de pomper de l'eau de mer comme les usines de désalinisation. Ces pullulations peuvent générer des coûts économiques et sociaux importants.
Nécromasse
Les méduses joueraient aussi un rôle très important de transferts biogéochimiques et écologiques d'éléments nutritifs (azote et carbone principalement) de l'océan superficiel vers le benthos de l'océan profond[86], y compris en climat froid (par exemple avec les millions de cadavres de la méduse Periphylla periphylla (en), méduse abyssale qui pullule régulièrement dans certains fjords et vit jusqu'à 3 000 m de profondeur)[62].
Le phénomène de mortalité massive de méduses est saisonnier, apparaissant surtout après des périodes de fort upwelling et/ou la formation de blooms planctoniques de printemps en zones tempérées et subpolaires ; et en fin de printemps et début d'été.
Andrew Sweetman[87] a récemment montré que les pullulations de ces méduses sont suivies par des pluies de cadavres (« jelly-falls ») qui vont enrichir les fonds marins. En il a utilisé une plate-forme dotée d'une caméra immergée à 400 mètres de fond dans le fjord de Lurefjorden (sud-ouest de la Norvège) pour voir in situ ce que devenaient les cadavres des 50 000 tonnes de méduses estimées présentes dans ce fjord lors de leurs pullulations[88] car des observations antérieures laissaient penser qu'elles pouvaient contribuer aux zones mortes (conditions anoxiques et toxiques notamment observées en Baltique), mais Sweetman a montré que dans ce fjord au moins, des charognards consommaient rapidement les méduses mortes, avant qu'elles n'aient le temps de se décomposer sur le fond, tout en augmentant de 160 % environ l'azote biodisponible pour les espèces vivant au fond (sur 218 photos prises au hasard sur le fond, seules 5 montraient un cadavre de méduse, mais les crustacés (caridea) étaient significativement plus abondants sur les photos montrant l'un de ces cadavres).
Des ROV ont permis des observations similaires encore plus profondément dans l'océan Pacifique, confirmant que contrairement à une idée reçue, la méduse ne constitue pas une impasse dans le réseau trophique. L'auteur a ensuite cherché à mieux mesurer l'importance de ce transfert et conclut avec ses collègues en 2012[89] que ce transfert pourrait « fournir une "compensation naturelle" aux pertes prévues de matière organique pélagique (MOP) en ce qui concerne l'alimentation des écosystèmes benthiques »[89]. Des caméras immergées en mer profonde norvégienne, appâtées avec un cadavre de méduse ont filmé jusqu'à un millier environ de nécrophages attirés par le cadavre (soit l'équivalent de ce qu’attirerait un poisson mort de poids similaire et ce sont les mêmes nécrophages : myxine atlantique, crabes de la famille des Galatheidae, crevettes décapodes et crustacés amphipodes comme des Lyssianasidae)[86] ; chaque méduse morte était entièrement consommée en moyenne en deux heures et demie[86].
Classification
Actuellement plus de 1 500 espèces de « méduses » ont été décrites dans le monde[90], dont seulement une minorité (182) sont des méduses « vraies » (scyphozoaires), la majorité des cnidaires pélagiques étant des hydroméduses, plus petites et de formes moins régulières. Elles se répartissent en trois grands groupes :
- Les Cuboméduses (ou Charybdéides) : petites méduses extrêmement urticantes de forme cubique possédant quatre tentacules creux.
- Les Hydroméduses : La classe des hydroméduses regroupe les méduses autonomes qui représentent l'organisation la plus simple ; elle a été subdivisée en plusieurs ordres :
- Les Trachyméduses : Ce sont des méduses de petite taille, mesurant quelques centimètres de diamètre. Elles sont hémisphériques ou aplaties. Le nombre de leurs tentacules varie de 8 à 32. Les trachyméduses habitent généralement en haute mer et ne sont présentes dans les zones côtières que pendant les saisons froides, amenées par les courants. L'espèce Geryonia proboscidalis peut être rencontrée en Méditerranée.
- Les Narcoméduses : leur organisation est plus complexe. Leur ombrelle est le plus souvent aplatie, lenticulaire ou discoïdale. Les narcoméduses sont peu nombreuses, mais abondantes en Méditerranée ; elles sont plus rares dans les mers tropicales et à peine représentées dans les mers froides. Leur taille varie en général de 3 à 30 mm de diamètre. Elles sont amenées près des rivages par les courants pendant la saison froide.
- Les Limnoméduses : ce sont de petits hydroïdes en forme de méduses simples, principalement solitaires et rarement coloniales et sessiles. Elles peuvent avoir des tentacules ou non, n'ont pas de thèque mais un périderme muqueux. Quelques espèces peuvent être trouvées en eaux douces.
- Les Leptoméduses : de petites méduses pélagiques à l'organisation extrêmement simple. Beaucoup d'espèces de ce groupe privilégient cependant la forme polype, fixée et coloniale (formant des ramifications d'allure végétale).
- Les Scyphoméduses (ou Acalèphes) : ce sont les méduses « vraies », urticantes et plus évoluées que les autres groupes. L'ombrelle est le plus souvent hémisphérique et sa musculature est bien développée (muscle coronal situé sous l’ombrelle). Les acalèphes sont généralement de grande taille et pélagiques. Elles appartiennent soit au plancton côtier, soit au plancton de haute mer. Les Acalèphes ont été répartis en quatre ordres :
- Les Séméostomes : méduses possédant des tentacules très urticants. Aurelia aurita est une méduse séméostome de grande taille bien connue. Pelagia noctiluca est une méduse séméostome de couleur rose chair phosphorescente, régulièrement sujette à de vastes invasions en Méditerranée.
- Les Rhizostomes : Ces méduses sont les plus évoluées. Elles se nourrissent de petits animaux planctoniques, et complètent leur alimentation grâce à une association avec des algues symbiotiques : les zooxanthelles. Les Rhizostomes abondent surtout dans les mers chaudes, mais on les trouve aussi dans les mers tempérées (Rhizostoma pulmo en Europe).
- Les Coronates : méduses dont le bord de l'ombrelle est découpé en lobes, au fond desquels sont insérés les tentacules. Les Coronates sont des espèces de haute mer des régions tropicales.
- Les Stauroméduses (ou Lucernaires) : méduses Scyphistomes n'ayant pas réalisé leur strobilation et devenues sexuées. Il s'agit d'une forme néoténique : la Lucernaire est une sorte de méduse fixée par un pédoncule, vivant un peu à la manière d'une anémone. Elles sont souvent accrochés à une zostère.
Taxonomie
Le terme « méduse » est ambigu d'un point de vue scientifique : comme l'anglais jellyfish, il est parfois utilisé, au-delà du groupe des méduses « vraies » qui sont les scyphozoaires, pour désigner les stades pélagiques macroscopiques de nombreux cnidaires (cuboméduses, siphonophores...), et même des animaux gélatineux non liés aux cnidaires, comme les cténophores ou les tuniciers pélagiques[62].
Au sein des cnidaires pélagiques, la position des gonades, la nature et l'origine embryologique des organes des sens, le niveau d'implantation des tentacules, ainsi que le cnidome, sont les caractères taxonomiques majeurs chez les méduses[91].
Une espèce très rare de la classe des stauroméduses, Lipkea ruspoliana (nl), pourrait être l'ancêtre des Médusozoaires[92].
Cette classification met en gras les groupes de cnidaires qui peuvent être dénommés « méduses », d'après World Register of Marine Species (13 janvier 2015)[93] :
- Classe Anthozoa (coraux et anémones de mer)
- Classe Cubozoa (cuboméduses)
- ordre Carybdeida
- ordre Chirodropida
- Classe Hydrozoa (hydroméduses, siphonophores, hydres, coraux de feu...)
- sous-classe Hydroidolina
- ordre Anthoathecata (coraux de feu)
- ordre Leptothecata (leptoméduses)
- ordre Siphonophorae (siphonophores)
- sous-classe Trachylinae
- ordre Actinulida (microméduses actinulides)
- ordre Limnomedusae (limnoméduses)
- ordre Narcomedusae (narcoméduses)
- ordre Trachymedusae (trachyméduses)
- sous-classe Hydroidolina
- Classe Scyphozoa (méduses « vraies »)
- sous-classe Discomedusae
- ordre Rhizostomeae (méduses rhizostomes)
- ordre Semaeostomeae (méduses séméostomes)
- ordre Coronatae (méduses coronates)
- sous-classe Discomedusae
- Classe Staurozoa (stauroméduses)
- ordre Stauromedusae
 Tripedalia cystophora, une cuboméduse de l'ordre des Carybdeida.
Tripedalia cystophora, une cuboméduse de l'ordre des Carybdeida. Avispa marina, une cuboméduse de l'ordre des Chirodropida.
Avispa marina, une cuboméduse de l'ordre des Chirodropida. Aequorea victoria, une hydroméduse de l'ordre des Leptothecata.
Aequorea victoria, une hydroméduse de l'ordre des Leptothecata. Olindias formosa, une hydroméduse de l'ordre des Limnomedusae.
Olindias formosa, une hydroméduse de l'ordre des Limnomedusae. Bathykorus bouilloni, une hydroméduse de l'ordre des Narcomedusae.
Bathykorus bouilloni, une hydroméduse de l'ordre des Narcomedusae. Crossota sp., une hydroméduse de l'ordre des Trachymedusae.
Crossota sp., une hydroméduse de l'ordre des Trachymedusae._edit.jpg.webp) Phyllorhiza punctata, une méduse de l'ordre des Rhizostomeae.
Phyllorhiza punctata, une méduse de l'ordre des Rhizostomeae..jpg.webp) Pelagia noctiluca, une méduse de l'ordre des Semaeostomeae.
Pelagia noctiluca, une méduse de l'ordre des Semaeostomeae. Periphyllopsis braueri, une méduse de l'ordre des Coronatae.
Periphyllopsis braueri, une méduse de l'ordre des Coronatae. Haliclystus antarcticus, une stauroméduse de l'ordre des Stauromedusae.
Haliclystus antarcticus, une stauroméduse de l'ordre des Stauromedusae.
Les méduses et l'homme

Services écosystémiques
Les méduses traînent une mauvaise réputation en raison de leur caractère urticant et envahissant[94]. Cette perception négative a entravé l'évaluation des services écosystémiques rendus par les méduses, alors qu'elles jouent un rôle central dans la biodiversité marine en empêchant la monopolisation de la biomasse par des concurrents extrêmement performants. Elles participent aux transferts biogéochimiques et écologiques d'éléments nutritifs (azote et carbone principalement) de l'océan superficiel vers le benthos de l'océan profond. Elles sont une source de nourriture pour de nombreuses espèces (elles pourraient notamment servir de nourriture pour la pisciculture). Elles peuvent contribuer à des avancées médicales, à la production d'engrais agricoles, ou à la cuisine de nouveaux mets pour l'homme[95] - [96].
Elles produisent en cas de stress, de reproduction ou de mort, un mucus à partir duquel on peut fabriquer des hydrogels naturels permettant de filtrer des nanoparticules responsables de pollution[97]. Elles pourraient servir ainsi de biomarqueurs des zones polluées par ces nanoparticules (en)[98]. Le rôle de bioindicateur est aussi observé, avec des applications en gestion des écosystèmes côtiers[99].
La méduse possède un réseau de cellules nerveuses (formant des structures sensorielles très élaborées comme des ocelles, rassemblées au sein de rhopalies) qui ont servi de modèle aux scientifiques pour l'étude et la compréhension du passage de l'influx nerveux[100].
Elle intéresse les fabricants de cosmétiques. Sa fibrilline et son collagène élastique et super-résistant contenus dans la mésoglée, ont la réputation de lutter contre les rides. Le collagène est aussi « une source inespérée pour la médecine car sa formule chimique est la seule de tous les collagènes animaux testés à être très voisine du collagène humain[101] ». Il a notamment des effets cicatrisants en chirurgie et des effets immunostimulateurs (en)[102]. La société Javenech, basée à Javené, collecte des méduses échouées sur les plages de Loire-atlantique et valorise ce collagène utilisé par de grands laboratoires internationaux[103] ou dans la régénération de la peau chez les grands brûlés[104].
La maladie de la vache folle ayant entraîné une interdiction de vente de produits à base de mucine (bovine ou ovine), des recherches sur des molécules de substitution ont conduit en 2007 des chercheurs de l'Université Tōkai à extraire des méduses géantes une protéine baptisée qniumucine qui a des applications potentielles en médecine (régénération de cartilages) et industrie alimentaire (additif alimentaire émulsifiant dans les sodas, les crèmes glacées, les soupes)[105].
Les méduses offrent un spectacle élégant et coloré, d'où l'engouement pour les medusariums[106]. Leur beauté inspire aussi des artistes comme Léopold et Rudolf Blaschka qui réalisent des méduses en verre pour des musées, aquariums, universités[25], Yves Chaudouët, Timothy Horn[107].
Consommation humaine


Une quinzaine d'espèces de méduses sont consommées séchées en Asie[109] - [110], en particulier au Japon (kurage), notamment coupées en lamelles sous forme de salades, la principale espèce consommée lors des repas de gala en Asie étant Rhopilema esculentum . Chaque année, les Japonais en consomment environ 13 tonnes[111]. En Chine, qui en fait des élevages, en Corée, en Thaïlande et en Malaisie, les méduses sont également consommées séchées, notamment sous forme de brochettes. Leur intérêt nutritif est relativement limité puisqu'elles sont composées à plus de 98 % d'eau, mais les 2 % de chair restants contiennent des protéines et des glucides[112]. 15 pays de l'Asie du Sud-Est (dont la Chine, l’Inde, l’Indonésie, le Japon, la Malaisie et les Philippines) possèdent des pêcheries à méduses qui en récoltent 400 000 tonnes par an pour la consommation humaine[113].
La surpêche ou la disparition des espèces prédatrices des méduses (thons, harengs, anchois, tortues)[114], la disparition de leurs concurrentes comme les sardines, qui augmentent la quantité de nourriture disponible, « la destruction des fonds marins par les chalutiers qui favorise leur reproduction, le réchauffement des eaux, et l'eutrophisation des milieux côtiers » stimulent leur prolifération, au point que les chercheurs Philippe Cury et Daniel Pauly font la conjecture provocante qu'« il nous faudra nous contenter de manger des méduses ! »[115].
Des analyses alimentaires de plats préparés commercialisés à Hong Kong ont montré que ce plat est souvent très contaminé par de l'aluminium, provenant probablement d'additifs alimentaires[116].
Envenimation

Seule une poignée d'espèces de méduses sont équipées de cellules piquantes capables de percer un épiderme humain. La très large majorité des espèces est inoffensive et ne présente donc aucun risque d'envenimation sévère, ne provoquant en général que des troubles locaux et superficiels, ou rien du tout[117]. Par ailleurs, les « méduses » les plus urticantes et aux piqûres les plus graves, en dehors de quelques espèces célèbres (comme la Pelagia noctiluca de Méditerranée) ne sont, pour la plupart, pas de vraies méduses, mais appartiennent à d'autres groupes : siphonophores (comme Physalia physalis), cuboméduses (comme Chironex fleckeri) responsables notamment du syndrome d'Irukandji, hydroméduses, etc.
Les méduses piquent leur proie en utilisant leurs tentacules extensibles qui portent par millions des nématocystes groupés en batteries urticantes qui injectent du venin en provoquant de multiples micro-piqûres qui immobilisent ou tuent leurs victimes. Parfois, ces cellules urticantes sont réparties sur tout le corps, comme pour la cuboméduse Carukia barnesi extrêmement venimeuse[118].
Ces nématocystes sont si légers que pour pouvoir percer le tégument de leurs proies, la pression hydrostatique de la capsule urticante de 15 mégapascals entraîne l'éversion du harpon barbelé en 700 nanosecondes et avec une accélération pouvant atteindre cinq millions de g (accélération qui crée un moment de torsion important), ce qui en fait l'un des processus cellulaires les plus rapides en biologie[119] - [120].
Chez l'homme, la douleur est immédiate, à type de décharge électrique ou de brûlure. Quelques minutes après la piqûre, apparaissent des paresthésies et un érythème local qui s'aggrave pendant les heures suivantes, reproduisant la forme des tentacules : la lésion rouge-marron ou violacée, prend l'aspect typique d’un coup de fouet[121]. Les personnes très allergiques, ou celles qui ont reçu une très grosse charge de venin, ou encore celles qui sont victimes de certains types particuliers de méduses très venimeuse, développent d'autres symptômes : crampes musculaires, vomissements, œdèmes pulmonaires, troubles cardiaques, hypertension[122]. Dans la majorité des cas, il y a disparition des lésions et des symptômes en quelques heures ou quelques jours avec guérison mais peuvent aussi apparaître des cicatrices hyperchromiques ou chéloïdes persistant plusieurs mois à années et entraînant une gêne esthétique, principalement quand le contact avec la méduse a été long ou l'envenimation sévère[123] - [124]. Le contenu d'environ 200 000 nématocystes suffit pour tuer un rat de 194 g ; celui de 35 000 nématocystes tue une souris de 28 g[125]. Selon un rapport de la National Science Foundation publié en 2005, environ 150 millions de personnes dans le monde sont exposées aux méduses chaque année[126]. Les méduses au sens large provoquent 15 à 30 fois plus de morts humaines chaque année (principalement les cuboméduses et en premier lieu la Chironex, réputée être l'un des animaux les plus venimeux au monde) que toutes celles issues d'attaques non provoquées de requins dans le monde (parmi les quelques dizaines d'attaques de requins recensées tous les ans, seules quatre ou cinq sont mortelles)[127].
En cas de piqûre, les traitements immédiats (retrait des éventuels fragments de tentacules restants sur la peau, rinçage de la zone touchée à l'eau de mer ou, mieux, au vinaigre, désinfection puis immersion dans de l'eau chaude non brûlante)[128] diffèrent selon les espèces et les régions[129]. Sur conseil médical, une douleur trop intense peut être tempérée à l'aide de Lidocaïne ou benzocaïne, voire d'hydrocortisone[130]. Pour les cas sérieux, le traitement médical fait appel à des antihistaminiques, des corticostéroïdes, de la morphine, des stimulants cardiaques mais il n'existe pas d'antidote connu, à l'exception de certaines cuboméduses pour lesquelles sont développés des antivenins[131]. Certaines larves de méduses et d'anémones de mer peuvent parfois s'infiltrer sous les vêtements de bain amples. Le frottement, la douche ou le rinçage à l'eau douce active leurs cnidocystes comme pour les méduses adultes, ce qui peut donner la dermatite des nageurs (en)[132].
Une grande quantité de rumeurs sans fondement courent sur les soins à apporter aux piqûres de méduse[130] :
- parmi les actions contre-productives (qui aggravent l'envenimation), on trouve l'utilisation d'eau douce, d'alcool, de sodas, le frottement avec du sable ou une serviette, le grattement avec un couteau ou une carte bancaire, le bandage ou garrot, ou encore le recours à de la glace ou de l'huile ;
- parmi les actions sans efficacité, on trouve l'utilisation d'urine, de crème solaire, d'un sèche-cheveux, d'anti-inflammatoires et de gel hydratant.
.jpg.webp) Le « piqueur mauve », méduse commune dont les tentacules sont très urticants (mais pas dangereux).
Le « piqueur mauve », méduse commune dont les tentacules sont très urticants (mais pas dangereux). Chironex fleckeri, la « main qui tue » qui entraîne une paralysie cardiaque et respiratoire en quelques minutes.
Chironex fleckeri, la « main qui tue » qui entraîne une paralysie cardiaque et respiratoire en quelques minutes. Physalie échouée, « méduse » célèbre pour être à l'origine d'une découverte en médecine, l'anaphylaxie, en 1901[133].
Physalie échouée, « méduse » célèbre pour être à l'origine d'une découverte en médecine, l'anaphylaxie, en 1901[133].
Protection
Des équipements de protection ont été développés, individuels (combinaisons intégrales, plus pratiques mais beaucoup plus onéreuses, crèmes anti-méduse) ou collectifs (filets anti-méduses), dont le coût élevé rend leur généralisation difficile, car ils n'arrêtent pas d'autres méduses plus petites et néanmoins très irritantes. De plus, ces filets peuvent favoriser la formation d'une soupe urticante : les méduses s’écrasent contre les mailles (d’autres animaux aussi, au demeurant). Stressées, elles secrètent un mucus urticant et leurs tentacules se brisent tout en restant venimeux[134]. De plus, la prise de ces animaux dans des filets induit la production de spermatozoïdes et d'ovules, ce qui favorise la pullulation de méduses[135]. D'autres moyens de prévention sont la pose de panneaux d’information, les baignades déconseillées entre novembre et mai, la prévention par modélisation pour alerter le public de l'avancée des méduses[136]. La pose de balises acoustiques miniaturisées sur ces méduses permet en effet d'évaluer la variabilité saisonnière de l’abondance de cet animal dangereux sur les plages australiennes dans le cadre de modèles de gestion des risques[137] - [138].
Des sites collaboratifs proposent au public de recenser les méduses sur les plages pour évaluer le risque d'envenimation (Jellywatch.org pour le monde entier, meduse.acri.fr pour la Côte d'Azur)[139].
Animaux ressemblants
.jpg.webp)
De nombreux êtres planctoniques ou neustoniques ont adopté par convergence évolutive, comme les cnidaires médusoïdes, un corps mou et transparent et un mode de vie plus ou moins dérivant, entraînant une confusion récurrente avec les méduses, d'autant qu'ils partagent souvent en anglais le nom ambigu de jellyfish :
- Les siphonophores sont des cnidaires comme les méduses, de la classe des hydrozoaires, mais leur organisation est extrêmement différente, puisqu'ils sont constitués de colonies de clones et pourvus d'organes originaux (notamment parfois des flotteurs). Les plus connus sont la physalie (Physalia physalis), la Porpite (Porpita porpita) et la Vélelle (Velella velella)
- Les cténaires se reconnaissent à leurs rangées de « peignes » iridescents sur quatre côtés.
- Les tuniciers thaliacés comme les pyrosomes sont beaucoup plus proches des humains que des méduses, équipés d'un système digestif et nerveux élaboré.
- Plusieurs groupes de mollusques ont adopté un mode de vie pélagique et une morphologie gélatineuse, avec ou sans coquille (par exemple les Gymnosomata et les Thecosomata).
- Certains autres animaux pélagiques ont dérivé vers une forme médusozoïde, comme le concombre de mer nageur Pelagothuria natatrix.

 Mertensia ovum, un cténaire.
Mertensia ovum, un cténaire. Pyrosoma atlanticum, un tunicier pélagique.
Pyrosoma atlanticum, un tunicier pélagique.
.png.webp) L'énigmatique Pelagothuria natatrix est un concombre de mer pélagique.
L'énigmatique Pelagothuria natatrix est un concombre de mer pélagique.
Dénominations dérivées
- En astronomie, le rémanent de supernova IC 443, issu de l'explosion d'une étoile massive, est composé de deux lobes dont l'un est plus brillant et présente un bord bien délimité et l'autre plus diffus et de structure plus filamentaire, le tout évoquant une méduse. Pour cette raison, cet objet est parfois appelé « nébuleuse de la Méduse ».
- Dans le dessin animé Bob l'éponge, Bob consomme régulièrement de la confiture de méduse qu'il obtient après avoir trait celles-ci. Il se livre également à la chasse à la méduse, proche de la chasse aux papillons chez les êtres humains.
- Dans le dessin animé Oum le dauphin blanc (série 2015, épisode Opération Ma'o Mauri), Von Crouk récupère la mucine des méduses pour en faire des crèmes anti-rides.
- Le groupe d’hacktivistes Telecomix utilise souvent la méduse comme symbole et icône.
Bibliographie
- Robert Calcagno, Jacqueline Goy, Méduses. À la conquête des océans, éditions du Rocher, 2014
- De Rüdiger Wehner, Walter Gehring : Biologie et physiologie animales. Bases moléculaires, cellulaires, anatomiques et fonctionnelles. (traduit par Christiane Élisabeth Meyer). Publié 1999 par "De Boeck Université", 864 pages (ISBN 2744500097)
- (en) Stefano Goffredo et Zvy Dubinsky, The Cnidaria, past, present and future. The world of Medusa and her sisters, Springer, , 855 p. (ISBN 978-3-319-31303-0, lire en ligne)
- Bonino E., Spiagge Cambriane. Meduse e tappeti algali. 232pp + poster. Back to the Past Museum. http://www.enrico-bonino.eu Origine des méduses et les processus de fossilisation qu'ils ont permis l'exceptionnelle conservation jusqu'à aujourd'hui (en langue italienne).
Voir aussi
Articles connexes
Liens externes
- Transformation d'une méduse Deepstaria : https://www.futura-sciences.com/planete/videos/meduse-transforme-sous-nos-yeux-6424/
- (en) Synopsis des méduses du monde entier, National Marine Biological Library
- Schéma détaillé d'une méduse
- Cycle vital d'une méduse
- "Le monde mystérieux des méduses", Le Temps d'un Bivouac, France Inter, 13 août 2019
- « Méduse (animal) », sur le dictionnaire de l’Académie nationale de médecine
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Jellyfish » (voir la liste des auteurs).
- Cet article comprend du texte dans le domaine public issu de la 20e édition de Gray's Anatomy (1918).
Notes
- Essentiellement des protéines.
- D'où son utilisation dans les crèmes anti-rides, comme cicatrisant ou reconstitution de fausses peaux.
Références
- Collins AG, Schuchert P, Marques AC, Jankowski T, Medina M, Schierwater B., « Medusozoan phylogeny and character evolution clarified by new large and small subunit rDNA data and an assessment of the utility of phylogenetic mixture models », Syst Biol., vol. 55, , p. 97-115 (lire en ligne [PDF])
- Corinne Bussi-Copin et Jacqueline Goy, « L'ère annoncée des méduses », Pour la science, no 453, , p. 31.
- (en) A.C. Marques, A. G. Collins, « Cladistic analysis of Medusozoa and cnidarian evolution », Invertebrate Biology, vol. 123, no 1, , p. 23–42 (DOI 10.1111/j.1744-7410.2004.tb00139.x)
- (en) Dr. Antonio Starcevic, Dr. Paul F. Long, « Diversification of Animal Venom Peptides—Were Jellyfish Amongst the First Combinatorial Chemists? », ChemBioChem - A European Journal of Chemical Biology, vol. 14, no 12, , p. 1407-1409 (DOI 10.1002/cbic.201300305).
- Raymond Enay, Paléontologie des invertébrés, Dunod, , p. 47.
- Vue partielle sur la dalle à méduses du gisement de Cerin, avec une méduse montrant ombrelle et tentacules, Bipedalia cerinensis, et de nombreuses méduses sans tentacule visible, Paraurelia cerinensis. Photographie : Monique et Gérard Sirven.
- (en) C. Gaillard, J. Goy, P. Bernier, J.-P. Bourseau, J.-C. Gall, G. Barale, É. Buffet, S. Enzo, « New jellyfish taxa from the Upper Jurassic lithographic limestones of Cerin (France) – taphonomy and ecology », Palaeontology, vol. 49, no 6, , p. 1287-1302 (DOI 10.1111/j.1475-4983.2006.00592.x).
- Jacqueline Goy, Les Miroirs de Méduse. Biologie et mythologie, Apogée, , p. 7.
- Jacqueline Goy, Les Méduses de François Péron et de Charles-Alexandre Lesueur. Un autre regard sur l'expédition Baudin, Comité des travaux historiques et scientifique, , p. 74-97.
- Georges Cuvier, Les zoophytes, les tables et les planches, Chez Deterville, , p. 54..
- Linné, Fauna Suecica, Stockholm, , p. 368.
- Eustache Marie Pierre Marc Antoine Courtin, Encyclopédie moderne, ou dictionnaire abrégé des sciences, des lettres et des arts, Bureau de l'Encyclopédie, , p. 26.
- Méduse, sur Larousse.fr
- Jacqueline Goy, Les Méduses de François Péron et de Charles-Alexandre Lesueur. Un autre regard sur l'expédition Baudin, Comité des travaux historiques et scientifiques, , p. 162.
- Charles d'Orbigny, Dictionnaire universel d'histoire naturelle, servant de complément aux œuvres de Buffon, de G. Cuvier, au encyclopédies, aux anciens dictionnaires scientifiques, Martinet et Compagnie, , p. 615.
- Baudin-Flinders dans l'Océan indien : voyages, découvertes, rencontre, Harmattan, , p. 82.
- Anne Diatkine, « Jacqueline Goy : «La méduse détient peut-être les clés de l’immortalité» », sur liberation.fr, .
- La vie dérive de la nature mais n'est pas directement créée par Dieu. Elle « peut naître lorsque les matières gélatineuses se réunissent en masses ». Jean-Baptiste de Monet de Lamarck, Histoire naturelle des animaux sans vertèbres, Gérard Paul Deshayes et Milne Edwards, 1835, p. 146
- Jacqueline Goy, Les Miroirs de Méduse. Biologie et mythologie, Apogée, , p. 8.
- Jacqueline Goy, Les Méduses de François Péron et de Charles-Alexandre Lesueur. Un autre regard sur l'expédition Baudin, Comité des travaux historiques et scientifique, , p. 74-77.
- F. Péron et C. A. Lesueur, Tableau des caractères génériques et spécifiques de toutes les espèces de méduses connues jusqu’à ce jour, Annales du muséum d’histoire naturelle, t.14, 1810, p. 325-366
- Jacqueline Goy, Les Méduses de François Péron et de Charles-Alexandre Lesueur : Un autre regard sur l'expédition Baudin, Comité des travaux historiques et scientifiques, , p. 79.
- Lustre-méduse au plafond du salon d'honneur du Musée océanographique
- (en) Guide to the Oceanographic Museum, Monaco, Musée océanographique de Monaco, , p. 47.
- (en) Sarah McFarland, Ryan Hediger, Animals and Agency. An Interdisciplinary Exploration, Brill, , p. 363.
- Jacqueline Goy, « Les paradoxes des méduses », Pour la science, no 299, , p. 26 et 42
- (en) Konstantin Khalturin et al., « Medusozoan genomes inform the evolution of the jellyfish body plan », Nature Ecology & Evolution, vol. 3, no 5, , p. 811–822 (DOI 10.1038/s41559-019-0853-y).
- Pierre-Paul Grassé, Zoologie, Gallimard, , p. 471.
- Jacqueline Goy et Anne Toulemont, Méduses, Musée océanographique, , p. 10.
- Jacqueline Goy, Anne Toulemont, Méduses, Musée océanographique, , p. 74.
- Jacqueline Goy, « Mystérieuses méduses », sur futura-sciences.com, .
- Catherine Desassis et Hélène Labousset-Piquet, Biologie fondamentale et génétique, Elsevier Masson, , p. 2
- Pierre Paul Grassé, Traité de zoologie, Masson, , p. 746.
- Jacqueline Goy, « Les paradoxes des méduses », Pour la Science, no 299, , p. 39.
- Claire Nouvian, Abysses, Fayard, , 202 p..
- Dominique Doumenc, Pierre-Paul Grassé et Jean Bouillon, Traité de zoologie, Masson, , p. 858.
- Rüdiger Wehner et Walter Gehring, Biologie et physiologie animales : bases moléculaires, cellulaires, anatomiques et fonctionnelles, De Boeck Supérieur, , p. 636-638.
- Stéphane Tanzarella, Perception et communication chez les animaux, De Boeck Supérieur, , p. 163-164.
- Jacqueline Goy, « Les paradoxes des méduses », Pour la Science, no 299, , p. 40
- (en) M.N. Arai, A Functional Biology of Scyphozoa, Springer Science & Business Media, , p. 207.
- (en) Stefano Piraino, Ferdinando Boero, Brigitte Aeschbach et Volker Schmid, « Reversing the Life Cycle: Medusae Transforming into Polyps and Cell Transdifferentiation in Turritopsis nutricula (Cnidaria, Hydrozoa) », Biological Bulletin, vol. 190, no 3, , p. 302 (DOI 10.2307/1543022, lire en ligne).
- Corinne Bussi-Copin et Jacqueline Goy, « L'ère annoncée des méduses », Pour la science, no 453, , p. 28.
- François Ramade, Dictionnaire encyclopédique des sciences de la nature et de la biodiversité, Dunod, , p. 577.
- « Les méduses prennent leurs aises dans les océans », sur 20minutes.fr, .
- (en) John H. Costello1,; Sean P. Colin, John O. Dabiri, « Medusan morphospace: phylogenetic constraints, biomechanical solutions, and ecological consequences », Invertebrate Biology, vol. 127, no 3, , p. 265–290 (DOI 10.1111/j.1744-7410.2008.00126.x, lire en ligne [PDF])
- Jacqueline Goy et Anne Toulemont, Méduses, Musée océanographique, , p. 108.
- Jacqueline Goy et Anne Toulemont, Méduses, Musée océanographique, , p. 28.
- Cycle de vie des scyphoméduses et des cuboméduses, tirée de « L'ère annoncée des méduses »
- Jacqueline Goy et Anne Toulemont, Méduses, Musée océanographique, , p. 40
- Jacques Ruffié, Le sexe et la mort, Odile Jacob, , p. 48-49
- (en) Frank Emil Moen et Erling Svensen, Marine Fish & Invertebrates of Northern Europe, Kom, , p. 57.
- Raymond Gilles, Physiologie animale, De Boeck Supérieur, , p. 340.
- (en) W. G. Gladfelter, « A comparative analysis of the locomotory systems of medusoid Cnidaria », Helgoländer wissenschaftliche Meeresuntersuchungen, vol. 25, nos 2–3, , p. 228–272 (DOI 10.1007/BF01611199, lire en ligne).
- La Grande encyclopédie, vol. 13, Larousse, , p. 7828.
- Frank Fish et George Lauder, « Des tourbillons pour mieux nager », Pour la science, no 448, , p. 46-52.
- (en) B. J. Gemmell et al, « Suction-based propulsion as a basis for efficient animal swimming », Nature Communications, vol. 6, no 8790, (DOI 10.1038/ncomms9790).
- Mouvements de la cloche Première (schémas a et b) et seconde poussée (schémas c et d), tiré de « L'efficacité de la nage des méduses expliquée ».
- Josh Fischman, « L'efficacité de la nage des méduses expliquée », sur pourlascience.fr, .
- Jacqueline Goy, « Les paradoxes des méduses », Pour la science, no 299, , p. 39
- (en) Susumu Ohtsuka, Kazuhiko Koike, Dhugal Lindsay, Jun Nishikawa, Hiroshi Miyake, Masato Kawahara, Nova Mujiono, Juro Hiromi, Hironori Komatsu, « Symbionts of marine medusae and ctenophores », Plank Benth Res, vol. 4, , p. 1–13 (DOI 10.3800/pbr.4.1).
- (en) Bryan Robert Davies, F. Gasse, African Wetlands and Shallow Water, IRD Editions, , p. 165
- (en) Garry Hamilton, « The secret lives of jellyfish », Nature.com, (lire en ligne).
- Il est ainsi possible d'élever des méduses en recueillant des polypes fixés sur une moule ou une huître. En les mettant dans un verre d'eau salée à 36 g/l, il est possible d'observer leur développement à la loupe. Cf « Devenez éleveur de méduses ! », Sciences Ouest, no 187, avril 2002, p. 21
- Pierre-Paul Grassé, Zoologie, Masson, , p. 171.
- Peter H Raven, Kenneth A Mason, Georges B Johnson, Jonathan B Losos, Susan R Singer, Biologie, De Boeck Superieur, , p. 653.
- H.W. Mianzan, N. Mari, B. Prenski et F. Sanchez, « Fish predation on neritic ctenophores from the Argentine continental shelf: a neglected food resource ? », Fisheries Research, vol. 27, , p. 69–79 (DOI 10.1016/0165-7836(95)00459-9)
- Pauly D, Graham WM, Libralato S, Morissette L, Palomares MLD, « Jellyfish in ecosystems, online databases, and ecosystem models », Hydrobiologia, vol. 616, , p. 67–85 (lire en ligne [PDF])
- (en) Jean‐Baptiste Thiebot, John PY Arnould, Agustina Gómez‐Laich, Kentaro Ito, Akiko Kato, Thomas Mattern, Hiromichi Mitamura, Takuji Noda, Timothée Poupart, Flavio Quintana, « Jellyfish and other gelata as food for four penguin species – insights from predator‐borne videos », Frontiers in Ecology and the Environment, vol. 15, no 8, , p. 437-441 (DOI 10.1002/fee.1529).
- K.A. Bjorndal, « Foraging ecology and nutrition of sea turtles », dans The Biology of Sea Turtles, édité par Peter L. Lutz et John A. Musick, (lire en ligne), p. 199–232
- Tomás J, Aznar FJ, Raga JA, « Feeding ecology of the loggerhead turtle Caretta caretta in the western Mediterranean », J Zool Lond, vol. 255, , p. 525–532 (lire en ligne)
- Revelles M, Cardona L, Aguilar A, Fernández G, « The diet of pelagic loggerhead sea turtles (Caretta caretta) of the Balearic archipelago (western Mediterranean): relevance of long-line baits », J Mar Biol Ass UK, vol. 87, , p. 805–813 (lire en ligne)
- Purcell JE, Shin-ichi U, Wen-Tseng L, « Anthropogenic causes of jellyfish blooms and their direct consequences for humans: a review », Mar Ecol Prog Ser, vol. 350, , p. 153–174 (lire en ligne [PDF])
- G.M. Daskalov GM, « Overfishing drives a trophic cascade in the Black Sea », Mar Ecol Prog Ser, vol. 225, , p. 53–63 (lire en ligne [PDF])
- Parsons TR (1995) The impact of industrial fisheries on the trophic structure of marine ecosystems. In: Polis GA, Winemiller KO, editors. Food Webs: Integration of Patterns and Dynamics. p. 352–357. Chapman & Hall, New York
- Harbison GR (1993) The potential of fishes for the control of gelatinous zooplankton. 10 p. International Council for the Exploration of the Sea, CM 199, ICES
- Richardson AJ, Bakun A, Hays GC, Gibbons MJ, « The jellyfish joyride: causes, consequences and management responses to a more gelatinous future », Trends Ecol Evol, vol. 24, , p. 312–322 (lire en ligne [PDF])
- J. Goy, P. Morand et M. Etienne, « Long-term fluctuations of Pelagia noctiluca (Cnidaria, Scyphomedusa) in the western Mediterranean Sea. Prediction by climatic variables. », Deep-Sea Res, vol. 36, , p. 269–279 (lire en ligne [PDF])
- Brodeur RD, Mills CE, Overland JE, Walters GE, Schumacher JD, « Evidence for a substantial increase in gelatinous zooplankton in the Bering Sea, with possible links to climate change », Fisheries Oceanography, vol. 8, , p. 296–306 (lire en ligne [PDF])
- L. Cardona, I. Álvarez de Quevedo, A. Borrell et A. Aguilar, « Massive Consumption of Gelatinous Plankton by Mediterranean Apex Predators », PLoS ONE, (lire en ligne)
- Reporterre, « Les méduses envahissent les océans malades », sur Reporterre, le quotidien de l'écologie (consulté le )
- (en) Lisa-ann Gershwin, Jellyfish : A Natural History, University of Chicago Press, , p. 166.
- Jean-Luc Goudet, « En bref : une déferlante de méduses dévaste un élevage de saumon irlandais », sur futura-sciences.com, .
- (en) Lisa-ann Gershwin (en), Jellyfish. A Natural History, University of Chicago Press, , p. 122.
- Marielle Court, « Les méfaits insoupçonnés des méduses », sur lefigaro.fr, .
- Suède: des méduses paralysent un réacteur nucléaire pendant trois jours
- (en) Andrew K. Sweetman, Craig R. Smith, Trine Dale et Daniel O. B. Jones, « Rapid scavenging of jellyfish carcasses reveals the importance of gelatinous material to deep-sea food webs », Proceedings of the Royal Society B, (DOI 10.1098/rspb.2014.2210)
- Andrew Sweetman, biologiste à l'Institut international de recherche de Stavanger (Norvège)
- A.K. Sweetman et A. Chapman, « First observations of jelly-falls at the seafloor in a deep-sea fjord », Deep Sea Research Part I: Oceanographic Research Papers, vol. 58, no 12, , p. 1206-1211 (DOI 10.1016/j.dsr.2011.08.006)
- Lebrato, M., Pitt, K. A., Sweetman, A. K., Jones, D. O., Cartes, J. E., Oschlies, A., ... & Lloris, D., « Jelly-falls historic and recent observations: a review to drive future research directions », Hydrobiologia, vol. 690, no 1, , p. 227-245 (lire en ligne)
- Jacqueline Goy, Anne Toulemont, Méduses, Musée océanographique, , p. 98.
- Pierre-Paul Grassé, Traité de zoologie. Anatomie, systématique biologie, Masson, , p. 272
- V. Pisani, F. Otero-Ferrer, S. Lotto, P. Maurel, J. Goy, « Lipkea ruspoliana Vogt, 1887, (Stauromedusa, Scyphozoa, Cnidaria) dans les aquariums du Musée Océanographique de Monaco », Bulletin de la Societe Zoologique de France, vol. 132, no 3, , p. 183-190.
- World Register of Marine Species, consulté le 13 janvier 2015
- (en) Richardson AJ, Bakun A, Hays GC, and Gibbons MJ. 2009. The jellyfish joyride: causes, consequences and management responses to a more gelatinous future. Trends Ecol Evol 24, p. 312–322
- Sylvie Rouat, « Les méduses, vigies des océans », sur sciencesetavenir.fr, .
- (en) William M Graham et al, « Linking human well-being and jellyfish:ecosystem services, impacts, and societal responses », Frontiers in Ecology and the Environment, vol. 12, no 9, , p. 515-523 (DOI 10.1890/130298, lire en ligne).
- (en) Xuezhen Wang, Huiliang Wang & Hugh R. Brown, « Jellyfish gel and its hybrid hydrogels with high mechanical strength », Soft Matter, vol. 7, no 1, , p. 211-219.
- (en) Amit Patwa, Alain Thiéry, Fabien Lombard, Martin K.S. Lilley, Claire Boisset, Jean-François Bramard, Jean-Yves Bottero & Philippe Barthélémy, « Accumulation of nanoparticles in “jellyfish” mucus: a bio-inspired route to decontamination of nano-waste », Scientific Reports, vol. 5, no 11387, (DOI 10.1038/srep11387).
- (en) Aki H. Ohdera1 et al., « Upside-Down but Headed in the Right Direction: Review of the Highly Versatile Cassiopea xamachana System », Front. Ecol. Evol., vol. 6, no 35, , p. 1-15 (DOI 10.3389/fevo.2018.00035).
- Jacqueline Goy, Les Miroirs de Méduse. Biologie et mythologie, Apogée, , p. 24.
- Jacqueline Goy et Anne Toulemont, Méduses, Musée océanographique, , p. 144.
- (en) Takuya Sugahara et al, « Immunostimulation Effect of Jellyfish Collagen », Bioscience, Biotechnology, and Biochemistry, vol. 70, no 9, , p. 2131-2137 (DOI 10.1271/bbb.60076).
- « Les méduses, ça pique mais ça peut aussi rajeunir la peau », sur lapresse.ca, .
- Janick Vigo, La mer et le littoral en Bretagne. Pour une ambition régionale, CESR de Bretagne, octobre 2001, p. 36
- (en) Se-Kwon Kim, Marine Pharmacognosy. Trends and Applications, CRC Press, , p. 351.
- Martine Valo, « La méduse, star des aquariums », sur lemonde.fr, .
- « Biotopes, le verre entre terre et mer », sur museeverre-tarn.com, .
- (en) Ferdinando Boero, Review of Jellyfish Blooms in the Mediterranean and Black Sea, Food and Agriculture Organization of the United Nations, , p. 27.
- (en) Makoto Omori, Eiji Nakano, « Jellyfish fisheries in southeast Asia », Hydrobiology, vol. 451, nos 1–3, , p. 19–26 (DOI 10.1023/A:1011879821323).
- (en) Minoru Kitamura, Makoto Omori, « Synopsis of edible jellyfishes collected from Southeast Asia, with notes on jellyfish fisheries », Plankton and Benthos Research, vol. 5, no 3, , p. 106-118 (DOI 10.3800/pbr.5.106).
- « L'été mystérieux à méduses », L'Humanité, (lire en ligne) et Le Point p. 63
- « Manger des méduses : une recommandation de l'ONU », Terrafemina, (lire en ligne)
- Julien Cartier, « Modéliser les différentes dynamiques d’un écosystème marin soumis à une perturbation anthropique », sur pedagogie.ac-nice.fr, .
- (en) J.P. Roux, C.D. van der Lingen, M.J. Gibbons, N.E. Moroff, L.J. Shannon, A.D.M. Smith et P. Cury, « Jellyfication of Marine Ecosystems as a Likely Consequence of Overfishing Small Pelagic Fishes: Lessons from the Benguela », Bulletin of Marine Science, vol. 89, no 1, , p. 249-284 (DOI 10.5343/bms.2011.1145)
- Philippe Cury et Daniel Pauly, Mange tes méduses ! : réconcilier les cycles de la vie et la flèche du temps, Paris, Éditions Odile Jacob, , 224 p. (ISBN 978-2-7381-2912-3)
- Wong, W. W., Chung, S. W., Kwong, K. P., Yin Ho, Y., & Xiao, Y. (2010) Dietary exposure to aluminium of the Hong Kong population. Food Additives and Contaminants, 27(4), 457-463 (résumé).
- (en) B. Nimorakiotakis & KD Winkel, « Marine envenomations: part 1 - jellyfish », Australian Family Physician, vol. 32, no 12, , p. 969-974.
- Frédéric Lewino, Tuez-vous les uns les autres. La vie et la mort chez nos amies les bêtes, Grasset, , p. 178.
- (en) A. Lotan, L. Fishman, Y. Loya & E. Zlotkin, « Delivery of nematocyst toxin », Nature, vol. 375, no 6531, , p. 456.
- (en) Timm Nüchter, Martin Benoit, Ulrike Engel, Suat Özbek, Thomas W. Holstein, « Nanosecond-scale kinetics of nematocyst discharge », Current Biology, vol. 16, no 9, , p. 316-318 (DOI 10.1016/j.cub.2006.03.089).
- Marine Van Der Kluft, « Piqûre de méduse : uriner dessus est-il vraiment conseillé? », sur lefigaro.fr, .
- (en) Peter J. Fenner, Joseph W. Burnett, Jacqueline F. Rifkin, Venomous and Poisonous Marine Animals : A Medical and Biological Handbook, University of New South Wales Press, , p. 63-306.
- Philippe Queruel et al., « Envenimations par la méduse Pelagia noctiluca sur nos côtes méditerranéennes », Presse Med, no 29, , p. 188.
- (en) G. Peca et al., « Contact reactions to the jellyfish Carybdea marsupialis: observation of 40 cases », Contact Dermatitis, vol. 36, no 3, , p. 124-126 (DOI 10.1111/j.1600-0536.1997.tb00392.x).
- Pierre Paul Grassé, Traité de zoologie, Masson, , p. 915.
- (en) David R. Boulware, « A randomized, controlled field trial for the prevention of jellyfish stings with a topical sting inhibitor », Journal of Travel Medicine, vol. 13, no 3, , p. 166 (DOI 10.1111/j.1708-8305.2006.00036.x).
- (en) Peter J. Fenner et John A. Williams, « Worldwide deaths and severe envenomations from jellyfish stings », The Australian Medical Journal, vol. 165, , p. 658-666 (PMID 8985452).
- Une méthode traditionnelle, uriner sur une piqûre de méduse, est déconseillée en raison du risque de surinfection. Cf (en) Louise Montgomery, Jan Seys & Jan Mees, « To Pee, or Not to Pee: A Review on Envenomation and Treatment in European Jellyfish Species », Marine Drugs, vol. 14, no 7, , p. 127.
- (en) J. W. Burnett & G. J. Calton, « Jellyfish envenomation syndromes updated », Ann. Emerg. Med., vol. 16, no 9, , p. 1000–1005 (DOI 10.1016/s0196-0644(87)80748-5).
- (en) Brad L. Bennett PhD, Paramedic, MFAWM, Kirsten B. Hornbeak MD, « Avoid jellyfish sting treatment misinformation: Up-to-date first aid recommendations », sur wms.org.
- (en) Burnett, J. W., 1989. Treatment of jellyfish stings. In C. L. Ownby & G. V. Odell (eds), Natural Toxins. Characterization, Pharmacology and Therapeutics. Proceedings of the 9th World Congress on Animal, Plant and Microbial Toxins. Pergamon Press, N.Y.: 160–164
- (en) Robert S. Tomchik, Mary T. Russell, Alina M. Szmant et al, « Clinical Perspectives on Seabather's Eruption, Also Known as 'Sea Lice' », JAMA, vol. 269, no 13, , p. 1669-1672 (DOI 10.1001/jama.1993.03500130083037).
- Jacqueline Goy, Anne Toulemont, Méduses, Musée océanographique, , p. 112.
- Martine Valo, « Filets, produits chimiques, robots hacheurs… face aux méduses, un combat inégal », Le Monde, .
- (en) Kylie A. Pitt, Cathy H. Lucas, Jellyfish Blooms, Springer Science & Business Media, , p. 198.
- (en) Pamela Nagami, Bitten : Bites and Stings from Around the World, Fusion, , p. 54.
- (en) M. R. Gordon, J. E. Seymour, « Quantifying movement of the tropical Australian cubozoan Chironex fleckeri using acoustic telemetry », Hydrobiologia, vol. 616, no 1, , p. 87–97 (DOI 10.1007/s10750-008-9594-7).
- (en) Kylie A. Pitt, Jennifer E. Purcell, Jellyfish Blooms: Causes, Consequences and Recent Advances, Springer Science & Business Media, , p. 86-97.
- Martine Valo, « Filets, produits chimiques, robots hacheurs… face aux méduses, un combat inégal », sur lemonde.fr, .