Anémone de mer
Actiniaria

Les Actiniaria, aussi appelées anémones de mer, orties de mer ou encore actiniaires sont un ordre d'animaux marins au corps mou et très musclé, généralement fixés à un support.
Ce sont des cnidaires anthozoaires. L'anémone est constituée d'un polype solitaire à symétrie radiaire, sans squelette calcaire. Souvent ornées de couleurs vives, ces organismes développent de nombreux tentacules péribuccaux pourvus de cellules urticantes très vulnérantes. Leur symétrie, leurs couleurs et leurs tentacules qui évoquent les pétales d'une fleur, leur ont donné le nom vernaculaire d'anémone.
Description et caractéristiques



_-_Harry's_Hole_Reef%252C_Soto%252C_Cura%C3%A7ao_Netherland_Antilles.jpg.webp)

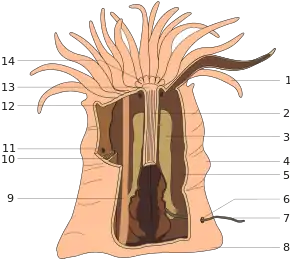
Ce sont des polypes solitaires sans stade méduse, dépourvus d'exosquelette et dont la taille atteint de 1,25 cm à presque 2 m de diamètre. Les tentacules, habituellement nombreux, ont des nématocystes au poison urticant — mais seules certaines espèces sont douloureuses pour l'Homme — et des spirocystes[5]. Ils sont disposés en séries radiaires ou en cycles alternatifs qui sont étroitement liés à la disposition des mésentères.
Leur anatomie montre un pied qui s'ancre dans le sable ou s'attache sur des substrats durs par adhésion, comme une ventouse, surmonté d'un corps d'où rayonnent des tentacules lisses, pointus ou arrondis, disposés en un ou plusieurs cercles concentriques autour de la cavité buccale. Cette dernière est un orifice qui se trouve en position centrale, qui sert à la fois de bouche mais qui joue aussi le rôle d'anus[6]. Aucune anémone n'a de squelette calcaire, contrairement aux coraux[7], et leur symétrie fondamentale est hexaradiaire (symétrie centrale d'ordre 6, qui s'observe notamment au niveau du nombre des tentacules qui est un multiple de six)[6].
La cavité stomacale et la cavité du corps se confondent en un seul sac appelé cavité gastro-vasculaire qui assure une première phase de digestion extracellulaire (en) suivie par une phase finale de digestion intracellulaire. Cette cavité digestive s'ouvre à l'extérieur par un pharynx qui est une zone ectodermique invaginée. Le pharynx est parcouru par une gouttière longitudinale ciliée, le siphonoglyphe, qui assure la circulation de courants d'eau vers cette cavité, participant à la respiration, au maintien de la pression interne et à l'ingestion de particules alimentaires[8].
 Une anémone caractéristique, avec les tentacules entourant la bouche.
Une anémone caractéristique, avec les tentacules entourant la bouche.
 Le siphonoglyphe peut former une projection charnue et lobée autour de la bouche, appelée la conchula.
Le siphonoglyphe peut former une projection charnue et lobée autour de la bouche, appelée la conchula.
 Une anémone plus complexe (Actinoscyphia aurelia).
Une anémone plus complexe (Actinoscyphia aurelia). La grosse anémone tropicale Heteractis magnifica peut se refermer comme un sac pour protéger ses organes des menaces.
La grosse anémone tropicale Heteractis magnifica peut se refermer comme un sac pour protéger ses organes des menaces. Actinia equina est une des espèces les plus fréquentes du littoral français métropolitain.
Actinia equina est une des espèces les plus fréquentes du littoral français métropolitain.
Malgré des ressemblances certaines, les anémones ne doivent pas être confondues avec les autres groupes de cnidaires sessiles mous : Alcyonacea, zoanthides, corallimorphes et autres.
Biologie et comportement
Les anémones sont pour la plupart sédentaires, mais peuvent aussi se déplacer par glissement sur le fond et certaines peuvent même se déraciner brusquement et nager en cas d'attaque. En cas d'agression, certaines anémones de mer sont capables de projeter des filaments blancs urticants, appelés aconties. Ces filaments ont des effets semblables à ceux des méduses pour l'homme.
Les anémones de mer hébergent dans leurs tentacules des algues unicellulaires, des zooxanthelles endosymbiotiques, qui métabolisent l'énergie lumineuse en énergie exploitable par l'organisme (comme le corail) : une grande partie de leur énergie est d'origine solaire. De façon opportuniste, elles complètent leur menu à l'aide de plancton, de crevettes ou de petits poissons attrapés grâce à leurs tentacules, lesquels apportent ensuite la proie à l'orifice buccal pour la digestion, dans une cavité stomacale centrale. Les excréments sortent du corps par le même orifice[7].
On connaît relativement peu de prédateurs des anémones de mer, les plus voraces étant sans doute les tortues de mer. Cependant, certains mollusques comme le nudibranche Aeolidia papillosa sont aussi spécialisés dans la consommation d'anémones.
Les anémones de mer se reproduisent sexuellement ou par multiplication asexuée.
Symbioses et mutualismes
Comme de nombreux autres cnidaires, les anémones de mer ont développé une symbiose avec les zooxanthelles de leurs tentacules, les zooxanthelles assurant la majorité des apports énergétiques nécessaires à la croissance et à la survie de leur hôte, notamment en sucres.
Une étude d'avril 2021 montre que les anémones de mer opèrent un tri entre les zooxanthelles et les autres microalgues : les secondes ne sont pas détruites, mais rejetées dans la nature par le système immunitaire des cellules infectées, alors que la réponse immunitaire est inhibée spécifiquement en présence des zooxanthelles[11] - [12].
Quelques anémones de mer vivent également en mutualisme avec d'autres organismes, protégés contre leurs cellules urticantes par une carapace épaisse ou un mucus protecteur (notamment les poissons-clowns[13]). On y trouve ainsi des bernard-l'hermite (comme le « pagure à anémones » Dardanus deformis), les poissons-clowns, ou certaines petites crevettes, telle la Thor amboinensis[14]. Des symbioses plus complexes peuvent aussi avoir lieu, comme avec le crabe boxeur Lybia tessellata, qui porte en permanence une anémone (Boloceractis prehensa) dans chacune de ses pinces et les agite devant lui pour se défendre[15].
 Le crabe porcelaine (Neopetrolisthes maculatus) vit dans les anémones.
Le crabe porcelaine (Neopetrolisthes maculatus) vit dans les anémones. La crevette Thor amboinensis dans une Heteractis aurora.
La crevette Thor amboinensis dans une Heteractis aurora. Le poisson-clown des Maldives (Amphiprion nigripes) vit en association exclusive avec l'anémone Heteractis magnifica.
Le poisson-clown des Maldives (Amphiprion nigripes) vit en association exclusive avec l'anémone Heteractis magnifica. Le bernard-l'hermite à anémones (Dardanus deformis) cultive des anémones toxiques sur sa coquille pour décourager les prédateurs.
Le bernard-l'hermite à anémones (Dardanus deformis) cultive des anémones toxiques sur sa coquille pour décourager les prédateurs. Le crabe-boxeur (Lybia tessellata) impressionne ses prédateurs grâce aux anémones venimeuses qu'il brandit.
Le crabe-boxeur (Lybia tessellata) impressionne ses prédateurs grâce aux anémones venimeuses qu'il brandit.
Menaces
Les anémones de mer, comme les coraux, blanchissent sous l'effet du réchauffement climatique et elles dépérissent aussi à cause de la pollution et de la surpêche[16].
Classification
La classification des anémones a été entièrement revue en 2014 par Rodríguez & Daly[17] : seuls deux sous-ordres sont désormais reconnus, l'essentiel des familles modernes étant comprises dans celui des Enthemonae, divisée en trois super-familles, dont une monotypique. Cette classification se substitue à celle héritée de Carlgren (début du XXe siècle), qui divisait les anémones en quatre sous-ordres (Endocoelantheae, Nyantheae - de loin le plus vaste -, Protantheae et Ptychodacteae)[18].
Les Actiniarias comprennent environ 1 200 espèces[19].

_in_Heteractis_magnifica_(Sea_anemone).jpg.webp)

Selon World Register of Marine Species (5 janvier 2017)[18] :
- sous-ordre Anenthemonae Rodríguez & Daly in Rodríguez et al., 2014
- super-famille Actinernoidea Stephenson, 1922
- famille Actinernidae Stephenson, 1922
- famille Halcuriidae Carlgren, 1918
- super-famille Edwardsioidea Andres, 1881
- famille Edwardsiidae Andres, 1881
- super-famille Actinernoidea Stephenson, 1922
- sous-ordre Enthemonae Rodríguez & Daly in Rodríguez et al., 2014
- super-famille Actinioidea Rafinesque, 1815
- famille Actiniidae Rafinesque, 1815
- famille Actinodendridae Haddon, 1898
- famille Aurelianiidae Andres, 1883
- famille Capneidae Gosse, 1860
- famille Condylanthidae Stephenson, 1922
- famille Haloclavidae Verrill, 1899
- famille Homostichanthidae
- famille Iosactinidae Riemann-Zürneck, 1997
- famille Limnactiniidae Carlgren, 1921
- famille Liponematidae Hertwig, 1882
- famille Minyadidae Milne Edwards, 1857
- famille Oractiidae Riemann-Zürneck, 2000
- famille Phymanthidae Andres, 1883
- famille Preactiniidae England in England & Robson, 1984
- famille Ptychodactinidae Appellöf, 1893
- famille Stichodactylidae Andres, 1883
- famille Stoichactidae Carlgren, 1900
- famille Thalassianthidae Milne Edwards, 1857
- super-famille Actinostoloidea Carlgren, 1932
- famille Actinostolidae Carlgren, 1932
- super-famille Metridioidea Carlgren, 1893
- famille Acontiophoridae Carlgren, 1938
- famille Actinoscyphiidae Stephenson, 1920
- famille Aiptasiidae Carlgren, 1924
- famille Aiptasiomorphidae Carlgren, 1949
- famille Aliciidae Duerden, 1895
- famille Andresiidae Stephenson, 1922
- famille Andvakiidae Danielssen, 1890
- famille Antipodactinidae Rodríguez, López-González & Daly, 2009
- famille Bathyphelliidae Carlgren, 1932
- famille Diadumenidae Stephenson, 1920
- famille Exocoelactinidae Carlgren, 1925
- famille Gonactiniidae Carlgren, 1893
- famille Halcampidae Andres, 1883
- famille Haliactinidae Carlgren, 1949
- famille Hormathiidae Carlgren, 1932
- famille Isanthidae Carlgren, 1938
- famille Kadosactinidae Riemann-Zürneck, 1991
- famille Metridiidae Carlgren, 1893
- famille Nemanthidae Carlgren, 1940
- famille Nevadneidae Carlgren, 1925
- famille Octineonidae Fowler, 1894
- famille Sagartiidae Gosse, 1858
- famille Sagartiomorphidae Carlgren, 1934
- super-famille Actinioidea Rafinesque, 1815
- Actiniaria incertae sedis
- famille Antheidae Gosse, 1860
- famille Antheomorphidae Hertwig, 1882
- famille Iosactiidae Riemann-Zürneck, 1997
- famille Sarcophinanthidae Andres, 1883
- + de nombreux genres encore non assignés.
.jpg.webp)
 Actinodendron arboreum, une Actinodendronidae
Actinodendron arboreum, une Actinodendronidae
 Actinostola sp., une Actinostolidae
Actinostola sp., une Actinostolidae Aiptasia mutabilis, une Aiptasiidae
Aiptasia mutabilis, une Aiptasiidae Alicia pretiosa, une Aliciidae
Alicia pretiosa, une Aliciidae Boloceroides mcmurrichi, une Boloceroididae
Boloceroides mcmurrichi, une Boloceroididae Diadumene cincta, une Diadumenidae
Diadumene cincta, une Diadumenidae
.jpg.webp) Protanthea simplex, une Gonactiniidae
Protanthea simplex, une Gonactiniidae Haliplanella lineata, une Haliplanellidae
Haliplanella lineata, une Haliplanellidae Peachia quinquecapitata, une Haloclavidae
Peachia quinquecapitata, une Haloclavidae.jpg.webp) Amphianthus sp., une Hormathiidae
Amphianthus sp., une Hormathiidae Isanthus capensis, une Isanthidae
Isanthus capensis, une Isanthidae Telmatactis cricoides, une Isophelliidae
Telmatactis cricoides, une Isophelliidae Liponema brevicorne, une Liponematidae
Liponema brevicorne, une Liponematidae
 Nemanthus annamensis, une Nemanthidae
Nemanthus annamensis, une Nemanthidae Phymanthus pulcher, une Phymanthidae
Phymanthus pulcher, une Phymanthidae Preactis millardae, une Preactiidae
Preactis millardae, une Preactiidae Sagartia elegans, une Sagartiidae
Sagartia elegans, une Sagartiidae
.jpeg.webp)
Annexes
Bibliographie
- (de) Richard Hertwig, Die Actinien der Challenger-Expedition, Iéna, Gustav Fisher, (lire en ligne)
Liens externes
- (en) Référence World Register of Marine Species : taxon Actiniaria (+ liste familles + liste genres)
- (en) Référence Paleobiology Database : Actiniaria
- (fr+en) Référence ITIS : Actiniaria
- (en) Référence Tree of Life Web Project : Actiniaria
- (en) Référence Animal Diversity Web : Actiniaria
- (en) Référence Catalogue of Life : Actiniaria (consulté le )
- (en) Référence NCBI : Actiniaria (taxons inclus)
- (en) Référence uBio : site déclaré ici indisponible le 7 avril 2023
Notes et références
- Feuillet tissulaire longitudinal. Les mésentères, disposés de manière radiaire, sont des cordons musculaires qui compartiment la cavité gastrovasculaire et maintiennent la base des tentacules et le pharynx en place en conservant au corps sa forme malgré la pression interne de l'eau.
- Cette sole pédieuse a une double fonction : fixation (disque pédieux formant ventouse par le jeu conjugué d'une musculature importante et de la sécrétion de mucus) et locomotion (lente reptation grâce aux contractions des cellules musculaires du disque basal). Une fois ce disque détaché, les anémones peuvent glisser sur leur substrat (voire se déplacer en pleine eau comme l'anémone des gorgones (en)).
- Le polype se tient normalement bien épanoui, mais en cas de dérangement, ce muscle leur permet de se rétracter pour devenir moins apparent.
- (en) Shah Pinal D., Thakkar Nevya J., Tailor Parth A, Mankodi Pradeep C., « Surveillance of Gravel Attached Sea Anemone », Research Journal of Marine Sciences, vol. 3, no 3, , p. 1-2.
- (en) J. Malcolm Shick, A Functional Biology of Sea Anemones, Springer, , p. 64-65.
- « Anémones », sur DORIS.
- Joël Ignasse, « Anémone de mer : moitié animal, moitié plante », .
- (en) Cleveland P. Hickman, Larry S. Roberts, Frances Miller Hickman, Biology of Animals, , p. 390.
- Ces pseudo-tentacules sont des expansions du disque oral. Se ramifient de façon dichotome en formant des rameaux aplatis, foisonnants, qui masquent la bouche et la colonne, elles portent des acrocystes (capsules bourrées de cellules urticantes).
- Épibiose sur certaines algues rouges et brunes (Laminaires), sur les tubes de spirographe, grâce à des spirocystes.
- (en) Marie R. Jacobovitz, Sebastian Rupp, Philipp A. Voss et Ira Maegele, « Dinoflagellate symbionts escape vomocytosis by host cell immune suppression », Nature Microbiology, vol. 6, no 6, , p. 769–782 (ISSN 2058-5276, DOI 10.1038/s41564-021-00897-w, lire en ligne, consulté le )
- « L’anémone de mer met à la porte les microalgues indésirables », Le Monde.fr, (lire en ligne, consulté le )
- « Poisson-clown et anémone de mer », sur aquarium-portedoree.fr.
- Thor amboinensis, sur Aquaportail.com
- Philippe Bourjon, « Lybia tesselata », sur SousLesMers.
- Florian Bardou, « Les poissons-clowns menacés par la destruction de leur habitat », sur liberation.fr, Libération,
- (en) E. Rodriguez et al., « Hidden among Sea Anemones: The First Comprehensive Phylogenetic Reconstruction of the Order Actiniaria (Cnidaria, Anthozoa, Hexacorallia) Reveals a Novel Group of Hexacorals », PLOS One, (DOI https://dx.doi.org/10.1371/journal.pone.0096998, lire en ligne).
- World Register of Marine Species, consulté le 5 janvier 2017
- (en) MARYMEGAN DALY, MERCER R. BRUGLER, PAULYN CARTWRIGHT, ALLEN G. COLLINS, MICHAEL N. DAWSON, DAPHNE G. FAUTIN, SCOTT C. FRANCE, CATHERINE S. MCFADDEN, DENNIS M. OPRESKO, ESTEFANIA RODRIGUEZ, SANDRA L. ROMANO & JOEL L. STAKE, « The phylum Cnidaria: A review of phylogenetic patterns and diversity 300 years after Linnaeus* »