Poisson
Les poissons sont des animaux vertébrés aquatiques à branchies, pourvus de nageoires dont le corps est généralement couvert d'écailles. On les trouve abondamment aussi bien dans les eaux douces, saumâtres et de mers : on trouve des espèces depuis les sources de montagnes (omble de fontaine, goujon) jusqu'au plus profond des mers et océans (grandgousier, poisson-ogre). Leur répartition est toutefois très inégale : 50 % des poissons vivraient dans 17 % de la surface des océans[1] (qui sont souvent aussi les plus surexploités).
l'appellation « Poisson » s'applique en français à plusieurs taxons distincts.

Taxons concernés
Articles connexes
- Pisciculture
- Piscivore
- Liste de noms vernaculaires de poisson
L'étude des poissons
- Liste d'ichtyologistes
- Chronologie de l'ichtyologie
Ils ont un rôle fondamental pour les humains :
- en tant que nourriture, les poissons sont partout dans le monde ; qu'ils soient pêchés dans la nature ou élevés en pisciculture ;
- ils sont aussi exploités à des fins récréatives, avec la pêche et l'aquariophilie, et sont parfois exposés dans de grands aquariums publics ;
- ils jouent et ont joué un rôle significatif dans de nombreuses cultures, en tant que déités et symboles religieux, ou sujets de contes, légendes, livres et films ;
- en jouant un rôle écosystémique important ;
- en contribuant aux cycles biogéochimiques, dont le cycle du carbone et en particulier en contribuant au puits de carbone océanique[1].
Dans la classification phylogénétique[2], obtenue par application des méthodes cladistiques, les poissons forment un groupe paraphylétique de vertébrés, donc non reconnu, car il exclut les tétrapodes (vertébrés terrestres). La super-classe des Poissons (les Pisces) de la classification classique n'est reconnue que par certains systématiciens évolutionnistes[3]. Les espèces actuelles (non-éteintes) de poissons sont réparties dans les taxons Pétromyzontides (lamproies), Chondrichtyens (les raies, les requins et les chimères), Actinoptérygiens (les plus communs), Sarcoptérygiens (Dipneustes et Actinistiens). On y associe parfois les Myxinoïdes.
Le premier inventaire ichtyologique de France semble être celui de Pierre Belon, en 1555, intitulé La nature et la diversité des poissons avec leurs pourtraicts représentés au plus près du naturel[4].
Définition et classification
Étymologie
Le substantif masculin[5] - [6] - [7] « poisson » (prononcé : [pwasɔ̃] en français standard)[6] est issu, par l'intermédiaire de l'ancien français peis, pois, du latin piscis, de même sens[5] - [6].
Définition
Le terme « poisson » est plus précisément employé pour désigner les crâniates non tétrapodes, c'est-à-dire des animaux avec un crâne cartilagineux ou osseux qui protège la partie antérieure du système nerveux, possédant des branchies toute leur vie et qui peuvent posséder des nageoires, mais pas de « pattes »[8]. Les poissons ne forment pas un groupe phylogénétiquement homogène, à l'inverse des oiseaux ou des mammifères (voir plus bas).
Un poisson typique est « à sang froid » ; il possède un corps allongé lui permettant de nager rapidement ; il extrait le dioxygène de l'eau en utilisant ses branchies ou un organe respiratoire annexe lui permettant de respirer le dioxygène atmosphérique ; il possède deux paires de nageoires, les nageoires pelviennes et latérales, habituellement une ou deux (plus rarement trois) nageoires dorsales, une nageoire anale et une nageoire caudale; il possède une double mâchoire pour les gnathostomes et simple pour les agnathes ; il possède une peau généralement recouverte d'écailles ; ovipare, il pond des œufs et la fécondation peut être interne ou externe.

Chacune de ces caractéristiques comporte toutefois des exceptions. Les thons, les espadons et certaines espèces de requins sont entre sang chaud et sang froid, et peuvent élever leur température corporelle au-dessus de celle de l'eau ambiante[9]. Et de la même façon, la lampris-lune semble être un cas unique de poisson à sang chaud. La forme du corps et les performances natatoires varient considérablement, des nageurs très rapides capables de parcourir dix à vingt longueurs de leur corps par seconde (thons, saumons) aux poissons très lents mais mieux manœuvrants (comme les anguilles ou les raies) qui ne dépassent pas 0,5 longueur par seconde[10]. Plusieurs groupes de poissons d'eau douce extraient le dioxygène de l'air comme de l'eau en utilisant des organes variés. Les dipneustes possèdent deux poumons similaires à ceux des tétrapodes ; les gouramis ont un « organe labyrinthe » qui fonctionne de la même manière ; les Corydoras extraient le dioxygène par l'estomac ou l'intestin[11]. La forme du corps et la position des nageoires varient énormément, comme en témoigne la différence entre les hippocampes, les lophiiformes, les poissons globes ou les saccopharyngiformes. De même, la surface de la peau peut être nue (murènes) ou couverte d'écailles de différents types : placoïdes (requins et raies), cosmoïdes (cœlacanthes), ganoïdes, cycloïdes et cténoïdes[12]. Certains poissons passent même davantage de temps hors de l'eau que dedans, comme les périophthalmes qui se nourrissent et interagissent entre eux sur des terrains boueux et ne retournent dans l'eau que pour se cacher dans leur terrier[13]. Certaines espèces peuvent être ovovivipares ou vivipares.
La taille d'un poisson varie du requin baleine de 16 m au Schindleria brevipinguis d'à peine 8 mm.
Quelques espèces de poisson dulçaquicole disposent de poumons, si les Erythrinus de l'Amazone extraient 50 % du dioxygène dont ils ont besoin avec ceux-ci, les poumons sont l'unique moyen de respiration des Arapaima gigas ou des gymnotes.
Terminologie
Plusieurs types d'animaux aquatiques sont communément appelés « poissons » mais n'en sont pas vis-à-vis de la définition précédente.
Les termes relatifs aux poissons viennent de différentes racines :
- poisson se dit piscis (pisces au pluriel) en latin, d'où la pisciculture, piscivore, etc. ;
- poisson se dit ἰχθύς / ikhthýs en grec ; l'Académie française a simplifié le groupe chth en cht en 1878 mais l'on retrouve le groupe complet en anglais par exemple ; d'où l'ichtyologie, Ichtus, l'ichtyocolle, etc.
Classification
À l'opposé des groupes tels que les oiseaux ou les mammifères, les poissons ne forment pas un clade : le groupe est paraphylétique, c'est-à-dire qu'il ne comporte pas tous les descendants de leur ancêtre commun[14] - [15] - [16]. Pour cette raison, la « super-classe Pisces » n'est plus utilisée en classification phylogénétique, chaque clade devant comporter tous les descendants du même ancêtre, ce qui amènerait à y adjoindre les Tétrapodes. Elle est par contre conservée dans certaines classifications évolutionnistes modernes[3].
Les poissons sont classés dans les groupes principaux suivants (en grisé et précédés de l'obèle « † », les taxons éteints) :
- Infra-embranchement des Agnathes ou Cyclostomes, (vertébrés sans mâchoires)
- Classe Hyperoartia (Hyperoartiens : poissons sans mâchoires)
- Ordre des Petromyzontiformes (lamproies)
- groupe des †Ostracodermes (terme qui regroupe les classes éteintes de poissons sans mâchoires)
- Classe †Pteraspidomorphi GOODRICH, 1909 (Ptéraspidomorphes, poissons primitifs sans mâchoires)
- Sous-classe †Heterostraci LANKESTER, 1868 (Hétérostracés, poissons primitifs sans mâchoires, Ordovicien → Dévonien)
- Sous-classe †Astrapida BERG, 1940 (Astrapides, poissons primitifs sans mâchoires, Ordovicien → Dévonien)
- Sous-classe †Arandaspida RITCHIE et GILBERT-THOMLINSON, 1977 (Arandaspides, poissons primitifs sans mâchoires, Ordovicien)
- Classe †Anaspida TRAQUAIR, 1899 (poissons primitifs sans mâchoires, Silurien → Dévonien supérieur)
- Classe †Thelodonti JAECKEL, 1911 (poissons primitifs sans mâchoires, Ordovicien → Dévonien)
- Classe †Cephalaspidomorphi GOODRICH, 1909 (Céphalaspidomorphes : poissons sans mâchoires à cuirasse articulée)
- Sous-classe †Osteostraci LANKESTER, 1868 (Ostéostracés : poissons à cuirasse ossifiée, Silurien moyen → Dévonien supérieur)
- Sous-classe †Galeaspida LIU, 1965 (Galéaspidés, poissons avec bouclier céphalique en forme de heaume, Silurien → Dévonien)
- Sous-classe †Pituriaspida (Pituriaspides, poissons cuirassés de "Pituri", Queensland, Australie, Dévonien moyen)
- Classe †Pteraspidomorphi GOODRICH, 1909 (Ptéraspidomorphes, poissons primitifs sans mâchoires)
- Classe Hyperoartia (Hyperoartiens : poissons sans mâchoires)
- Infra-embranchement des Gnathostomes (vertébrés à mâchoires)
- Classe †Placodermi (Placodermes : poissons à cuirasse articulée)
- Classe †Acanthodii (Acanthodiens : requins épineux)
- Classe Chondrichthyes (Chondrichtyens : poissons cartilagineux : requins et les raies)
- Superclasse Osteichthyes (Ostéichthyens : poissons osseux)
- Classe Actinopterygii (Actinoptérygiens : poissons à nageoires rayonnées)
- Classe Sarcopterygii (Sarcoptérygiens : poissons à nageoires charnues)
- Sous-classe Coelacanthimorpha (cœlacanthes)
- Sous-classe Dipnoi (dipneustes)
Certains paléontologues considèrent que les conodontes sont des chordés et les considèrent comme des poissons primitifs ; voir l'article Vertébré.
Les différents groupes de poissons pris tous ensemble comprennent plus de la moitié des vertébrés connus. Il y a près de 28 000 espèces de poissons existantes (sans compter les espèces disparues), dont près de 27 000 poissons osseux, le reste étant formé d'environ 970 requins, raies et chimères et environ 108 lamproies et myxines[17]. Un tiers de toutes ces espèces est renfermé dans les neuf plus grandes familles, qui sont (des plus grandes aux plus petites) : Cyprinidae, Gobiidae, Cichlidae, Characidae, Loricariidae, Balitoridae, Serranidae, Labridae, et Scorpaenidae. D'un autre côté, environ 64 familles sont monotypiques (ne contiennent qu'un seul genre, parfois monospécifique). On suppose que le nombre total d'espèces de poissons en existence serait de 32 500[17].
Génomique
Les poissons contemporains sont les vertébrés chez lesquels on observe les plus grands et les plus petits génomes (parmi les vertébrés), phénomène qui a une « signification évolutive » encore incomprise[18]. Le génome est plus petit chez les poissons à nageoires à rayons que chez les poissons cartilagineux, hormis chez les polyploïdes (qui explique en grande partie les variations de taille de génome au sein de ces deux groupes)[18]. Le génome des poissons d'eau douce (et eurybiontes) est plus grand que celui des espèces apparentées marines et sténobiontes[18]. Les différences de taille de génome ne semblent pas liées au taux métabolique propre à l'espèce mais elles sont positivement corrélées avec la taille des œufs, ce qui peut évoquer un lien avec l'évolution des soins parentaux[18].
Évolution

Dans un contexte évolutif, l'ensemble des taxons désignés par le terme poisson n'est plus considéré homogène, ces taxons ayant des histoires évolutives différentes et formant donc différents clades[2].
Certains pensent que les poissons ont évolué à partir d'une créature du type ascidie (dont les larves ont des ressemblances avec les poissons primitifs) ; les premiers ancêtres des poissons auraient alors conservé leur forme larvaire à l'état adulte par néoténie, mais l'inverse est aussi possible. Les fossiles candidats au statut de « premier poisson » connus sont Haikouichthys, Myllokunmingia et Pikaia.
Les tout premiers fossiles de poissons ne sont guère nombreux, ni de bonne qualité : peut-être les poissons primitifs étaient-ils rares ou mal fossilisables ou les conditions taphonomiques mauvaises. Cependant, le poisson devint une des formes de vie dominantes du milieu aquatique et a donné naissance aux branches évolutives menant aux vertébrés terrestres comme les amphibiens, les reptiles et les mammifères.
L'apparition d'une mâchoire articulée semble être la raison majeure de la prolifération ultérieure des poissons, car le nombre d'espèces de poissons agnathes devint très faible. Les premières mâchoires ont été trouvées dans les fossiles de placodermes. On ignore si le fait de posséder une mâchoire articulée procure un avantage, par exemple pour la préhension ou la respiration.
Les poissons ont aussi coévolué avec d'autres espèces (prédateurs, pathogènes et parasites notamment, mais aussi parfois des espèces symbiotes). Durant leurs migrations (longues et sur de longues distances pour les saumons et lamproies, et plus encore pour les anguilles), ils peuvent transporter (dispersion) un certain nombre de propagules d'autres organismes (ectoparasitisme, endozoochorie, œufs viables non digérés[19], etc.).
Agnathes
Les agnathes regroupent des animaux à corde dorsale et à crâne, mais sans mâchoires. Leur vie en milieu aquatique les a fait longtemps classer parmi les poissons.
La monophylie des agnathes actuels est débattue[20] - [21] - [3] :
- les myxines, font ou ne font pas partie des vertébrés selon la phylogénie retenue ;
- les lamproies, sont indéniablement des vertébrés.
La plupart des études récentes basées sur les comparaisons de séquences d'ADN soutiennent que les myxines et les lamproies sont étroitement apparentées. On parlera alors du groupe des cyclostomes[20].
Les myxines et lamproies partagent des caractères morphologiques ancestraux à tous les craniés, qui sont perdus chez les gnathostomes. Leur bouche rudimentaire, qui se comporte comme une ventouse, ne possède pas de mâchoires, et ne peut donc pas modifier son ouverture. Leur squelette est cartilagineux et composé d'une capsule crânienne et d'une colonne vertébrale sans côtes.
Si les agnathes actuels sont peu nombreux, de nombreux fossiles d'agnathes sont présents dans les sédiments du paléozoïque. Les agnathes furent les tout premiers crâniates à apparaître.
Certains agnathes fossiles, comme les ostéostracés sont plus proches parents des vertébrés à mâchoire que des lamproies et myxines. Par exemple, ils possèdent des membres pairs (nageoires pectorales) à la différence de ces dernières[20].
Les conodontes sont un type d'agnathes préhistoriques ayant développé des "dents" sans avoir jamais développé de machoires.
Poissons cartilagineux (Chondrichtyens)

Chez les Chondrichthyens, aussi appelés « poissons cartilagineux », il n'y a globalement pas d'ossification endochondrale. Le squelette est donc très majoritairement composé de cartilage, et pas d'« os vrai »[2]. On peut y trouver les différentes espèces de requins, de raies et de chimères. Il faut ajouter que les « os vrais » peuvent tout de même être observés chez les Chondrichtyens, mais en petite quantité[22]. La généralisation de l'os enchondral ne se trouvera que chez les ostéichtyens, étant par ailleurs leur synapomorphie principale.
Les principales synapomorphies des chondrichthyens incluent une couche de cartilage calcifié prismatique et, chez les mâles, les nageoires pelviennes portent des claspers pelviens (organes servant à l'accouplement)[2].
Poissons osseux (Ostéichtyens au sens classique)

Comme leur nom l'indique, l'innovation la plus notable des poissons osseux est l'os. Le tissu osseux périchondral qui renforçait certains cartilages se généralise, et conduit à deux types d'os d'origines différentes :
- l'os enchondral (associé au mésoderme), qui remplace au cours du développement les pièces cartilagineuses du squelette interne ;
- surtout, l'os dermique, qui se forme à partir du derme (d'origine mésodermique), apparaît. Il donne les os de la boîte crânienne et les ceintures scapulaires, ainsi que les rayons des nageoires (qui évolueront ultérieurement en membres).
On observe aussi la présence de sacs aériens connectés au tube digestif qui donneront les poumons des vertébrés terrestres et les vessies natatoires des Actinoptérygiens. Ces sacs aériens sont soupçonnés chez certains Gnathostomes fossiles. Les tentatives d'émancipation du milieu aquatique seraient alors apparues dans ce clade.
Les principales fonctionnalités évolutives explorées au niveau des poissons osseux sont l'articulation de la mâchoire, de plus en plus structurée, et la forme et la mobilité des nageoires.
Poisson à nageoires charnues

On peut par exemple compter comme poissons à nageoires charnues (sarcoptérygiens) les cœlacanthes, les dipneustes ou encore les tétrapodes. Plusieurs innovations se retrouvent dans ce groupe :
- le membre monobasal : l'attache basale se réduit à un seul élément (fémur, omoplate et humérus) et des muscles permettent l'articulation indépendante des rayons (doigts) ;
- les dents se couvrent d'émail.
Il apparait donc évident, vu les membres de ce groupe, que pour rendre holophylétique le groupe des poissons (c'est-à-dire pour qu'il contienne tous les descendants de son dernier ancêtre commun, et donc le considérer valide du point de vue cladiste), il faudrait y inclure tous les vertébrés terrestres dont les humains font évidemment partie. Certains évolutionnistes ont souligné que l'idée d'appeler l'homme un poisson était absurde et qu'il était donc préférable d'accepter comme valides les groupes paraphylétiques[23].
Morphologie et anatomie
Aspect général
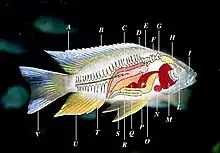
A Nageoire dorsale B Rayon
C Ligne latérale D Rein
E Vessie natatoire F Appareil de Weber
G Oreille interne H Cerveau
I Narine L Orbite
M Branchie N Cœur
O Estomac P Vésicule biliaire
Q Rate R Gonades
S Nageoire ventrale ou pelvienne (par paire)
T Colonne vertébrale U Nageoire anale
V Nageoire caudale.
.svg.png.webp)
1 Opercule
2 Ligne latérale
3 Nageoire dorsale
4 Nageoire molle ou adipeuse
5 Pédoncule caudal ou queue
6 Nageoire caudale
7 Nageoire anale
8 Photophores
9 Nageoire ventrale ou pelvienne (par paire)
10 Nageoire pectorale (par paire)
Épiderme

Les cellules épidermiques sont toutes vivantes, éliminations sans modification elles tombent. Peu épais (5 -9 couches cellulaires), il y a des échanges osmotiques et ioniques.
Certains poissons pélagiques développent sur leur épiderme une coloration à fort contraste dorso-ventral. L'interprétation la plus classique est qu'il s'agirait d'une coloration cryptique permettant une sorte de camouflage anti-prédateur baptisée ombre inversée : la coloration sombre dorsale leur permet de se confondre avec les fonds marins et les rend moins visibles d'un prédateur aviaire ; la coloration blanche du ventre aurait une valeur adaptative, en les rendant moins visibles d'un prédateur venant des profondeurs (requin, thon) qui est ébloui par la luminosité des rayons solaires (confusion avec la lumière ambiante à travers la fenêtre de Snell)[24].
Nageoires

La plupart des poissons se déplacent en contractant alternativement les muscles insérés de chaque côté de la colonne vertébrale. Ces contractions font onduler le corps de la tête vers la queue. Lorsque chaque ondulation atteint la nageoire caudale, la force propulsive créée pousse le poisson vers l'avant.
Les nageoires du poisson sont utilisées comme stabilisateurs. La nageoire caudale sert aussi à augmenter la surface de la queue, augmentant ainsi la poussée lors de la nage, et donc la vitesse. Le corps fuselé des poissons permet de diminuer les frictions lorsqu'ils nagent, et donc d'éviter qu'ils soient ralentis par la résistance de l'eau. De plus, leurs écailles sont enrobées d'un mucus qui diminue les frottements.
Alimentation
Presque toutes les formes d'alimentation sont observées chez les poissons, mais les modes parasitaires semblent rares ou inexistants (la lamproie n'est pas un poisson au sens taxonomique le plus restrictif du terme). Le régime alimentaire d'une espèce mal connue ou nouvellement découverte peut être étudié par des analyses du contenu stomacal et des analyses isotopiques.
Des cailloux, microplastiques, et parfois du sédiment et des os ou écailles de poissons sont souvent trouvés dans les estomacs de poissons (une étude ayant porté sur 5 000 estomacs de poissons appartenant à plus de 70 espèces démersales différentes, échantillonnés à intervalles bathymétriques de 250 m au nord-est de l'océan Atlantique, à des profondeurs allant de 500 à 2 900 m[25]. Des cailloux ou graviers n'ont été trouvés que dans les estomacs de poissons pêchés à 500–1000 m de profondeur (taux : 4,6 % à 500 m de profondeur, 1,1 % à 750 m et 1,3 % à 1 000 m[25]. Des sédiments étaient présents dans 9 % des estomacs et des écailles chez 7 % des poissons, des estomacs avec des contenus. Sédiments et échelles co-produite dans l'estomac des poissons d'alimentation principalement benthopélagiques[25].
Écologie et comportement
Comportement social

De nombreuses espèces de poissons, tels les demoiselles (Pomacentridés), les poissons-zèbres (Cyprinidés) ou les néons (Characidés), etc. ont un instinct grégaire et préfèrent vivre en bancs. D'autres, tels les requins, sont plutôt solitaires. Certains sont même si agressifs que la rencontre d'un congénère peut entraîner la mort de l'un d'eux après une rude bataille : c'est le cas du combattant du Siam (Anabantidés) chez les mâles. La plupart des poissons sont ovipares : la femelle dépose ses ovules et le mâle les féconde, de manière externe ; cependant certains poissons sont ovovivipares, comme de nombreux requins, et il y a alors une accouplement avec fécondation interne. Certains s'occupent de leurs œufs ou de leurs petits (protégés dans la bouche des parents chez certaines espèces comme celles de la famille des Apogonidae, ou dans une poche ventrale du mâle chez les hippocampes) et d'autres (qui pondent beaucoup plus d’œufs) abandonnent leurs œufs à leur sort, dans l'eau ou sur un support.
Dans les années 2010, des études scientifiques relèvent chez plusieurs espèces une sensibilité et des comportements sociaux plus complexes qu'imaginés jusqu'alors[26].
Par exemple, des raies manta ont démontré des comportements associés avec la conscience de soi. Placés dans un test du miroir, les individus ont démontré un comportement inhabituel, apparemment destiné à vérifier si le comportement de leur reflet correspond toujours à leurs propres mouvements[27].
Des labres nettoyeurs ont également passé le test du miroir dans une expérience indépendante, réalisée en 2018[28] - [29].
Des cas d'usages d'outils chez les poissons ont également été mentionnés, notamment chez des poissons de la famille des choerodons, ceux du genre Toxotes et chez la morue de l'Atlantique[30].
En 2019, des chercheurs ont démontré que les Amatitlania siquia, une espèce de poisson monogame, développent une attitude pessimiste quand ils sont privés de la présence de leur partenaires[31] - [32].
Cycles
La plupart des poissons ont un cycle nycthéméral (et dorment la nuit[33], en pleine eau ou posés sur un substrat, parfois couchés sur le flanc) et saisonnier. Certains ont une activité plutôt nocturne. De nuit, en aquarium comme dans la nature, certains poissons changent de couleur[33] - [34]. Des changements électriques du cerveau passant en phase de sommeil ou d'éveil montrent ces changements (8–13 Hz dans le noir, 18–32 Hz à la lumière chez la morue) proches de ceux observées chez les mammifères[33].
Migration des poissons
La migration est un phénomène instinctif[35] présent chez de nombreuses espèces de poissons. Peu de poissons sont absolument sédentaires, hors quelques espèces coralliennes ou vivant dans des eaux fermées. La plupart des espèces marine et de rivière, accomplissent (individuellement ou de manière grégaire) des déplacements saisonniers ou migratoires.
Beaucoup de poissons migrent de manière cycliquement régulière (à l'échelle du jour ou de l'année), sur des distances de quelques mètres à des milliers de kilomètres, en relation avec les besoins de reproduction ou en nourriture, les conditions de température ; dans certains cas, le motif de la migration n'est pas connu.
Contribution des poissons aux puits de carbone
À partir du dioxyde de carbone dissous dans l'eau, les poissons marins produisent constamment dans leur intestin des carbonates peu solubles.
Par exemple, le flet européen synthétise et rejette chaque heure et en moyenne 18 micromoles de carbone par kg de poisson (sous forme de calcite)[1]. Les poissons contribueraient ainsi de 3 %[36] à 15 %[37] du puits de carbone océanique (voire 45 % si l'on prenait les hypothèses les plus « optimistes »)[1]. De plus, les poissons ont une marge de tolérance à la température[38] et un climat chaud associé à la surpêche tendent à réduire le nombre de grands poissons ; or, une petite taille du poisson et une eau plus chaude favoriseraient cette formation de carbonates de calcium ou de magnésium (qui sont éliminés avec la nécromasse, les fèces ou des boulettes de mucus)[1].
Hélas, ces carbonates plus riches en magnésium sont aussi plus solubles à grande profondeur. Ils peuvent alors relarguer une partie de leur carbone, mais en tamponnant le milieu, au point que cela pourrait expliquer jusqu'à un quart de l'augmentation de l'alcalinité titrable des eaux marines dans les 1 000 mètres sous la surface (cette anomalie de dureté de l'eau était jusqu'ici controversée car non expliquée par les océanographes)[1].
Hélas encore, c'est aussi dans les zones les plus favorables à ce piégeage du carbone (plateaux continentaux où se concentre environ 80 % de la biomasse en poisson) que la surpêche est la plus intense et que les zones mortes ont fait disparaître le plus de poissons.
Les poissons et l'Homme
Utilisation alimentaire
Le poisson est un aliment consommé par de nombreuses espèces animales, dont l'Homme. Le mot poisson désigne donc aussi un terme de cuisine faisant référence à l'ensemble des aliments préparés à partir de poissons capturés par le biais de la pêche ou de l'élevage. Trois quarts de la planète Terre sont couverts d'eau et de nombreuses rivières sillonnent l'intérieur des terres, ce qui fait que le poisson a fini par constituer, depuis la nuit des temps, une partie importante du régime alimentaire des humains dans presque tous les pays du monde.
Surpêche

Pour les poissons comestibles comme la morue et le thon, la menace principale est la surpêche[39] - [40]. Lorsque la surpêche persiste, elle finit par causer une diminution de la population de poissons (le « stock ») car les individus ne peuvent pas se reproduire assez vite pour compenser la perte due à la pêche. Un exemple de surpêche catastrophique très étudié est celui de la sardine du Pacifique (Sadinops sagax caeruleus), qui était pêchée près des côtes de Californie. Le maximum avait été atteint en 1937 avec 790 000 tonnes, puis la quantité pêchée a décru pour atteindre à peine 24 000 t en 1968, date à laquelle cette industrie s'arrêta faute d'être rentable. Une telle « extinction commerciale » ne veut pas dire que l'espèce elle-même est éteinte, mais seulement qu'elle n'est plus économiquement viable[41]. La pêche minotière a également localement conduit à la surpêche.
La principale source de tension entre l'industrie de la pêche et la science halieutique est la recherche d'un équilibre entre la conservation des espèces pêchées, et la préservation du revenu des pêcheurs. Dans des zones comme l'Écosse, Terre-Neuve ou l'Alaska, où l'industrie des pêches est le principal employeur, le gouvernement est particulièrement impliqué dans cet équilibre[42], en maintenant à la fois un stock suffisant et des ressources suffisantes pour les pêcheurs. D'un autre côté, les scientifiques promeuvent une protection toujours accrue pour les stocks, en prévenant que de nombreux stocks pourraient disparaitre dans les cinquante prochaines années[43].
Selon le WWF, « 80 % des stocks mondiaux de poissons utilisés à des fins commerciales sont déjà surpêchés ou menacés de l’être. Par ailleurs, 40 % de tous les animaux marins capturés finissent comme prises accessoires et sont rejetés morts ou moribonds par-dessus bord. Et comme le poisson d’élevage est le plus souvent nourri avec de l’huile de poisson et/ou de la farine de poisson, les élevages contribuent également au pillage des mers »[44].
Pollution de l'eau, des sédiments et destruction des habitats
_(13587504875).jpg.webp)
Les poissons sont notamment vulnérables à de nombreux polluants (plomb, mercure et autres métaux, insecticides... ) et à des problèmes de féminisation (imposex) induits par des perturbateurs endocriniens[45].
Une des menaces sur les écosystèmes (marins et d'eau douce) est la dégradation physique, chimique et écologique des habitats ; celle-ci est causée par la pollution de l'eau, la construction de grands barrages, le réchauffement, l'eutrophisation, l'acidification et la baisse du niveau d'eau par les activités humaines, et doivent faire face à la concurrence et aux pathogènes d'espèces introduites[46]. Un exemple de poisson en danger à cause d'un habitat modifié est l'Esturgeon blanc, vivant dans les cours d'eau en Amérique du Nord, ceux-ci ayant été modifiés de différentes manières[47].
Espèces exotiques envahissantes

L'introduction d'espèces exotiques dont beaucoup sont devenues invasives s'est produite à de nombreux endroits et pour de nombreuses raisons, dont le ballastage des navires de commerce. Un exemple bien connu et étudié est l'introduction de la perche du Nil dans le lac Victoria. À partir des années 1960, la perche du Nil introduite pour la pêche a progressivement exterminé les 500 espèces de cichlidés que l'on ne trouvait nulle part ailleurs que dans ce lac ; certaines espèces ne survivent que grâce à des programmes de reproduction en captivité, mais d'autres sont probablement éteintes[48]. Parmi les espèces de poissons invasives ayant causé des problèmes écologiques, on peut noter les carpes, les tête-de-serpent, les tilapias, la perche européenne, la truite fario, la truite arc-en-ciel ou la lamproie marine.
Conservation

Statut de préservation
En 2006, la liste rouge de l'UICN comprenait 1 173 espèces de poissons menacées d'extinction[49]. Cette liste incluait des espèces comme la morue de l'Atlantique, le Cyprinodon diabolis, les cœlacanthes ou le grand requin blanc. Comme les poissons vivent sous l'eau, ils sont plus compliqués à étudier que les animaux terrestres ou les plantes, et on manque toujours d'informations sur les populations de poissons. Les poissons d'eau douce semblent particulièrement menacés, car ils vivent souvent dans des zones restreintes.
Mesures de protection
On cherche à établir des indicateurs ou indices de biodiversité en poissons, notamment pour les milieux d'eau douce, lacs[50] et mares y compris.
Vers un usage éthique des poissons
De nombreuses études ont porté sur la douleur[51] - [52] - [53] la souffrance[54] - [55], l’évitement de la douleur[56] - [57], la peur[58] - [59] telle que perçue par les poissons, sur la composante d’affectivité ou de personnalité qu’ils expriment[60], des états apparentés à des émotions[61], ou sur leur bien-être en pisciculture[62] - [63] ou en aquarium, avec des conclusions parfois opposées. Ces questions ont des enjeux juridiques et éthiques car les pays développés tendent à introduire de l’éthique animale et environnementale dans leurs législations (par ex en Suisse depuis 2005 : « personne ne doit de façon injustifiée causer à des animaux des douleurs, des maux ou des dommages, les mettre dans un état d’anxiété ou porter atteinte à leur dignité d’une autre manière. Il est interdit de maltraiter les animaux, de les négliger ou de les surmener inutilement », tout comme sont interdites « les autres pratiques sur des animaux qui portent atteinte à leur dignité »[64]).
Depuis les années 1980 les indices d’un stress et d’une perception de la douleur s’accumulent et les poissons, qui sont de moins en moins considérés comme des machines biologiques qui ne seraient animées que par des réflexes simples. Ils disposent comme nous de deux types d’axones (fibres A delta et fibres C) impliqués dans la nociception, et la douleur affecte leurs capacités mémorielles et d'apprentissage[65]. La morphine supprime la perception de la douleur chez le poisson (comme chez l'escargot)[66]. L’étude de leurs capacités cognitives[67], de mémorisation et d’apprentissage[68] - [69] conduit à des conclusions similaires.
On distingue généralement la nociception[70] - [71] (inconsciente, qui désigne un stimulus douloureux remonté vers le cerveau) de la « perception douloureuse ». James Rose considère que les cerveaux d’animaux sans néocortex (cas du poisson) n’auraient pas de vraie perception (consciente) de la douleur et que le comportement du poisson ne serait que réflexe. « Posséder des nocicepteurs est une condition nécessaire mais pas forcément suffisante pour ressentir la douleur » rappelle Jean-Marc Neuhaus qui ajoute qu’on ignore à quel moment (ou quels moments) de l’évolution la sensibilité à la douleur et son importance évolutive ; il est possible que des poissons des espèces éloignées des mammifères perçoivent la douleur via des mécanismes internes différents de ceux des mammifères.
En 2014 après une revue de la littérature scientifique puis des débats entre ses membres, tout en restant prudente et en reconnaissant l’absence de certitudes, la Commission fédérale d'éthique pour la biotechnologie dans le domaine non humain (CENH, sise en Suisse ; pays où l’art. 120 de la Constitution fédérale impose une prise en compte de la dignité de la créature) a conclu qu’il «est difficile de dénier toute sensibilité à la douleur au moins à certains poissons» ; il n y a «aucune bonne raison de conclure que les poissons seraient insensibles» à la douleur.. Un rapport rendu public à Berne par la commission invite les pêcheurs, éleveurs et chercheurs à «utiliser les poissons avec attention et respect», ces animaux devant «faire l’objet d’un respect moral indépendant de leur utilité pour l’être humain»[72].
Mais ces résultats ont été tempérés par d'autres études dont celle de James Rose (Université du Wyoming) qui, en 2012 dans la revue Fish and Fisheries, estimait que les poissons ne peuvent pas ressentir quoi que ce soit car dépourvus des structures nerveuses adéquates. Les réactions observées par certaines études relèveraient non pas de la douleur, mais de la nociception, c’est-à-dire de seuls réflexes[72].
La CENH recommande une utilisation plus « éthique » des poissons, en limitant la souffrances des poissons pêchés, qui souffrent de décompression, meurent par asphyxie et souvent après de multiples traumatismes[72]. Elle invite aussi les pisciculteurs à mieux tenir compte des besoins de chaque espèce, et elle souhaite que la pêche à la ligne soit soumise à une attestation de compétence[72]. Elle invite aussi à interdire - de manière générale - l’utilisation des poissons à des fins de bien-être (Fish pedicure)[72].
Records
Taille
Le Paiche d'Amazonie, ou Arapaïma, est le plus gros poisson dulçaquicole : il peut atteindre 4,5 m et 200 kg. Le plus gros poisson connu est le requin-baleine (16 m, 10 t).
Selon les Proceedings of the Royal Society (janvier 2006), le plus petit poisson serait Paedocypris progenetica, un cyprinidé d'eau douce découvert par Maurice Kottelat et Tan Heok Hui, du Raffles Museum (Singapour). La femelle Paedocypris est mature à partir de 7,9 mm de long. Adultes, les femelles mesurent 10,3 mm et les mâles, 11,4 mm. Il détrône un gobie nain de l'océan Indien décrit en 1981, Trimmatom nanus, adulte à 8 mm. Un poisson du même genre, Paedocypris micromethes, légèrement plus grand (femelle adulte à partir de 8,8 mm), a été identifié à Sarawak. Ces poissons vivent dans les forêts marécageuses constituées d'arbres inondés poussant sur un sol de tourbe détrempée, mou et épais de plusieurs mètres. L'eau y est rouge sombre et très acide.
Selon une équipe de l'université de Washington, Photocorynus spiniceps est le plus petit vertébré connu : le mâle de cette espèce de baudroie de la famille des Linophrynidae, découverte dans les abysses du large des Philippines, long de seulement 6,2 mm, vit en parasite sur le dos d'une femelle mesurant 46 mm. Celle-ci pourvoit aux besoins en nourriture d'un mâle ne se limitant pratiquement qu'à un appareil reproducteur (Pietsch et al., Ichtyological Research, 2005[73]).
Si le mâle Photocorynus spiniceps est plus petit, notons que Paedocypris progenetica détient, en moyenne mâle-femelle, le record du plus petit poisson connu (même s'il n'est plus le plus petit vertébré depuis la description en 2012 de la grenouille Paedophryne amauensis[74]).
Puissance
Dunkleosteus terrelli, un poisson marin à plaques cuirassées qui vivait il y a 400 Ma, mesurait jusqu'à 11 m de long et pouvait peser jusqu'à quatre tonnes. Après en avoir reconstitué la musculature, des scientifiques américains ont découvert en 2006 que les mâchoires de ce poisson étaient capables d'exercer une pression de 5 500 kg/cm2, soit à peu près deux fois celle de l'actuel requin blanc et autant que la mâchoire d'un Tyrannosaurus. De surcroît, on estime que Dunkleosteus terrelli était capable d'ouvrir et de refermer sa gueule en un cinquantième de seconde (Philip Anderson et Mark Westneat, 2006).
Annexes
Articles connexes
- Ichtyologie
- Chordata, Gnathostomata et articles subséquents
- Hypoxie chez les poissons
- Liste de poissons
- Liste d'articles sur les poissons
- Poisson dans la culture
- Poisson (aliment)
- Pêche (halieutique)
- Pêche minotière
- Reproduction des poissons
- Liste de préparations à base de poisson
- Liste de poissons de fiction
Bibliographie
- Edward C. Migdalski et George S. Fichter (trad. Charles Roux, ill. Norman Weaver), Les Poissons du monde, Paris, Odège, , 316 p. (ISBN 2-245-01149-X et 9782245011492)
- Karel Pivnicka et Karel Cerny, Poissons, Paris, Nathan, , 304 p. (ISBN 2-7000-1518-5)
- John R. Paxton, William N. Eschmeyer et J.-J. Vayne (trad. Marc Baudoux), Les poissons, Bordas, coll. « Encyclopédie des animaux », (ISBN 2-04-027019-1)
- (en) J. S. Nelson, Fishes of the World, John Wiley & Sons, (ISBN 0-471-25031-7)
- (en) G. Helfman, Collette B. et D. Facey, The Diversity of Fishes, Malden, Mass. etc., Blackwell Publishing, , 528 p. (ISBN 0-86542-256-7)
- (en) BP, Helfman Keck, ZH, Marion, DJ, Martin, JC, Kaufman, CP, Harden, JS, Schwartz et RJ. Strange, Fish functional traits correlated with environmental variables in a temperate biodiversity hotspot, PLoS One, 2014 (mar 27) (présentation en ligne)
Liens externes
- Notices dans des dictionnaires ou encyclopédies généralistes :
- Ressources relatives au vivant :
- (en) Australian Faunal Directory
- (en) Plazi
- (en) World Register of Marine Species
- (en) ZooBank
- (fr) (en) FishBase, la base de données sur les poissons
- Bibliothèque d'Ichtyologie du Muséum national d'Histoire naturelle
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Fish » (voir la liste des auteurs).
- R.W. Wilson, F.J. Millero, J.R. Taylor, P.J. Walsh, V. Christensen, S. Jennings et M. Grosell, « Contribution of Fish to the Marine Inorganic Carbon Cycle », Science, vol. 323, no 5912, , p. 359-362 (DOI 10.1126/science.1157972)
- Guillaume Lecointre et Hervé Le Guyader, Classification phylogénétique du vivant, 3e édition, 2001, Belin, Paris.
- (fr)Aubert D. (2017). Classer le vivant. Les perspectives de la systématique évolutionniste moderne. Ellipses.
- Belon P., (1555) La nature et la diversité des poissons avec leurs pourtraicts représentés au plus près du naturel. Estienne, Paris, 448 p.
- « Poisson », dans le Dictionnaire de l'Académie française, sur Centre national de ressources textuelles et lexicales (sens 1) [consulté le 17 septembre 2017].
- Informations lexicographiques et étymologiques de « poisson » (sens A, en part. 1) dans le Trésor de la langue française informatisé, sur le site du Centre national de ressources textuelles et lexicales [consulté le 17 septembre 2016].
- Entrée « poisson » des Dictionnaires de français [en ligne], sur le site des éditions Larousse [consulté le 17 septembre 2017].
- Joseph S. Nelson, Fishes of the World, John Wiley & Sons, 2006, (ISBN 0471250317).
- Helfman, Collette et Facey, op. cit., p. 83-86.
- Helfman, Collette et Facey, op. cit., p. 103.
- Helfman, Collette et Facey, op. cit., p. 53-57.
- Helfman, Collette et Facey, op. cit., p. 33-36.
- R. Froese et D. Pauly (éds.), Species Summary: Periophthalmus barbarus, FishBase [lire en ligne].
- G. Helfman, B. Collette et D. Facey, The Diversity of Fishes, Blackwell Publishing, p. 3, 1997 (ISBN 0-86542-256-7)
- Tree of life web project - Chordates.
- Acanthoweb, site de l'équipe de Phylogénie Systématique et Évolution du MNHN - .
- J. S. Nelson, Fishes of the World, John Wiley & Sons, p. 4-5, 2006 (ISBN 0471250317)
- David C Hardie, Paul DN Hebert (2004), Genome-size evolution in fishes ; Canadian Journal of Fisheries and Aquatic Sciences, 2004, 61(9): 1636-1646, 10.1139/f04-106 (résumé)
- S.T. Jarnagin, B.K. Swan et W.C. Kerfoot, « Fish as vectors in the dispersal of Bythotrephes cederstroemi: diapausing eggs survive passage through the gut », Freshwater Biology, vol. 43, , p. 579–589.
- (en)Janvier, P. (2015). Facts and fancies about early fossil chordates and vertebrates. Nature 520: 483-489 (doi: 10.1038/nature14437).
- (fr)Lecointre, G., Le Guyader, H. (2017). La classification phylogénétique du vivant – Tome 2 – 4e édition. Belin.
- B.F. Eames et al., « Skeletogenesis in the swell shark Cephaloscyllium ventriosum », J Anat, vol. 210, no 5, , p. 542–554.
- R. K. Brummitt, « Am I a bony fish? », Taxon, vol. 55, no 2, , p. 268-269
- (en) G. D. Ruxton, M. P. Speed & D. J. Kelly, « What, if anything, is the adaptive function of countershading? Animal Behaviour », Anim. Behav, vol. 68, no 3, , p. 445–451 (DOI 10.1016/j.anbehav.2003.12.009).
- Mauchline, J., & Gordon, J. D. M. (1984). Occurrence of stones, sediment and fish scales in stomach contents of demersal fish of the Rockall Trough. Journal of fish biology, 24(4), 357-362 (résumé).
- « CIWF et L214 révèlent la cruauté des conditions d’élevage des poissons », Le Monde.fr, , p. 167-174 (lire en ligne, consulté le )
- (en) Csilla Ari et Dominic P. D’Agostino, « Contingency checking and self-directed behaviors in giant manta rays: Do elasmobranchs have self-awareness? », Journal of Ethology, , p. 167-174 (DOI 10.1007/s10164-016-0462-z, lire en ligne).
- (en) Masanori Kohda, Takashi Hotta, Tomohiro Takeyama, Satoshi Awata, Hirokazu Tanaka, Jun-ya Asai et L. Alex Jordan, « Cleaner wrasse pass the mark test. What are the implications for consciousness and self-awareness testing in animals? », PLOS Biology, (DOI 10.1371/journal.pbio.3000021, lire en ligne).
- (en) Hannah Devlin, « Scientists find some fish can ‘recognise themselves’ in mirror », sur the Guardian, .
- (en) Jonathan Balcombe, « Fishes Use Problem-Solving and Invent Tools », sur Scientific American, .
- François-Xavier Dechaume-Moncharmont et Anne-Lise Santoni, « Peine de coeur dans l'aquarium : le chagrin d'amour rend les poissons pessimistes », sur INEE,
- (en) Chloé Laubu, Philippe Louâpre et François-Xavier Dechaume-Moncharmont, « Pair-bonding influences affective state in a monogamous fish species », the Royal Society, vol. 286, no 1904, (lire en ligne)
- Marshall, N. B. (1972). Sleep in fishes. Proceedings of the Royal Society of Medicine, 65(2), 177 (résumé)
- Verrill A.E (1897) Nocturnal and diurnal changes in the colors of certain fishes and of the squid (Loligo), with notes on their sleeping habits. American Journal of Science, 4(14), 135.
- Fontaine, M. (1954). Du déterminisme physiologique des migrations. Biological Reviews, 29(4), 390-418. (résumé).
- …si l'on estime qu'il y a 812 millions de t de poissons dans les mers (fourchette basse)
- …si l'on estime qu'il y a 2,05 milliards de tonnes (fourchette haute crédible)
- L. Tissot et Y. Souchon, « Synthèse des tolérances thermiques des principales espèces de poissons des rivières et fleuves de plaine de l’ouest européen », Hydroécol. Appl., vol. 17, , p. 17 (DOI 10.1051/hydro/2010004, lire en ligne [PDF])
- « Call to halt cod 'over-fishing' », BBC News, (lire en ligne)
- « Tuna groups tackle overfishing », BBC News, (lire en ligne).
- Helfman, Collette et Facey, op. cit., p. 462.
- « UK 'must shield fishing industry' », BBC News, (lire en ligne)
- Stanford University, Ocean study predicts the collapse of all seafood fisheries by 2050, 2006 [lire en ligne].
- [PDF]WWF, « Guide d'achat, poissons et fruits de mer », sur wwf.ch (consulté le )
- Kime, D. E. (2012). Endocrine disruption in fish. Springer Science & Business Media
- Helfman, Collette et Facey, op. cit., p. 463.
- Threatened and Endangered Species: Pallid Sturgeon Scaphirhynchus Fact Sheet, Natural Resources Conservation Service, United States Department of Agriculture, 2005 [lire en ligne].
- Laura Spinney, « The little fish fight back », The Guardian, (lire en ligne).
- Table 1: Numbers of threatened species by major groups of organisms (1996–2004) [lire en ligne].
- L. Launois et C. Argillier, « Intérêts et limites d’une approche par type de milieu pour le développement d’un indice poisson lacustre français », Hydroécol. Appl., , p. 111 (DOI 10.1051/hydro/2010005, lire en ligne)
- Braithwaite V (2010). Do fish feel pain ? Oxford University Press
- ROSE, J. D. et al. (2012). Can fish really feel pain ? Fish and Fisheries, 1-37.
- SNEDDON L. U. et al. (2003). Novel object test. Examining nociception and fear in the rainbow trout. Journal of Pain 4, 431-40.
- CHANDROO K. P. et al (2004). Can fish suffer ? Perspectives on sentience, pain, fear and stress. Applied Animal Behaviour Science 86, 225-50
- SNEDDON, L. U. (2009). Pain perception in fish. Indicators and endpoints. ILAR J. 50, 378-86.
- DUNLOP, R. S. et al. (2006). Avoidance learning in Goldfish (Carassius auratus) and Trout (Oncorhychus mykiss) and implications for pain perception. Applied Animal Behaviour Science 97, 255-71.
- SNEDDON L. U. (2003). The evidence for pain in fish. The use of morphine as analgesic. Applied Animal Behavoiur 83, 153-62.
- BRAITHWAITE V. A., BOULCOTT, B. (2007). Pain and fear in fish. Diseases of Aquatic Organisms 75, 131-8.
- YUE, S. et al. (2004). Investigating fear in domestic Rainbow Trout (Oncorhynchus mykiss) using an avoidance learning task. Applied Anial Behaviour Science 87, 343-54
- KALEUFF , A. V. et al. (2012). Time to recognize zebrafish ‘affective’ behaviour. Behaviour 149, 1019-36.
- (an)Cognitive appraisal of environmental stimuli induces emotion-like states in fish, M. Cerqueira, S. Millot, M. F. Castanheira, A. S. Félix, T. Silva, G. A. Oliveira, C. C. Oliveira, C. I. M. Martins & R. F. Oliveira, Scientific Reports, 2017/10/13
- BOVENKERKB.et al. (2013). Fish Welfare in Aquaculture. Explicating the Chain of Interactions Between Science and Ethics. Journal of Agricultural and Environmental Ethics 26, 41-61
- MEIJBOOM F. L. B. et al. (2013), Fish Welfare : Challenge for Science and Ethics – Why Fish Makes the Difference. Journal of Agricultural Environmental Ethics 26, 1-6
- Art. 4 LPA (SR 455, loi fédérale sur la protection des animaux du 16 décembre 2005).
- G Varner (2011), Do Fish Feel Pain? | Environmental Ethics pdcnet.org | extrait
- J Mather (2011) Do Fish Feel Pain? - Journal of applied animal welfare science | Taylor & Francis |résumé
- WILD, M.(2012). Fische. Kognition, Bewusstsein und Schmerz. Eine philosophische Perspektive, EKAH (éd.), volume 10 de la série Contributions à l’éthique et à la biotechnologie.
- BROWN C.et al. (éd.) 2006. Fish cognition and behavior. Blackwell Publishers
- LALAND, K. N. et al. (2003).Learning in fishes : from three second memory to culture. Fish Fisheries 4, 199-202.
- SEGNER, H.(2012). Fish. Nociception and pain. A biological perspective, EKAH (éd.), Volume 9 de la série Contributions à l’éthique et à la biotechnologie.
- SNEDDON L. U. et al. (2003). Do fishes have nociceptors ? Evidence for the evolution of a vertebrate sensory system | Proceedings of the Royal Society B | Biological Sciences 270, 1115-21
- CENH (2014), « Utilisation éthique des poissons », Rapport de la Commission fédérale d’éthique pour la biotechnologie dans le domaine non humain (CENH) ; Confédération suisse ; PDF, 36 p
- (en) Theodore W. Pietsch, « Dimorphism, parasitism, and sex revisited: modes of reproduction among deep-sea ceratioid anglerfishes (Teleostei: Lophiiformes) », Ichthyological Research, vol. 52, no 3, , p. 207–236 (DOI 10.1007/s10228-005-0286-2)
- (en) Eric N. Rittmeyer, Allen Allison, Michael C. Gründler, Derrick K. Thompson et Christopher C. Austin, « Ecological guild evolution and the discovery of the world's smallest vertebrate », PLoS ONE, vol. 7, no 1, , e29797 (DOI 10.1371/journal.pone.0029797, lire en ligne, consulté le )
